Potencialidades no uso do software Avogadro no ensino de Forças Intermoleculares
ISBN 978-85-85905-23-1
Área
Ensino de Química
Autores
Firmino, E.S. (IFCE - CAMPUS FORTALEZA) ; Nojosa, A.C.B. (IFCE - CAMPUS FORTALEZA) ; Guerra, M.H.F.S. (IFCE - CAMPUS FORTALEZA) ; Saldanha, G.C.B. (IFCE - CAMPUS FORTALEZA) ; Vasconcelos, A.K.P. (IFCE - CAMPUS ARACATI) ; Barroso, M.C.S. (IFCE - CAMPUS MARACANAÚ) ; Costa, M.R. (IFCE - CAMPUS MARACANAÚ) ; Sampaio, C.G. (IFCE - CAMPUS MARACANAÚ)
Resumo
No atual contexto tecnológico que se encontra a educação, o uso de Objetos de Aprendizagem (OA) surge como uma alternativa para auxiliar o docente no ensino de Química. Com isso, esse trabalho tem como objetivo principal apresentar as potencialidades de uso do software Avogadro como OA para auxiliar o professor no processo de ensino e aprendizagem de Forças Intermoleculares. O Avogadro, apesar de estar no idioma inglês, tem uma interface bastante interativa, que possibilita ao aluno construir ou inserir moléculas dos mais variados graus de complexidade, que vai desde de uma simples molécula de água a uma sequência de DNA. Pelo exposto, é possível inferir que o software apresenta um grande potencial como ferramenta para auxiliar o professor no processo de ensino.
Palavras chaves
Objeto de Aprendizagem; Ensino de Química; Avogadro
Introdução
Hoje vivemos em um mundo notadamente influenciado pelo avanço tecnológico que impermeia os mais diversos setores da sociedade, e no campo educacional não poderia ser diferente, pois com todo esse acesso à tecnologia o conhecimento está ao alcance de um “click”. O uso de Tecnologias da Informação e Comunicação (TIC) no ensino de ciências, por exemplo, torna-se uma ferramenta a mais para auxiliar o professor, pois permite a demonstração dos conceitos estudados em sala na forma de simulações interativas de fenômenos ou processos, o que facilita a aceitação do conteúdo por parte dos alunos, como demonstra Giordan (2005). A ideia de Giordan é apoiada por Souza, Reis e Linares (2009), que afirmam que o uso de TIC’s e jogos, que possuem como objetivo o uso educacional, despertam o interesse dos alunos pelo campo das ciências. Nesse atual contexto tecnológico em que os professores se encontram, o uso de Objeto de Aprendizagem (OA) surge como uma alternativa para auxiliar o docente no ensino de Química, ciência considerada por muitos alunos como abstrata e difícil compreensão. O conceito de OA surgiu por volta de 1990, no entanto sua utilização continua expressiva devido ao avanço tecnológico já comentado aqui (CARNEIRO; SILVEIRA, 2014). Ainda segundo as autoras, o termo Objetos de Aprendizagem é usado desde o início dos anos 2000 para designar materiais didáticos usados para facilitar o processo de ensino e aprendizagem, sendo a origem desse termo atribuída a Hodgins (2000, 2002). Um OA pode ser criado em qualquer ferramenta, podendo ser simples como uma apresentação de slides ou mais completo como uma simulação (TAROUCO, 2014). Segundo o autor supracitado, definir OA não é tarefa fácil, em vista as variadas possibilidades de uso. “Sua definição surge de acordo com uma concepção própria dos autores acerca da utilidade e importância do Objeto para o ensino e a aprendizagem e varia de acordo com a abordagem proposta e os aspectos que estão associados ao seu uso educacional”, (TAROUCO, 2014, p. 13). Miranda (2004) traz a definição de OA apresentada pelo Learning Technology Standards Committee (LTSC – IEEE) na qual afirma que “OAs podem ser definidos como qualquer entidade, digital ou não-digital, que pode ser usada, reusada ou referenciada durante a aprendizagem suportada pela tecnologia”. Como pode-se observar, a definição é bem ampla, não considerando apenas objetos digitais como sendo OA, mas qualquer entidade suportada pela tecnologia da informação. Também existem definições de OA que se restringem ao meio digital, como a de Wiley (2002) apud Miranda (2004) afirmando que “é qualquer recurso digital que possa ser utilizado para suporte ao ensino”. Apresentadas algumas definições de OA, Braga et al. (2012) trazem as características de qualidade de um Objeto de Aprendizagem, as quais estão listadas a seguir: 1. Habilidades Didático Pedagógicas: O OA deve ser capaz de mostrar ao aluno o objetivo do aprendizado a que se propõe. Sendo esse objetivo alinhado às metas de aprendizagem e características dos alunos. É desejável que o OA forneça feedback suficiente para facilitar o aprendizado do aluno; 2. Disponibilidade: O OA deve ser indexado e armazenado de maneira que possa ser facilmente encontrado; 3. Acessibilidade: O OA pode ser acessado por diferentes dispositivos, diferentes contextos (ex.: velocidade de conexão diferente) e principalmente possuir versão adaptada para diferentes tipos de usuários (deficientes visuais, idosos etc.); 4. Precisão: O OA deve apresentar resultados precisos, dentro do esperado; 5. Confiabilidade: O OA não deve possuir falhas técnicas; 6. Facilidade de instalação (installability): O OA deve ser fácil de ser instalado; 7. Portabilidade: O OA deve funcionar em diversos cenários como: diferentes sistemas operacionais, diferentes ambientes virtuais de Avaliação, diferentes hardwares etc; 8. Interoperabilidade: O OA deve poder de interagir com outros OA ou sistemas; 9. Usabilidade: O OA deve ser fácil de ser utilizado e estar de acordo com os padrões mais consagrados de usabilidade. Com as características apresentada acima, pode-se influir que não é tarefa fácil produzir um OA ou utilizar algum software preexistente de moda que ele ganhe a função de OA. Não obstante, utilizando a metodologia certa é possível se adequar para que o OA possa ter o maior número de características possível. Com isso, esse trabalho tem como objetivo apresentar as potencialidades de uso do software Avogadro como Objeto de Aprendizagem para auxiliar o professor no processo de ensino aprendizagem de Forças Intermoleculares, que faz parte do componente curricular de Química.
Material e métodos
Devido ao desenvolvimento tecnológico e consequente uso do computado na escola, “os modelos de educação com suas teorias de aprendizagem têm passado do paradigma tradicional/instrucionista para o paradigma construtivista/construcionista” como aponta Sales (2005, p. 18). O autor ainda apresenta uma síntese das características instrucionistas e construcionistas no campo educacional com relação ao uso de TIC’s. O ensino baseado no modelo construcionista dá-se no sentido Aluno-Software-Computador e tem como objetivo ensinar de forma a obter a maior aprendizagem com o mínimo de ensino. Em contrapartida, o modelo instrucionistas dá-se no sentido Computador-Software-Aluno, ou seja, o estudante passa a ser um receptor das informações disponibilizadas pelo equipamento utilizado. Com isso, a escolha do software Avogadro se deu pelo fato de que ele possibilita a utilização do modelo construcionista, pois o estudante necessita alimentá-lo com informações para poder obter resposta aos problemas propostos. Avogadro é, como define o próprio site, um avançado editor e visualizador de moléculas projetado para uso entre plataformas em química computacional, modelagem molecular, bioinformática, ciência de materiais e áreas relacionadas. Logo, percebe-se que seu uso é muito amplo, passeando por diversas áreas das ciências, no entanto, seu uso no campo educacional é promissor, pois permite ao aluno simular e observar fenômenos antes vistos somente na teoria. Mesmo sendo possível utilizar em diversas áreas da Química, foi escolhido para esse trabalho focar no uso para o conteúdo de Forças Intermoleculares e mostrar as ferramentas que podem ser exploradas. O download do software foi realizado no site <https://avogadro.cc/>, é gratuito e de código aberto, com arquivo em tamanho aproximado de 10,8 megabyte (MB) e após instalado, 33,4 MB. Foi testando em um notebook Positivo Master utilizando o sistema operacional Microsoft Windows 7 Professional equipado com processador Intel® Core™ i5-2450M, CPU de 2,50 GHz e memória RAM de 4 gigabyte (GB). As ferramentas utilizadas para demonstrar as Forças intermoleculares de diferentes moléculas (água, etanol, metanol, etc.) funcionaram perfeitamente. Ele está no idioma inglês, no entanto, esse fator não interfere na interação com o software.
Resultado e discussão
Antes de entrarmos de fato na explicação do funcionamento do software, será apresentado um resumo sobre Forças Intermoleculares.
Forças Intermoleculares (FI) podem ser definidas como aquelas que atuam entre as moléculas, diferente das intramoleculares (entre os átomos), e são responsáveis por manter moléculas unidas nas mais diferentes formas e compostos que conhecemos, com força de interação variando muito, mas que em comparação com ligações iônicas e covalentes são baixíssimas (BROWN; LEMAY; BURSTEN, 2005). Por exemplo, são necessário 16 kJ/mol para vencer a atração entre duas moléculas de ácido clorídrico (HCl). Em contrapartida, para separar a molécula em átomos de hidrogênio (H) e cloro (Cl) são necessários 431 kJ/mol. As FI’s influenciam as propriedades químicas dos compostos de muitas formas: pontos de fusão, pontos de ebulição, e são, inclusive, cruciais na formação de moléculas biológicas importantes como DNA e RNA, que só existem como as conhecemos pela atuação das ligações de hidrogênio, um tipo de FI.
Brown, Lemay e Bursten (2005) apresentam três tipos de interações entre moléculas neutras: forças dipolo-dipolo, forças de dispersão de London e forças de pontes de hidrogênio; e um tipo de interação entre uma espécie carregada e uma neutra: íon-dipolo. Todas essas interações são de natureza eletrostática, que são atrações entre espécies positivas e negativas.
Forças íon-dipolo acontecem entre um íon e uma carga parcial de um extremo de uma molécula polar. As moléculas polares, por sua vez, são dipolos, possuem uma extremidade com carga parcialmente positiva (com deficiência de elétrons) e outra com carga parcial negativa (abundância de elétrons). Nas forças dipolo-dipolo, duas moléculas neutras polares se atraem quando a parte “negativa” de uma se encontra com a parte “positiva” de outra. As forças de dispersão de London acontecem entre moléculas normalmente apolares, o que de início pensou-se que fosse impossível. A partir daí o cientista Fritz London propôs esse tipo de interação em 1930. A ponte de hidrogênio é um tipo especial de interação que existe entre um átomo de hidrogênio de uma ligação polar (exclusivamente na ligação entre H-F, H-O ou H-N) com um par eletrônico desemparelhado de um grupo de elementos em específico: flúor (F), oxigênio (O) ou nitrogênio (N). Na Figura 1 é possível observar exemplos de cada um dos tipos de FI apresentadas aqui, retiradas diretamente do Avogadro.
Agora, apresentado brevemente o conceito de FI, será explorado o software. Ao iniciar a aplicação, ele abre uma interface com um espaço dedicado a criação ou inserção de moléculas ou estruturas diversas (DNA, RNA, nano tubos de carbono, etc.) com um painel de opção ao lado esquerdo e uma barra de menus posicionada na parte superior, como pode-se observar na Figura 2(a). Dentre as ferramentas dispostas na parte superior, uma delas é a “Draw Tool”, em que ao clicar, abre ao lado esquerdo a opção de inserir átomos, com a sugestão de alguns mais conhecidos ou a possibilidade de consultar diretamente na Tabela Periódica, dando início à criação de moléculas. Ele possui a opção de inserir os átomos de hidrogênio (H) manualmente ou automaticamente para completar as valências restantes, pois o software reconhece os números de ligações que cada elemento realiza. Após a construção ou inserção de moléculas, é possível fazer uma série de cálculos desse sistema: cálculos das interações, momento dipolo, visualização das distâncias entre os átomos, densidade eletrônica na superfície da molécula, etc. A opção de visualizar a densidade eletrônica no entorno da molécula é de grande relevância para o estudo das FI’s, pois permite ao aluno inferir quis partes das moléculas irão interagir entre si. Na Figura 2(b) é possível observar a densidade eletrônica das moléculas de água e etanol. Para realizar os cálculos de interação é preciso escolher a opção “Auto Optimization Tool”, que logo em seguida aparecerá opões no lado esquerdo. Dentre essas opções, aparecerá o “Force Field”, opção em que o usuário escolherá dentre cinco opção para calcular automaticamente as forças do sistema. Os mais recomendados para o proposto aqui são o UFF, MMFF94 e MMFF94s. Na Figura 2(c) é possível observar essas opções destacadas na interface do Avogadro. Como o software possui diversas funções e ferramentas, a curiosidade do aluno é seu guia para descobrir cada vez mais novas coisas. O exposto aqui é apenas uma pequena parcela das possibilidades disponíveis.
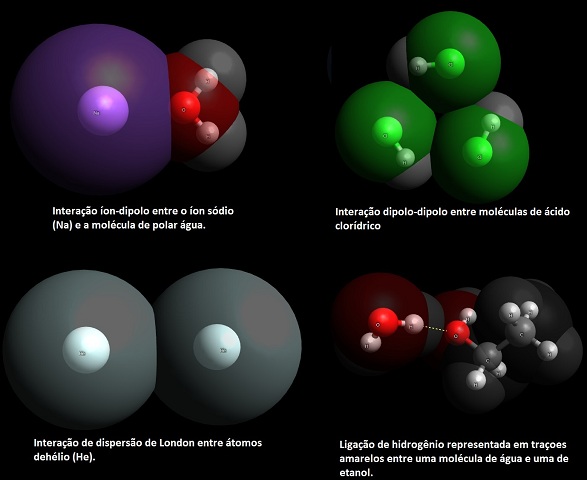
Superior observa-se as interações íon-dipolo (esquerda) e dipo-dipolo (direita). Inferior: Dispersão de London (Esquerda) e Ligação de hidrogênio.
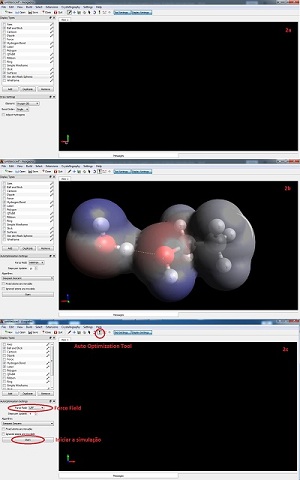
Pode-se observar algumas das interfaces do software Avogadro.
Conclusões
O presente trabalho teve como objetivo apresentar um pouco as potencialidades do Avogadro no ensino de Forças Intermoleculares. Pelo exposto até aqui é possível inferir que o software apresenta um grande potencial como ferramenta para auxiliar o professor no processo de ensino e aprendizagem. Como ele não oferece nada ao estudante se o mesmo não interagir e alimentar o programa, se enquadra no modelo construcionista, em que o aluno constrói seu próprio conhecimento. Conclui-se ainda, que o uso do Avogadro pode possibilitar ao aluno uma melhor compreensão dos conceitos estudados na Química, umas que ele consegue visualizar os fenômenos através de simulações. Para finalizar, observa-se que o Avogadro se enquadra como um ótimo OA, e que futuramente os autores realizarão novos estudos para explorar novas funcionalidades no ensino da ciência Química.
Agradecimentos
Ao Programa de Mestrado Acadêmico em Ensino de Ciência e Matemática (PGECM); ao IFCE – Campus Fortaleza; à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CA
Referências
BRAGA, J. C.; DOTTA, S.; PIMENTEL, E.; STRANSKY, B. Desafios para o Desenvolvimento de Objetos de Aprendizagem Reutilizáveis e de Qualidade. In: Workshop de Desafios da Computação Aplicada à Educação (desafie), 2012.
BROWN, T.; LEMAY, H. E.; BURSTEN, B. E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.
CARNEIRO, M. L. F.; SILVEIRA, M. S. Objetos de Aprendizagem como elementos facilitadores na Educação a Distância. Educar em Revista, n. 4, p. 235-260, 2014.
SALES, G. L. Quantum: um software para aprendizagem dos conceitos da física moderna e contemporânea. Dissertação (Mestrado). Mestrado Integrado Profissional em Computação Aplicada do Centro de Ciências e Tecnologia, da Universidade Estadual do Ceará e da Diretoria de Pesquisa e Pós-graduação do Centro Federal de Educação Tecnológica, 2005.
GIORDAN, M. O Computador na Educação em Ciências: Breve Revisão Crítica Acerca de Algumas Formas De Utilização. Ciência & Educação, v. 11(2), p. 279-304, 2005.
HODGINS, H. W. The future of learning objects. In: WILEY, D. A. (Ed.). The instructional use of learning objects: online version. 2000. Disponível em: <http://reusability.org/read/chapters/hodgins.doc>. Acesso em: 30/07/2018.
HODGINS, H. W. The future of learning objects. e-Technologies in Engineering Education: learning outcomes providing future possibilities. In: LOHMANN, J.; CORRADINI, M. (Eds.). ECI Symposium Series. v. P01, 2002. p. 76-82. Disponível em: <http://dc.engconfintl.org/etechnologies/11>. Acesso em: 30/07/2018.
MIRANDA, R. M. Usabilidade: O OA deve ser fácil de ser utilizado e estar de acordo com os padrões mais consagrados de usabilidade. Dissertação (Mestrado). Dissertação apresentada ao Programa de Pós-Graduação em Computação da Universidade Federal do Rio Grande do Sul, 2004.
SOUZA, N. S.; REIS, E. M.; LINHARES, M. P. (2009). Ensino de química no proeja: integrando o espaço virtual de aprendizagem às ações de sala de aula. Trabalho apresentado no VII Encontro Nacional de Pesquisa em Educação em Ciências (2009). Florianópolis.
TAROUCO, L. M. R. Objetos de Aprendizagem: teoria e prática. Porto Alegre: Evangraf, 2014.











