O uso de embalagens de leite fermentado no estudo da ressonância eletrônica em moléculas com ligações duplas conjugadas de cadeias abertas
ISBN 978-85-85905-23-1
Área
Ensino de Química
Autores
Mascarenhas, M.S. (UNIVERSIDADE FEDERAL DE JUÍZ DE FORA) ; Mariano, K.K.A.S.M. (UFV) ; Monteiro, A.A. (UNIVERSIDADE FEDERAL DE VIÇOSA)
Resumo
O fenômeno da ressonância química, conhecido como mesomeria, acontece em substâncias covalentes, que apresentam na sua estrutura, ligações duplas conjugadas em cadeias fechadas como exemplo os anéis aromáticos e em cadeias abertas como o buta-1,3-dieno. Esse fenômeno ocorre também nos grupos funcionais de ácidos carboxílicos e nitrocompostos. A ressonância ocorre a tranposição de elétrons pela estrutura independente da posição dos átomos. A pesquisa teve como objetivo propor um método alternativo de ensino sobre a ressonância em cadeias abertas, como o buta-1,3-dieno, uma vez que esse fenômeno é enfatizado nos compostos aromáticos, utilizando embalagens de leite fermentado, materiais alternativos, na explicitação desse fenômeno. O trabalho permitiu uma abordagem criativa, de baixo custo, d
Palavras chaves
buta-1,3-dieno; ressonância eletrônica; hibridização sp2
Introdução
O processo de aprendizagem significativa e satisfatória, principalmente no que se trata de matérias cuja visualização a olho nu não é possível, deve contar com diversos mecanismos para o entendimento digno do aluno. Há uma série de meios que podem ser aplicados para que se alcance a compreensão, como meios tecnológicos, lúdicos, entre outros. A realização do presente trabalho se deu a partir da reutilização de embalagens de leite fermentado para a simulação das moléculas com suas respectivas hibridações, e, principalmente demonstrar o fenômeno de ressonância em compostos de cadeia abertas, uma vez que esse conteúdo é enfatizado nos anéis aromáticos. O fenômeno da ressonância é a transposição dos elétrons, sem que haja mudança nas posições dos átomos na molécula (FONSECA, 2007). Vários compostos orgânicos apresentam a ressonância, como é o caso dos compostos aromáticos e os compostos de cadeia aberta que apresentam ligações duplas alternadas com ligações simples, como o buta-1,3- dieno e seus derivados. Esse efeito também pode ser observado em nitrocompostos (grupo nitro), ácidos carboxílicos (híbrido carboxilato), ozônio e outras moléculas (BARBOSA, 2004, FELTRE, 2008 e FOGAÇA, 2018). As moléculas com duplas conjugadas ou alternadas são aquelas que possuem uma alternância entre ligações simples e ligações duplas entre si. Tais moléculas podem ser de cadeia aberta ou fechada. O grande diferencial das duplas conjugadas é a possibilidade de deslocalização de seus elétrons (pi) nos orbitais (p) que se encontram paralelos na estrutura. Tal fenômeno permite que as ligações duplas não estejam de fato fixas, mas sim, deslocalizadas ao longo da região que apresenta as duplas conjugadas. O buta-1,3-dieno e seus derivados são exemplos de moléculas de cadeia aberta com duplas conjug
Material e métodos
O projeto foi desenvolvido no Colégio de Aplicação – Cap-COLUNI da Universidade Federal de Viçosa, na disciplina de Química Orgânica, do terceiro ano do ensino médio. Foi realizada uma campanha para a coleta das embalagens vazias de leite fermentados tipo Yakult, Chamyto, Batavinho, Itambinho e outras marcas, explicando os objetivos da pesquisa e sua importância no ensino e aprendizado dos alunos. As embalagens simularam os orbitais híbridos e não híbridos das estruturas químicas. Além das embalagens, foram utilizado bastão de cola quente, aplicador de cola quente, fita adesiva colorida na cor vermelha e azul para diferenciar os orbitais híbridos e não híbridos, bolinhas de isopor, fios de cobre, velcro e tesoura. O buta-1,3-dieno é um composto que apresenta 4 átomos de carbonos com hibridização sp2, portanto, possui geometria espacial trigonal planar apresentando na camada de valência de cada átomo de carbono, três orbitais hibridizados do tipo sp2 com ângulo de 120º entre si e um orbital (p) perpendicular aos orbitais hibridizados. Cada orbital do átomo de carbono possui um elétron desemparelhado podendo fazer a ligação com outros átomos. Na montagem das moléculas, os frascos (orbitais) foram unidos pelo fundo com cola quente para simular a ligação covalente, onde os orbitais sp2, representados por uma única embalagem, foram revestidos com fita adesiva vermelha e os orbitais (p), representados por duas embalagens unidas (simulando a forma de um halter simétrico) na cor azul. As bolinhas de isopor simularam os átomos de hidrogênio e foram coladas sobre as mesmas um pedaço de velcro para serem unidas aos átomos de carbono, também com velcro na extremidade, na formação das moléculas. A ligação do tipo π, entre orbitais (p) foi representada por um fio de cobre revestido.
Resultado e discussão
Foi escolhido o buta-1,3-dieno para a confecção do modelo químico de composto de
cadeia aberta por ser um dos mais simples para o entendimento. O buta-1,3-dieno
é um alcadieno, isto é, um hidrocarboneto com duas ligações duplas em sua
estrutura. Sua fórmula é C4H6 e o mesmo é conhecido por sua importante função na
confecção de borracha sintética, atuando como monômero. Seu aproveitamento pela
química industrial em parte se deve a estabilidade conferida ao composto, uma
vez que sua estrutura possui duplas conjugadas, que sofrem o fenômeno de
ressonância eletrônica conforme a Figura 1. A representação da ressonância com
as embalagens alternativas do composto foi realizada utilizando 12 potinhos de
leite fermentado revestidos com fita adesiva na cor vermelha, representando os
orbitais hibridizados do tipo sp2 da ligação σ, 8 potinhos revestidos na cor
azul, representando os orbitais do tipo (p) na ligação π. A Figura 2 apresenta a
estrutura do modelo formado com as embalagens alternativas do buta1,3-dieno e
sua forma hibrida de ressonância. Também foram utilizados fios de cobre na cor
azul para a representação da ligação π dos orbitais p, quando os mesmos se
encontram paralelos. Os orbitais hibridizados possui um ângulo de 120 ºC entre
si formando uma geometria trigonal planar. Os átomos de hidrogênio da molécula
são representados por bolinhas de isopor. Os potinhos que representam os
orbitais (p) foram furados e encaixados os fios de cobre para simular a ligação
π que ocorre entre orbitais (p) quando se encontram paralelos. Observe na Figura
2, que os fios podem se mover, tanto para um lado como para o outro, simulando a
ressonância que ocorre entre os elétrons π.
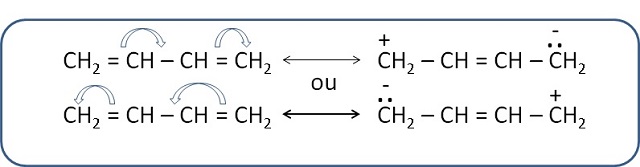
Fórmulas estruturais canônicas do buta-1,3-dieno representando o fenômeno da ressonância eletrônica.
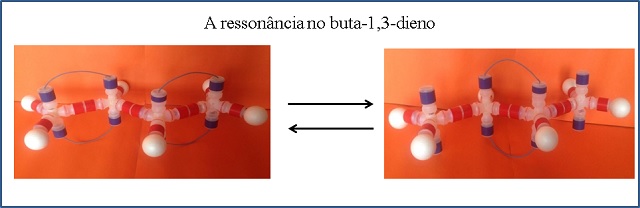
Modelo alternativo da molécula do buta-1,3-dieno, montado com embalagens de leite fermentado, evidenciando a ressonância.
Conclusões
O uso dos materiais alternativos na explicação da ressonância foi satisfatório, uma vez que possibilitou aos alunos um novo modo de aprendizagem, lúdico e de fácil visualização. Assim, o seu uso foi capaz de auxiliar os estudantes em matérias que até então eram consideradas de difícil entendimento. Além disso, a busca por métodos auxiliares e alternativos deve ser sempre empregada, principalmente no que se refere a fenômenos tridimensionais e de difícil visualização. A partir da reutilização das embalagens, foi possível compreender de forma mais fácil, o fenômeno da ressonância.
Agradecimentos
Agradecemos ao CNPq e à FAPEMIG pela concessão das bolsas científicas aos alunos do PIBIC-EM, à CAPES pelo apoio e aos alunos do Cap-COLUNI pela campanha das embalagens.
Referências
BARBOSA, Luiz Cláudio de Almeida. Introdução à Química Orgânica- São Paulo: Ed. Pearson Prentice Hall, 2004.
FELTRE, Ricardo. Química Orgânica 3, 7ª edição – São Paulo: Ed. Moderna, 2008.
FOGAÇA, Jennifer Rocha Vargas. "Ressonância"; Brasil Escola. Disponível em <https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm>. Acesso em 16 de agosto de 2018
FONSECA, Martha Reis Marques da. Química Orgânica, São Paulo: Ed. FTD, 2007.
JÚNIOR, José Nunes da Silva, BARBOSA, Francisco Geraldo, JÚNIOR, Antonio José Melo Leite e EDUARDO, Valeska Mesquita. Ressonância: desenvolvimento, utilização e avaliação de um software educacional, Química Nova, v. 37, p. 373-376, 2014.
RAMOS, Joana Maria, IZOLANI, Antônio Orlando, TÉLLEZ, Cláudio Alberto, SANTOS, Maria Josefa Gomes. O Conceito de Hibridização. Química Nova Na Escola, v.1, p.28, 24-27, 2008.











