Prospecção química e atividade larvicida do extrato etanólico de Annona mucosa para o controle de vetores de dengue, zika e chikungunya
ISBN 978-85-85905-23-1
Área
Produtos Naturais
Autores
Maia de Morais, S. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Machado Rodrigues, A. (IFPA) ; Lima dos Santos, D. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Emanuel Pessoa Martins, V. (UNILAB) ; Araujo da Silva, A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Carolina Silva e Silva, A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Lima Maciel, G. (UNIVERSIDADE ESTADUAL DO CEARÁ)
Resumo
A utilização de plantas para o controle de insetos, devido a presença de seus componentes bioativos, tem se disseminado em todo o mundo. A família Annonaceae tem ganhado destaque por suas propriedades medicinais, como anticâncer e antileishmanial. Objetiva-se a investigação do perfil químico e atividades biológicas do extrato etanólico de sementes da Annona mucosa. Realizou-se a espectroscopia na região do infravermelho a fim de identificar os principais componentes químicos da amostra, revelando a presença de bandas de absorção características da presença de acetogeninas, compostos comuns em Annonaceae. O extrato das sementes apresentou atividade larvicida promissora frente as larvas de Aedes aegypti e Aedes albopictus, com CL50 de 14,29 ppm e 5,19 ppm, respectivamente.
Palavras chaves
Annona mucosa; Aedes; Larvicida
Introdução
A família Annonaceae alcança cerca de 130 gêneros e 2.300 espécies (ALALI et al.,1999), subdividido em países de climas tropical e subtropical. Muitas pesquisas vêm sendo realizadas voltadas ao gênero Annona (LOBO; JOLY, 1998), devido ao isolamento e caracterização de diversas classes de substâncias com atividades químicas e farmacológicas (LEBOEUF et al., 1982). A Annona mucosa, conhecida popularmente como biribá é uma espécie da família Annonaceae. É uma árvore frutífera e produtora de importantes metabólitos secundários com interesse medicinal, como lignanas, acetogeninas e alcaloides (BARBOZA et al.,2014). Sabe-se que as acetogeninas são responsáveis por muitas atividades biológicas, contendo substâncias que possuem propriedades citotóxica, antitumoral, sedativa, adstringentes, antireumática, emética, imunossupressora, antiparasitária, antimicrobiana e pesticida (SANTOS; SANT’ANA, 2001; GRZYBOWSKI, 2011). Os mosquitos Aedes aegypti e Aedes albopictus têm sido evidenciados pelo seu potencial em transmitir doenças virais como Dengue, Chikungunya, Zika e Febre Amarela. As estratégias que apresentam maior resultado no controle destes artrópodes têm sido a utilização de compostos químicos sintéticos. Entretanto, percebe-se ao longo do tempo uma seleção dos espécimes mais resistentes de ambas as espécies, dificultando o controle a base de produtos químicos sintéticos, além dos agravos ocasionados ao meio ambiente. Diante dessa resistência, nos últimos anos, medidas de controle alternativo de Aedes vêm sendo buscadas, sendo o controle com base em produtos naturais bastante promissores. Neste trabalho, objetivou-se a caracterização química da A. mucosa a partir de espectrometria na região de infravermelho (FT-IR) e atividade larvicida frente Ae. aegypti e Ae.albopictus.
Material e métodos
As sementes da A. mucosa foram coletadas na cidade de Santa Isabel - PA. Realizou-se a preparação do extrato etanólico: 300g das sementes em 1 L de etanol PA 96º GL, por maceração, durante sete dias, à temperatura ambiente, com agitação ocasional e concentrado em evaporador rotativo sob pressão reduzida (40 rpm a 60ºC). O extrato etanólico (EA) obtido das sementes da A. mucosa foi submetido a testes fitoquímicos para caracterização dos metabólitos secundários presentes na amostra, seguindo a metodologia de Matos (1988). O FT-IR foi obtido utilizando um espectrofotômetro modelo Nicolet iS5 da Thermo Scientific. A amostra foi preparada na forma de pastilhas de KBr na proporção 1:20 (m/m) e o espectro registrados no intervalo de 4000 a 400 cm- 1, empregando-se 32 scans e resolução de 4 cm-1. Para o ensaio larvicida foram utilizadas larvas (20 espécimes/amostra) de 3o e 4o estádios da geração F1 de Ae. aegypti e Ae. albopictus, oriundas das colônias mantidas no laboratório, de acordo com os parâmetros estabelecidos pela Organização Mundial da Saúde (WHO, 1981). As amostras foram submetidas ao tratamento com concentrações diferentes do extrato obtido, realizado em triplicatas, a partir das quais foram estimadas as concentrações letais do(s) produto(s) responsável pela mortalidade de 50% e 90% (LC50 e LC90) dos espécimes testados por meio de análise de probito por meio do software estatístico SPSS.
Resultado e discussão
Pode-se observar o efeito larvicida a partir da Tabela 1 que representa a
ação larvicida do extrato etanólico das sementes da A. mucosa para as cepas
dos mosquitos Ae. aegypti e Ae. albopictus.
Outras anonáceas como A. reticulata foram eficazes contra larvas de Ae.
aegypti com CL50 e CL90 de 95,24 e 262,64 ppm, respectivamente (MOHANKUMAR;
SHIVANNA; ACHUTTAN, 2016).
O espectro no infravermelho do extrato mostrou alguns picos característicos,
observados em plantas da família Annonaceae (Fig. 1). Os números de onda
722, 1082, 1173, 1125, 1465, 1742, 2853, 2925 e 3435 cm-1 são peculiares dos
grupos funcionais presentes nas acetogeninas de Annonaceae, tendo as
seguintes associações nos picos: 3435 cm-1 é característico de grupamento O-
H; 2853 e 2925 cm-1 são característicos de estiramento C-H indicando maior
presença de compostos de cadeias longas e confirmando estas cadeias pela
absorção do C-H do grupamento CH2 em 1465 e 722 cm-1 (deformação fora do
plano); 1082 e 1742 cm-1 são característicos de estiramentos C-O e C=O,
encontrados nas estruturas de acetogeninas devido a presença de anéis
tetrahidrofurano e lactonas, respectivamente.
Na análise feita por Agu et al. (2018) em A. muricata, os picos confirmaram
a presença da fração γ-lactona α e β-insaturada e a absorção de IR pelo
grupo carbonila de grupamento lactona (-O[C = O]-) a 1732,2 cm-1, além da
presença de um proeminente sinal de estiramento de metileno (-CH2 -) a
1459,5 cm −1 e da presença do grupo funcional hidroxila (-OH) sendo
confirmada pela absorção de IR a 3435,2 e 3863,3 cm- 1.
Fig. 1. IR do extrato etanólico de A. mucosa
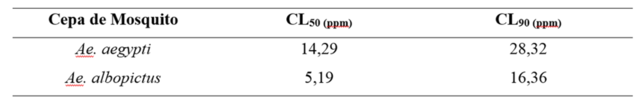
Efeito larvicida do extrato etanólico de A. mucosa sobre Ae. aegypti e Ae. albopictus.
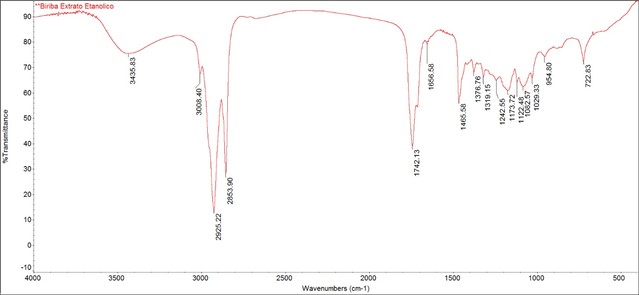
IR do extrato etanólico de A. mucosa
Conclusões
Os resultados conferem a atividade larvicida da A. mucosa provavelmente devido a presença de acetogeninas características da família Annonaceae. Assim, o isolamento químico dos componentes da planta poderá oferecer potenciais alternativas para o controle de Aedes aegypti e Aedes albopictus.
Agradecimentos
Universidade Estadual do Ceará Programa de iniciação científica IC-UECE Selene Maia de Morais LQPN- Laboratório de Química de Produtos Naturais
Referências
AGU, K.C. OKOLIE, FALODUN, N.P. ENGEL-LUTZ, A.N. In vitro anticancer assessments of Annona muricata fractions and in vitro antioxidant profile of fractions and isolated acetogenin (15-acetyl guanacone). Journal of Cancer Research and Practice, v. 5, p. 53-66, 2018.
ALALI, FERAS Q.; LIU, Xiao-Xi; MCLAUGHLIN, Jerry L. Annonaceous Acetogenins: Recent Progress. Journal of Natural Products, v. 62, n. 3, p. 504-540, 1999.
BARBOZA, T. J. S. et al. Effect of different culture media and plant growth regulators for the optimization of callus induction of Annona mucosa (Jacq.). Revista Brasileira de Plantas Medicinais, v. 16, n. 4, p. 905-911, 2014.
SANTOS, A.F. e SANT'ANA, A.E.G. Molluscicidal properties of some species of Annona. Phytomedicine, v. 8, n. 2, p. 115-120, 2001.
GRZYBOWSKI, Adélia. Fitolarvicidas para o controle do vetor da dengue e febre amarela, Aedes aegypti. 2012.
LEBOUEF M, CAVÉ A, BHAUMIK PK, MUKERJEE B, MUKHERJEE R. The phytochemistry of the Annonaceae. Phytochemistry 21: 2783-2813, 1982.
LOBO, P. C; JOLY, C. A. 1998. Tolerance to hipoxia and anoxia in neotropical tree species. Pp. 137-156. In F. R. Scarano & A. C. Franco (eds.). Ecophysiological strategies of xerophytic and amphibious plants in the neotropics. Series Oecologia Brasiliensis. vol IV. PPGE-UFRJ, Rio de Janeiro.
MATOS, F. J. A. Introdução a Fitoquímica Experimental. 1st ed. Fortaleza: Edições UFC, 1988.
MOHANKUMAR, T.K., SHIVANNA, K.S., ACHUTTAN, V.V. Screening of Methanolic Plant Extracts against Larvae of Aedes aegypti and Anopheles stephensi in Mysore. Journal of Arthropod-Borne Diseases, v.10, p. 303–314, 2016.
World Health Organization. Instructions for determining the susceptibility or resistance of mosquito larvae to insecticides. Geneva: World Health Organization, WHO, VBC, 1981.











