CARACTERIZAÇÃO QUÍMICA E ATIVIDADE ANTIOXIDANTE DO EXTRATO ETANÓLICO DE FOLHAS DE Astronium fraxinifolium Schott. (GONÇALO ALVES).
ISBN 978-85-85905-23-1
Área
Produtos Naturais
Autores
Rodrigues, A.L.M. (RENORBIO/UNIVERSIDADE ESTADUAL DO CEARÁ) ; Montes, R.A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Silva, A.A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Maciel, G.L. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Lisboa, D.S. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Vieira, I.G.P. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Silveira, E.R. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Morais, S.M. (UNIVERSIDADE ESTADUAL DO CEARÁ)
Resumo
A família Anacardiaceae apresenta um amplo espectro de propriedades biológicas em suas várias espécies. Desta forma, objetivou-se realizar a prospecção fitoquímica do extrato etanólico das folhas de Gonçalo Alves (E.E.F.G.A), quantificar por CLAE os taninos e flavonoides presentes e avaliar seu potencial antioxidante pelo método DPPH. O estudo fitoquímico apresentou taninos condensados, flavonónois, flavonona e esteroides. A análise por CLAE detectou ácido gálico 4,118±0,112, ácido clorogênico 1,059±0,002, geraniina 1,736±0,007, rutina 4,045±0,0004, isoquercitrina 34,32±0,056, campeferol-3-O-rutinosídeo 12,46±0,114 e quercetina 3,421±0,014 em mg/g de extrato. O extrato apresentou um bom potencial antioxidante. Assim, este estudo confirma o potencial medicinal dessa espécie.
Palavras chaves
Quantificação química; DPPH; Gonçalo Alves
Introdução
O uso do conhecimento popular sobre plantas medicinais, que é adquirido e repassado por gerações, pode ser uma alternativa de tratamento as doenças, este melhoraria o atendimento da população pelo Sistema Único de Saúde, em razão de proporcionar outra forma de tratamento e de prevenção (BRUNING, MOSEGUI, VIANNA, 2012). Desta forma, a fitoterapia apresenta-se como uma possibilidade de atuar como coadjuvante nos tratamentos alopáticos. No entanto, estudos que comprovem essas atividades, associados à determinação da toxicidade, são necessários (BRUNING, MOSEGUI, VIANNA, 2012). A família Anacardiaceae é uma rica fonte de metabólitos secundários, que são isolados de frutos e folhas e apresenta um amplo espectro de propriedades biológicas (PANDIT, et. al., 2009; DRAGULL, BECK, MERRILL, 2010; ROITMAN, MERRILL, BECK, 2011). Esta família compreende cerca de 70 gêneros e 700 espécies com distribuição tropical e subtropical (MONTANARI, et. al. 2012). Na literatura, encontra-se a utilização de várias espécies desta família em algumas áreas, tais como: alimentação, paisagismo, extração de tanino e verniz, produção de substâncias para uso na indústria e na medicina e aproveitamento de madeira para construção (SANTIN, 1989; BARROSO, 1991). No entanto, somente 7% das espécies conhecidas foram investigadas quanto à fitoquímica e atividades biológicas. Os metabólitos secundários comumente encontrados nessa família são os lipídios fenólicos, que compreendem substâncias fenólicas, catecólicas, e os flavonóides, principalmente os biflavonóides, terpenos, esteróides e xantonas (CORREIA et al., 2006). Chalconas e substâncias tânicas também podem ser encontradas em espécies dessa família, as quais são responsáveis por uma variedade de atividades relacionadas, tais como ação anti-séptica, analgésica, anti-hemorrágica, antimicrobiana, antiparasitária, antiinflamatória e cicatrizante (LEITE et al., 2002). Na Argentina o decocto das folhas secas de Schinus terebinthifolius (Aroeira-vermelha) é usado para desordens menstruais, no combate a tumores, infecções e desordens do trato respiratório e urinário (SCHMOURLO et al., 2005). As folhas S. terebinthifolius coletadas da África subareana indicou a presença de trans-ocimeno nos óleos essenciais e forte atividade antibacteriana contra Yersinia enterocolitica e Pseudomonas aeruginosa bem como uma moderada atividade antifúngica (GUNDIDZA et al., 2009). A espécie Myracrodruon urundeuva (Aroeira do sertão) possui alguns constituintes químicos com atividades farmacológicas comprovadas, tais como os taninos responsáveis pela ação analgésica e antiinflamatória (VIANA et al., 1997), as chalconas com atividade antiinflamatória (BANDEIRA et al.,1994; VIANA et al., 2003), cicatrizante (VIANA et al.,1995), antiulcerogênica (MENEZES, RAO, 1986) e antioxidante (JORGE, DANTAS, 2003). De acordo com estudos fitoquímicos realizados em extrato etanólico de folhas de Astronium fraxinifolium as principais classes de produtos naturais encontradas foram taninos, flavonoides, terpenos e cumarinas. Este extrato apresentou também atividade antiviral parcial contra rotavírus. Os resultados encontrados corroboram os dados etnofarmacológicos como fonte valiosa na seleção de plantas com atividade antiviral validando seus usos tradicionais (CECÍLIO et. al., 2012). Extratos produzidos a partir das cascas do caule e da raiz de A. fraxinifolium demonstraram um amplo espectro de atividade em leveduras, alguns destes apresentaram resultados melhores que o controle positivo fluconazol em Candida. albicans e atividade antitumoral em células leucêmicas (MOURA, 2014). Desta forma, são necessários mais estudos de isolamento, identificação e rota biossintética dessas substâncias visando comprovar as muitas atividades biológicas relatadas. A obtenção de novos princípios ativos se torna uma alternativa muito rentável, assim pesquisas com diferentes produtos de origem vegetal têm sido realizadas para garantir uma aplicação mais segura e eficaz à saúde humana.
Material e métodos
A planta, Gonçalo Alves foi coletada no Nordeste do Brasil no município de Caucaia, sob o número de exsicata ALCB 122296. O extrato etanólico foi obtido a partir das folhas da Çonçalo Alves (E.E.F.G.A) por maceração. Aextração foi realizada no período de sete dias, foram pesadas 310g de folhas e extraídas com 5L de etanol PA 96°GL num recipiente de vidro fechado à temperatura ambiente. A prospecção fitoquímica qualitativa, visando identificar os metabólitos secundários do E.E.F.G.A, seguiu a metodologia de Matos (1988). A cromatografia líquida de alta eficiência (CLAE-DAD) foi realizada com um sistema de CLAE Shimadzu Prominence Auto Sampler (SLI-20A), equipado com bombas alternativas Shimadzu LC-20AT conectadas a um desgaseificador DGU20A5 com um CBM 20A. integrado, detector de arranjo de diodos SPD-M20A e software LC 1.22 SP1. AS análises cromatográficas foram realizadas utilizando uma coluna de fase móvel reversa (Phenomenex) Luna 18 C18(4,6X250mm,5um). As fases móveis C e D foram acetonitrila e água deionizada, acidificada para pH= 2,8 com ácido fosfórico, correspondentemente, foi utilizado o gradiente de solvente da seguinte maneira: 0-15min, uma eluição isocrática com C:D(20:80v/v);17-25min, variação linear até C:D (40:60v/v);25-30min, uma eluição isocrática com C:D(20:80v/v). A taxa de fluxo foi de 1,0mL/min, com um volume de injeção de 20uL e o comprimento de onda 350nm. AS soluções padrões de referência foram preparadas numa faixa de concentrações de 0,01-1,0mg/mL para ácido gálico; 0,0008-1mg/mL para ácido clorogênico;0,032-0,5mg/mL para geraniina; 0,00032-1,0mg/mL para rutina;0,008-1,0mg/mL para isoquercitrina; o,008-1,0mg/mL para campeferol-3-O-rutinosídeo;0,00006-0,2mg/mL para quercetina. A curva de calibração para o ácido gálico foi Y=3.10-8X-0,0315(r=0,9612);ácido clorogênico Y=2.10-8X+0,0092(r=0,996); geraniina Y=2.10-8X+0,0081(r=0,997); rutina Y=4.10-8+0,005(r=0,999); isoquercitrina Y=4.10-8X+0,0118(r=0,999); campeferol-3-O-rutinosídeo Y=2.10-7X+0,0038(r=0,999); quercetina Y=2.10-8X-2.10-5(r=1). A amostra E.E.F.G.A, foi solubizada numa concentração de 21,6mg/mL. A amostra foi analisada em triplicata e a média dos picos foi mensurada. Segundo o método desenvolvido por Yepez et al.(2002), 0,1mL de solução metanólica da amostra(10,000-1ppm) foi adicionada a um tubo de ensaio contendo 3,9mL de 6.5x10-5M de solução metanólica de DPPH. Após 1h a abrbância da mistura foi medida a 515nm. Os valores CI50 foram determinados por regressão linear dos dados plotados. Os resultados foram apresentados como média e desvio padrão, avaliados pela análise de variância(One Way ANOVA), seguida do teste de comparação de média, o teste de Tukey. Valores de P menores do que 0,05(p<0,05) foram considerados como indicativos de significância. Os cálculos foram realizados utilizando o Software estatístico GraphPad Prism versão 5.00, San Diego Califórnia,EUA.
Resultado e discussão
Estudos fitoquímicos do E.E.F.G.A indicaram a presença das seguintes classes de metabólitos secundários: taninos condensados, flavonónois, flavonona e esteroides. Dentre os compostos identificados, os taninos comumente encontrados em espécies de Anacardiaceae são considerados uma classe promissora de substâncias com atividades antibacterianas e antibiofilme contra Pseudomonas aeruginosa. Uma fração rica em taninos hidrolisáveis, do extrato aquoso da casca do caule Myracrodruon urundeuva, induziu danos à membrana de P. aeruginosa, proporcionando efeitos bacteriostáticos e anti-adesivos (TRETIN et al., 2013).
Extratos ricos em taninos já tiveram algumas atividades biológicas comprovadas como antioxidante, antiploriferativa (DE MELO et al., 2010); anticâncer e na prevenção do câncer (LI, WANG, LIU, 2003); antileishmanial (KOLODZIEJ et al., 2005); antiviral (YANG et al., 2013); antidiarreica (GALVEZ et al., 1991); antimicrobiana (HO et al., 2001).
Os flavonoides quando ingeridos na dieta a longo prazo estão associados a redução da mortalidade por doença coronariana (KRIS-ETHERTON et al., 2002), possui importante efeito na inibição da carcinogênese, atividade antioxidante e atuam também na prevenção de distúrbios dos vasos sanguíneos (YAO et al., 2004).
Os esteroides apresentam algumas atividades relatadas na literatura como atividade antimicroniana (TALEB-CONTINI etal., 2003), significativa toxicidade contra células tumorais humanas e de ratos (HUANG, LIN, KONG, 2008) e atividade antioxidante (DJERIDANE, et al., 2010).
As análises do perfil cromatográfico realizada por CLAE-DAD mostraram que os picos foram eluídos dentro de um intervalo de tempo de retenção de 3 a 25 minutos (Fig.1). Os picos cromatográficos foram confirmados pela comparação dos tempos de retenção e pelos espectros DAD (200 a 400nm) das amostras com os padrões de referência.
Desta forma, os compostos químicos encontrados foram: (1) ácido gálico, (2) ácido clorogênico, (3) Geraniina, (4) rutina, (5) isoquercitrina, (6) Campeferol-3-O-rutinosídeo, (7) quercetina. Esses resultados corroboram com a maioria das classes de metabolitos secundários evidenciadas na prospecção fitoquímica. Os níveis em mg/g de extrato de cada composto analisado encontram-se na Tabela 1. Esses resultados não foram relatados na literatura até o momento. A isoquercitrina foi o composto majoritário identificado seguido do canferol-3-O-rutinosídeo, o ácido gálico, a rutina, a quercetina, a geraniina e o ácido clorogênico.
Estudo do perfil cromatográfico obtido das análises por cromatografia liquída de alta eficiência (CLAE) de extratos hidroalcoólicos das folhas e caule de espécies de Astronium detectou a presença das seguintes classes de constituintes, derivados do ácido gálico, derivados do ácido cafeoilquínico, derivados de ácido fenólico, flavonoides, derivados do ácido elágico e taninos condensados (RESENDE et al., 2015).
A quantificação fitoquímica do extrato hidroalcoólico do caule de Astronium fraxinifolium (HAAF) por CLAE apresentou uma quantidade significativa de ácido gálico (4.25 %), ácido clorogênico (2,11%), ácido caféico (0,73%), rutina (0,08%) e quercetina (0,29%) (MARTINS, et al., 2018). Esses resultados de quantificação e identificação dos constituintes químicos presentes nessas espécies possibilita uma melhor aplicabilidade dessa planta como um novo fitoterápico.
Estudos mostraram que o ácido gálico possui as seguintes atividades biológicas: antioxidante (ROSSO, 2005), antitumoral (GOMES et al., 2003), antifúngica e antibacteriana (ROSSO, 2004; ROSSO, 2005) e antiviral (SAVI, 2005).
O ácido clorogênico apresenta atividade antioxidante (BONITA et al., 2007;), antiinflamatória, antinoceptiva (DOS SANTOS et al., 2006) e hipotensor (CHEN et al.,2009) .
A geraniina tem atividade antioxidante, atividade inibitória da semicarbazida-sensitivo amina oxidase (SSAO) e da enzima conversora da angiotensina (ECA), efeito anti-hipertensivo em ratos (LI et al., 2008), efeito radioprotetor (KANG et al., 2011), atividade anti-hiperglicemica (PALANISAMY, et al., 2011).
A rutina possui atividade antihiperlepidêmica (SANTOS et al., 1999), antioxidante (PULIDO, BRAVO, SAURA-CALIXTO, 2000), anticonvulsivante em ratos (NASSIRI-ASL, SHARIATI-RAD, ZAMANSOLTANI, 2008), anticarcinogênica (MARCHAND, 2002) e antiinflamatória (GUARDIA et al., 2001).
A isoquercitrina tem atividade antioxidante (DOS SANTOS et al., 2014), antiinflamatória (COUTINHO, MUZITANO, COSTA, 2009), anti-hipertensivo (GASPAROTTO et al., 2011), atua contra distúrbios no metabolismo lipídico e no combate a doença hepática gordurosa não- alcoólica (ZHOU, et al., 2014).
O canferol-3-O-rutinosídeo apresenta um forte efeito protetor contra dano hepático oxidativo induzido por CCl4 (WANG, TANG, ZHANG, 2015), tem atividade biológica para prevenção e tratamento de doenças do sistema nervoso central (SNC) (MA, et al., 2017), efeito hipotensor (AHMAD, et al., 1993), atividade antiacetilcolinesterase (BAEK, et al., 2017) e atividade antimicrobiana (ÖZÇELIK, et al., 2008).
A quercetina possui atividade antitumoral (BEHLING et al., 2004), antiangiogênica (TAN et al., 2003) antioxidativa hepática (SU et al., 2003) e efeitos na prevenção e no tratamento de doenças cardiovasculares, câncer e insuficiência renal e hepática (BEHLING et al., 2004).
O E.E.F.G.A apresentou um bom potencial antioxidante CI50= 20,085 ± 1,74 µg/mL, com valor próximo ao padrão quercetina 5,0±0,18 µg/mL. Esse resultado está relacionado com a presença de flavonoides e taninos identificados nesse extrato, que possuem capacidade de capturar radicais livres do reagente DPPH (2,2- difenil, 1-picrihidrazila). Os compostos químicos encontrados são responsáveis por retardar a velocidade de oxidação e assim podem contribuir na melhoria e no funcionamento do organismo, fortalecendo, por exemplo, o sistema imunológico.
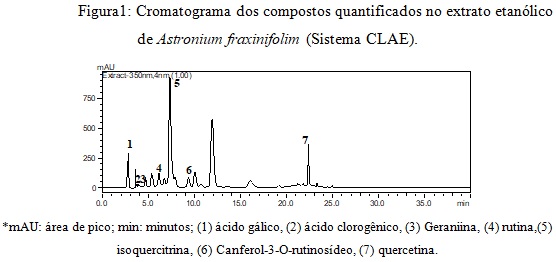
Cromatograma dos compostos quantificados no extrato etanólico de Astronium fraxinifolim (Sistema CLAE).
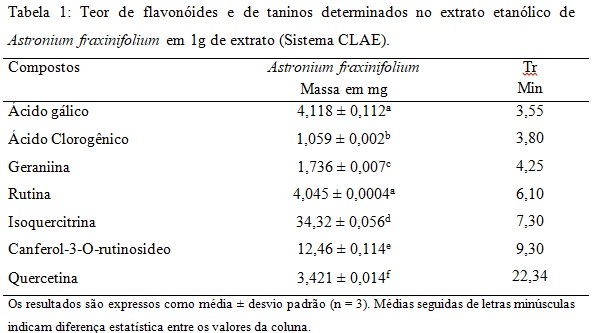
Teor de flavonóides e de taninos determinados no extrato etanólico de Astronium fraxinifolium em 1g de extrato (Sistema CLAE).
Conclusões
As classes fitoquímicas encontradas no E.E.F.G.A revelaram substâncias com ação antioxidante na inibição dos radicais livres, antimicrobiana, anti-inflamatória, entre outras, podendo combater várias doenças, como por exemplo, causadas pelo extresse oxidativo. A quantificação dos constituintes químicos detectados é um fator determinante para sua atividade, porém mais estudos relacionados ao comportamento desses constituintes e de toxicidade são necessários. Os resultados obtidos mostraram que o E.E.F.G.A tem potencial para ser utilizado como fitoterápico, pois se verificou a presença de compostos com comprovada ação biológica. Desta forma, motivando a realizar estudos aprofundados visando elucidar toda a composição química do extrato relacionando os dados etnofarmacológicos e estudos científicos. Assim, este trabalho certificou as propriedades medicinais de Astronium fraxinifolium tanto pela sua atividade antioxidante como pelos seus diversos compostos fenólicos de conhecidas propriedades medicinais, garantindo um fitoterápico a partir de folhas de A. fraxinifolium com espectro de ação.
Agradecimentos
Os autores agradecem a Universidade Estadual do Ceará (UECE) e a Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico pelo apoio financeiro(FUNCAP).
Referências
AHMAD, M., GILANI, A. U.H., AFTAB, K., AHMAD, V. U. Effects of Kaempferol-3-O-rutinoside. PHYTOTHERAPY RESEARCH, 7, 314–316, 1993.
BAEK, J., LEE, H. L., KANG, K. S., KIM, K. H. Chemical constituents from the fruit of citrus Unshiu and their inhibitory effects on acetylcholinesterase. Macedonian Journal of Chemistry and Chemical Engineering, 36(1), 1–8, 2017.
BANDEIRA, M. A. M.; MATOS, F. J. A; BRAZ-FILHO, R; New chalconoid dimers from Myracrodruon urundueva. Natmural Product Letters, v.4,p.113-120,1994.
BARROSO, G. M. Sistemática de Angiospermas do Brasil. Volume 2. Universidade Federal de Viçosa, Imprensa Universitária, 1991.
BEHLING, E. B; SENDÃO, M. C; FRANCESCATO, H. D. C; ANTUNES, L. M. G; BIANCHI, M. L. P. Flavonoid quercetin: general aspects and biological actions. Alimentos e Nutrição, Araraquara, v. 15, p. 285-292, 2004
BONITA, J. S; MANDARANO, M; SCHUTA, D; VINSON, J. Cofee and cardiovascular disease: In vitro, cellular, animal and human studies.Pharmacological Research, Scranton, v.55,p.187-198, 2007.
BRUNING, M. C. R., MOSEGUI, G. B. G., E VIANNA, C. M. de M. A utilização da fitoterapia e de plantas medicinais em unidades básicas de saúde nos municípios de Cascavel e Foz do Iguaçu - Paraná: a visão dos profissionais de saúde. Ciência & Saúde Coletiva. V.17, nº10, p.2675–2685, 2012.
CECÍLIO, A. B.; DE FARIA, D. B.; OLIVEIRA, P. D. C.; CALDAS, S.; DE OLIVEIRA, D. A.; SOBRAL, M. E. G., DUARTE, M. G. R.; MOREIRA, C. P. S.; SILVA, C. G.; De ALMEIDA, V. L. Screening of Brazilian medicinal plants for antiviral activity against rotavirus. Journal of Ethnopharmacology, v.141(3), p. 975–981, 2012.
CHEN, Z; PENG, C; JIAO, R; WONG, Y. M; HUANG, Y. Anti-hypertensive Nutraceuticals and Functional Foods. Journal Agricultural Food Chemical, Hong Kong, v.57,p.44854499, 2009.
CORREIA, S. J; DAVID, J. P.; DAVID, J. M. Metabólitos secundários de espécies de Anacardiaceae. Química Nova, 29(6): 1287-1300, 2006.
COUTINHO, MARCELA A. S.; MUZITANO, MICHELE F.; COSTA, S. S. Flavanoides: Potenciais agentes terapêuticos para o processo inflamatório. Revista Virtual de Química, 1(3), 241–256, 2009.
DE MELO, J. G., DE SOUSA ARAÚJO, T. A., DE ALMEIDA CASTRO, V. T. N., DE VASCONCELOS CABRAL, D. L., DO DESTERRO RODRIGUES, M., DO NASCIMENTO, S. C., DE AMORIM, E., L., C., DE ALBUQUERQUE, U. P. Antiproliferative activity, antioxidant capacity and tannin content in plants of semi-arid northeastern Brazil. Molecules, 15(12), 8534–8542, (2010).
DJERIDANE, A., YOUSFI, M., BRUNEL, J. M., & STOCKER, P. Isolation and characterization of a new steroid derivative as a powerful antioxidant from Cleome arabica in screening the in vitro antioxidant capacity of 18 Algerian medicinal plants. Food and Chemical Toxicology, 48(10), 2599–2606, 2010.
DOS SANTOS, M. D; ALMEIDA, M.C; LOPES, N. P; DE SOUZA, G. E. P. Evaluation of the anti-inflamatory, analgesic and antipyretic activies of the natural polyphenol cholorogenic acid. Biological Pharmacology Bull, Riberão Preto, v.29, p.2236-2240, 2006.
DOS SANTOS, P. M., DE ALMEIDA, P. D. O., LIMA, E. S., DE MORAES, M. O., DA COSTA, P. M., MEIRA, A. S., DA VEIGA, V. F. Perfil de flavonoides e avaliação do potencial antioxidante e citotóxico de bauhinia purpurea (fabaceae) da região amazônica. Quimica Nova, 37(1), 89–94, 2014.
DRAGULL, K.; BECK, J.J.; MERRILL, G.B. Essential oil yield and composition of Pistacia vera ‘Kerman’ fruits, peduncles and leaves grown in California. J. Sci. Food Agric. 90, 664–668, 2010.
GALVEZ, J., ZARZUELO, A., CRESPO, M. E., UTRILLA, M. P., JIMÉNEZ, J., SPIESSENS, C., WITTE, P. Antidiarrhoeic activity of Sclerocarya birrea bark extract and its active tannin constituent in rats. Phytotherapy Research, 5(6), 276–278, 1991.
GASPAROTTO, A., GASPAROTTO, F. M., LOURENÇO, E. L. B., CRESTANI, S., STEFANELLO, M. E. A., SALVADOR, M. J., KASSUYA, C. A. L. Antihypertensive effects of isoquercitrin and extracts from Tropaeolum majus L.: Evidence for the inhibition of angiotensin converting enzyme. Journal of Ethnopharmacology, 134(2), 363–372, 2011.
GOMES, C. A; CRUZ, T. G; ANDRADE, J. L; MILHAZES, N; BORGES, F; MARQUES, M. P. M. Anticancer Activity of Phenolic Acids of Natural or Synthetic Origin: A StructureActivity Study. Journal of Medicinal Chemistry, v. 46, p. 5395-5401, 2003.
GUARDIA, T; ROTELLI, A. E; JUAREZ, A. Q; PELZER, L. E. Anti-inflamatory properties os plant flavonoids. Effect of rutin, quercetin and hiperidin on adjuvant arthritis in rat. II Pharmacology, v. 56, p. 683-687.2001.
GUNDIDZA, M.; GWERU, N.; MAGWA, M. L.: MMBENGWA V.; SAMIE, A. The chemical composition and biological activities of essential oil from the fresh leaves of Schinus terebinthifolius from Zimbabwe. African J. Biotechnol. Vol. 8 (24), p. 7164-7169, 2009.
HO, K. Y., TSAI, C. C., HUANG, J. S., CHEN, C. P., LIN, T. C., LIN, C. C. Antimicrobial activity of tannin components from Vaccinium vitis-idaea L. The Journal of Pharmacy and Pharmacology, 53(100), 187–191, 2001.
HUANG, X. F., LIN, Y. Y., KONG, L. Y. Steroids from the roots of Asparagus officinalis and their cytotoxic activity. Journal of Integrative Plant Biology, 50(6), 717–722, 2008.
JORGE, S. A.; DANTAS, S. R. P. E. Abordagem multiprofissional no tratamento de feridas. Sao Paulo: Atheneu; p.123-31, 2003.
KANG, K. A., LEE, I. K., ZHANG, R., PIAO, M. J., KIM, K. C., KIM, S. Y., SHIN, T., KIM, B. G., LEE, N.H., HYUN, J. W. Radioprotective effect of geraniin via the inhibition of apoptosis triggered by γ-radiation-induced oxidative stress. Cell Biology and Toxicology, 27(2), 83–94, 2011.
KOLODZIEJ, H., BURMEISTER, A., TRUN, W., RADTKE, O. A., KIDERLEN, A. F., ITO, H., HATANO, T., YOSHIDA, T., LAI, Y. F. Tannins and related compounds induce nitric oxide synthase and cytokines gene expressions in Leishmania major-infected macrophage-like RAW 264.7 cells. Bioorganic and Medicinal Chemistry, 13(23), 6470–6476, 2005.
KRIS-ETHERTON, P., HECKER, K. D., BONANOME, A., COVAL, S. M., BINKOSKI, A. E., HILPERT, K. F., ETHERTON, T. D. Bioactive compounds in foods: their role in the prevention of cardiovascular disease and cancer. The American Journal of Medicine, 113 Suppl(1), 71S–88S, 2002.
LEITE, E. J. State of knowledge on Astronium fraxinifolium (Anacardiceae) for genetic conservation in Brazil. Embrapa Genetic Resources and Biotechnology. Brasília DF, Brazil, 2002.
LI, H., WANG, Z., LIU, Y. Review in the studies on tannins activity of cancer prevention and anticancer. Journal of Chinese Medicinal Materials, 26(6):444-448, 2003.
LIN, S. Y., WANG, C. C., LU, Y. L., WU, W. C., HOU, W. C. Antioxidant, anti-semicarbazide-sensitive amine oxidase, and anti-hypertensive activities of geraniin isolated from Phyllanthus urinaria. Food and Chemical Toxicology, 46(7), 2485–2492, 2008.
MA, Y., LIU, Y., SUN, A., DU, Y., YE, M., PU, X., QI, X. Intestinal absorption and neuroprotective effects of kaempferol-3-O -rutinoside. RSC Advances, 7(50), 31408–31416, 2017.
MARCHAND, L. L. Cancer preventive effects of flavonóides – a review. Biomed Pharmacother. v. 56, p. 296-301, 2002.
MARTINS, A, O. B. P. B., SIEBRA, A. L. A. OLIVEIRA, C. D. M., LEITE, G. O., COUTINHO, H. D. M., ATHAYDE, M. L., BOLIGNON, A. A., ANDRADE, J. C., OLIVEIRA, L. R., KERTONPF, M. R., BARBOSA, R., CESARIO, F. R. A. S., COUTINHO, T. S., QUINTANS-JUNIOR, L. J., ROSE, I., MENEZES, A. Antimicrobial, Gastroprotective and Healing Effect of the Hydroalcoholic Extract of Astronium fraxinifolium. Letters in Drug Design & Discovery, v. 15, n. 3, p. 325-334, 2018)
MATOS, F. J. A. Introdução a Fitoquímica Experimental. Edições UFC, 1988.
MENEZES, A. M. S; RAO, V. S. Antiulcerogenic activity of Astronium urundueva. Fitoterapia, v.57, p.55-57,1986.
MONTANARI, R. M.; BARBOSA, L. C. A.; DEMUNER, A. J.; SILVA, C. J.; ANDRADE, N. J.; ISMAIL, F. M.D.; BARBOSA, M. C. A. Exposure to Anacardiaceae Volatile Oils and Their Constituents Induces Lipid Peroxidation within Food-Borne Bacteria Cells. Molecules. v.17, p.9728-9740, 2012.
MOURA, C.M. Contribuição à quimiotaxonomia de Anacardiaceae - estudo fitoquímico e das atividades antifúngicas e antitumorais de Astronium fraxinifolium Schott ocorrente no Cerrado. Dissertação (Mestrado em Ciências Médicas). Universidade de Brasília, 2014.
NASSIRI-ALS, M; SHARIATI-RAD, S; ZAMANSOLTAN, F. Anticonvulsive effects of intracerebroventicular administration of rutin in rats. Progress in NeuroPsychopharmacology & Biological Psychiatry, v. 32, p. 989-993, 2008.
ÖZÇELIK, B., ORHAN, D. D., ÖZGEN, S., ERGUN, F. Antimicrobial Activity of Flavonoids against Extended-Spectrum β -Lactamase ( ES β L ) -Producing Klebsiella pneumoniae. Tropical Journal of Pharmaceutical Research, 7(July), 1151–1157, 2008.
PALANISAMY, U. D., LING, L. T., MANAHARAN, T., & APPLETON, D. Rapid isolation of geraniin from Nephelium lappaceum rind waste and its anti-hyperglycemic activity. Food Chemistry, 127(1), 21–27, 2011.
PANDIT, S.S.; KULKARNI, R.S.; CHIDLEY, H.G.; GIRI, A.P.; PUJARI, K.H.; KÖLLNER, T.G.; DEGENHARDT, J.; GERSHENZON, J.; GUPTA, V.S. Changes in volatile composition during fruit development and ripening of ‘Alphonso’ mango. J. Sci. Food Agric. 89, 2071–2081, 2009.
PULIDO, R., BRAVO, L., SAURA-CALIXTO, F. Antioxidant activity of dietary polyphenols as determined by a modified ferric reducing/antioxidant power assay. Journal of Agricultural and Food Chemistry, 48(8), 3396–3402, 2000.
RESENDE, F. A.; CAMPOS, D. L.; DA SILVA, V. C.; DE GRANDIS, R. A.; SOUZA, L. P.; LEONARDO JUNIOR, C. S.; DA ROCHA, C.Q.; DOS SANTOS, L.C.; VILEGAS, W.; VARANDA, E. A. Mutagenicity and chemopreventive activities of Astronium species assessed by Ames test. Regulatory Toxicology and Pharmacology. v.72(3), p.506–513, 2015.
ROITMAN, J.N.; MERRILL, G.B.; BECK, J.J. Survey of ex situ fruit and leaf volatiles from several Pistacia cultivars grown in California. J. Sci. Food Agric. 91, 934–942, 2011.
ROSSO, R.; Avaliação das propriedades antioxidantes de derivados de esteres de ácido gálico. Dissertação de mestrado.Universidade Federal de Santa Maria, 2005.
ROSSO, R.; REGINATTO, F. H.; BARELLI, C.; LÜCKEMEYER, D. D.; KAPPEL, V.; LEAL, P. C.; YUNES, R. A.; NUNES, R. J.; CRECZYNSKI-PASA, T. B. Avaliação preliminar da atividade antimicrobiana de compostos fenólicos sintéticos. In: XXXVIII Congresso Anual da Sociedade Brasileira de Patologia Clínica. Divulgação digital, Florianópolis, Brasil, 2004.
SANTIN, D. A. Revisão taxonômica do gênero Astronium Jacq. e revalidação do gênero Myracrodruon Fr. Allem. (Anacardiaceae) Dissertação de mestrado, Universidade Estadual de Campinas, Campinas, 1989.
SANTOS, K. F. R.; OLIVEIRA, T. T; NAGEM, T. J.; PINTO, A. S.; OLIVEIRA, M. G. A., Hypolipidaemic effects of neringenin, rutin, nicotinic acid and their associations. Pharmacology Research, v. 40, p. 493-496, 1999.
SAVI, L. A; LEAL, P. C; VIEIRA, T. O; ROSSO, R; NUNES, R. J; YUNES, R. A; CRECZYNSKI-PASA, T. B; BARARDI, C. R. M; SIMOES, C. M. O. Evaluation of antiherpetic and antioxidant activies, and cytotoxic and genotoxic effects os synthetic alkyl-esters of gallic acid. Arzneimittel Forschung Drug Research, v. 55, p. 66-75, 2005.
SCHMOURLO, G., MENDONÇA-FILHO R.R.; ALVIANO, C.S.; COSTA, S.S. Screening of antifungal agents using ethanol precipitation and bioautography of medicinal and food plants. J. Ethnopharmacol. v. 96, p. 563-8, 2005.
SU, J. F. et al. Protection againts hepatic ischemiareperfusion injury in rats by oral pretreatment with quercetin. Biomedical and Environmental Sciences, v. 16, p. 1-8, 2003.
TALEB-CONTINI, S. H., SALVADOR, M. J., WATANABE, E., ITO, I. Y., & DE OLIVEIRA, D. C. R. Antimicrobial activity of flavonoids and steroids isolated from two Chromolaena species. Revista Brasileira de Ciências Farmacêuticas, 39(4), 403–408, 2003.
TAN, W. et al. Quercetin, a dietary-derived flavonoid, possesses antiangiogenic potential. European Journal of Pharmaceutics and Biopharmaceutics, v. 459, p. 255-262, 2003.
TRENTIN, D. S., SILVA, D. B., AMARAL, M. W., ZIMMER, K. R., SILVA, M. V., LOPES, N. P., GIORDANI, R. B., MACEDO, A. J. Tannins Possessing Bacteriostatic Effect Impair Pseudomonas aeruginosa Adhesion and Biofilm Formation. PLoS ONE, 8(6),(2013).
VIANA, G. S. B.; BANDEIRA, M. A. M.; MOURA, L. C.; SOUZA-FILHO, M. V. P.; MATOS, F. J. A.; RIBEIRO, R. A.;Analgesic and antiinflamatory effects of the tannin fraction and Myracrodruon urundueva Fr.All.Phytotherapy Research.v.11,p.118-122,1997.
VIANA, G. S. B; BANDEIRA, M. M. A; MATOS, F. J. A. Analgesic and antiinflamatory effects of chalcones isolated from Myracrodruon Allemão.Phytomedicine, v.10,p.189195,2003.
VIANA, G. S. B; BANDEIRA, M. M. A; RAO, V. S; Aroeira do sertão (Myracrodruon urundueva Fr.All):estudo botânico, farmacognóstico, químico e farmacológico. 2 ed.revisão e ampliada, Fortaleza, Edições UFC.1995.
WANG, Y., TANG, C., ZHANG, H. Hepatoprotective effects of kaempferol 3-O-rutinoside and kaempferol 3-O-glucoside from Carthamus tinctorius L. on CCl4-induced oxidative liver injury in mice. Journal of Food and Drug Analysis, 23(2), 310–317, 2015.
YANG, Y., XIU, J., LIU, J., ZHANG, L., Li, X., XU, Y., QIN C., ZHANG, L. Chebulagic acid, a hydrolyzable tannin, exhibited antiviral activity in vitro and in vivo against human enterovirus 71. International Journal of Molecular Sciences, 14(5), 9618–9627, 2013.
YAO, L. H., JIANG, Y. M., SHI, J., TOMÁS-BARBERÁN, F. A, DATTA, N., SINGANUSONG, R., & CHEN, S. S. Flavonoids in food and their health benefits. Plant Foods for Human Nutrition (Dordrecht, Netherlands), 59(3), 113–122, 2004.
YEPEZ, B., ESPINOSA, M., LOPEZ, S., BOLANOS, G. Producing antioxidant fractions from herbaceous matrices by super-critical fluid extraction. Fluid Phase Equilibr. 194, 879-884, 2002.
ZHOU, J., YOSHITOMI, H., LIU, T., ZHOU, B., SUN, W., QIN, L., GUO, X., HUANG, L., WU, L., GAO, M. Isoquercitrin activates the AMP-activated protein kinase (AMPK) signal pathway in rat H4IIE cells. BMC Complementary and Alternative Medicine, 14:42, 2014.











