Utilização da casca do jambo vermelho (Syzygium malaccense) como indicador de pH
ISBN 978-85-85905-23-1
Área
Produtos Naturais
Autores
Conceição, C.M.S. (UFPA - CUNTINS/ CAMETÁ) ; Melo Junior, J.G. (UFPA - CUNTINS/ CAMETÁ) ; Coelho, E.M. (UFPA - CUNTINS/ CAMETÁ) ; Lobato, R.P. (UFPA - CUNTINS/ CAMETÁ) ; Ribeiro, E.A. (UFPA - CUNTINS/ CAMETÁ) ; Amaral, J.M. (UFPA - CUNTINS/ CAMETÁ) ; Freitas, M.C.C. (UFPA) ; Silva, E.M. (UFPA - CUNTINS/ CAMETÁ) ; Carvalho, I.O. (UFPA - CUNTINS/ CAMETÁ)
Resumo
Este trabalho verificou o potencial da utilização do extrato de jambo vermelho para servir de alternativa como indicador natural de pH. Foi realizada revisão de literatura e experimentação no Laboratório de Química da UFPA-CUTINS, tendo sido obtido o extrato da casca do fruto; o preparo e aplicação do extrato de jambo para indicação de ácido-base; em soluções de uso doméstico. Evidenciou-se que as variações de cores indicam que o extrato de jambo pode ser aproveitado tanto como indicador de ácido- base quanto para indicador de pH. Com os resultados pode-se concluir que o efeito visual, a facilidade e o baixo custo de produção do extrato da casca do jambo o tornam indicador natural alternativo capaz de indicar soluções ácidas e básicas, servindo de recurso didático para o ensino de química.
Palavras chaves
indicador natural de pH; jambo vermelho; ensino de química
Introdução
O jambo é um fruto originário do continente asiático. No Brasil, encontrada principalmente nos estados da região Norte e Nordeste (COSTA et al., 2006). A sua aparência atraente em função das suas cores é apreciada, além de suas propriedades aromáticas e de sabor, sendo que entre os compostos que conferem tais propriedades estão as antocianinas são as principais responsáveis pela cor vermelha intensa da casca do jambo, sendo esta fonte destes corantes (TEIXEIRA et al., 2008; TERCI e ROSSI, 2002; apud AUGUSTA, 2011). As antocianinas são pigmentos da classe dos flavonóides presentes nas seivas das plantas. As transformações estruturais ocorrem de acordo com o pH do meio inserido e que são responsáveis pela variedade de cores observáveis fazendo com que esses pigmentos possam ser uteis como indicadores naturais de pH. O pH é uma escala de ácido-base que varia de 0 a 14, sendo que o pH entre 0 e próximo de 7 ela é considerada ácida e, acima de 7 até 14 é uma solução classificada como básica, já, a solução que tiver o pH 7 é avaliada como neutra. Existem muitos indicadores de pH tanto naturais (ex: açaí, ameixa, repolho roxo) quanto sintéticos (ex: fenolftaleína, azul de bromotimol). Esses corantes naturais são bastante uteis para serem empregados em aulas práticas do ensino de química. O fato da alteração de tom apresentar um efeito visual chamativo gerando o interesse dos alunos, tornando-se um meio para a aprendizagem dos alunos na disciplina de química (WOEHL JUNIOR & BISPO, 2010). Dentre os indicadores naturais está o jambo, que através do extrato obtido da sua casca procurou-se identificar soluções ácidas e básicas, sendo um meio de baixo custo para o uso como recurso didático para o ensino de conceitos de química no município de Cametá-Pará, objetivo desse trabalho.
Material e métodos
Os frutos de jambo utilizados na pesquisa foram adquiridos na feira municipal de Cametá-PA. As análises da pesquisa foram feitas no Laboratório de Química da UFPA-CUNTINS/ Cametá. Adaptando o método utilizado por Santos (2000) a obtenção do extrato se iniciou com a exposição do fruto em NaClO 10 ml diluídos em 2L de água destilada por um período de 10min para higienização. Logo após esse processo foram colocados os frutos em um recipiente coberto com jornal durante 24h para secagem do fruto e posteriormente a retirada de sua casca. Após este procedimento sempre em triplicata, pesou-se 100g de insumo e colocou-se na estufa à 45°C e sendo pesado a cada 2h até o material se manter com a massa constante. Na próxima etapa o material pesado foi colocado no liquidificador e triturado, em seguida, colocado no cadinho com proporção de 1:3 de etanol 70% e macerado após 20min de descanso. Logo após o suco foi filtrado a vácuo e o material foi estocado em frasco âmbar, este deixado em repouso na temperatura ambiente. Por fim, utilizado para os testes. Os resíduos sólidos foram descartados. Para os testes de indicação de ácido-base pela cor do extrato de jambo, foram feitas soluções tampões com pHs variando de 1 a 14 e comprovando os pHs pelo peagâmetro portátil Lutron Datalogger pH221. Foram utilizadas soluções de vinagre, água sanitária, detergente, sabão em pó filtrado, suco de laranja, HCl, NaCl, leite em pó, Sonrisal, solução tampão pH4, solução tampão pH7, NaOH, água da torneira e água destilada. Todas as soluções foram colocadas em tubos de ensaios seguindo a proporção: 10,0 ml de solução; 5,0 ml de extrato de jambo. Foram observados o pH e cor das respectivas soluções. A coloração do antes exposta na Tabela 1 e os tons após mistura com o extrato de jambo na figura 1.
Resultado e discussão
Após a realização do experimento foi possível identificar e classificar as
soluções, sendo perceptível a variação de cor concomitantemente com a
variação de pH, estando em destaque o extrato de jambo (figura 1). As
variações de cores observadas indicam que o extrato de jambo pode ser
aproveitado tanto como indicador de ácido-base quanto para indicador de pH,
corroborando o que foi asseverado por Woehl Junior e Bispo (2010) sobre a
utilização de corantes naturais como indicadores. É viável a utilização do
extrato de jambo durante as aulas de química experimental no ensino básico e
superior, pois apresenta a capacidade de indicar, em virtude da sua
diferença de coloração, o potencial hidrogeniônico: vermelho em soluções
ácidas variando a tonalidade de acordo com o pH (pH maior que 7), verde em
soluções básicas variando a tonalidade de acordo com a variação de pH (pH
menor que 7) e tom rosa no pH 7. O efeito visual e o baixo custo de produção
do extrato tornam o experimento uma boa alternativa no ensino de ciências e
química. Os testes foram feitos em diferentes pHs, os extratos adquirem
distintas colorações que podem ser facilmente observadas, definindo-se a
escala de pH em função da cor da solução resultante. Esse fenômeno ocorre
devido ao jambo (especificamente na casca) apresentar uma substancia
denominada antocianina, no qual, ao entrar em contato com soluções muda a
sua estrutura de acordo com a quantidade de hidrogênio ou hidroxila.
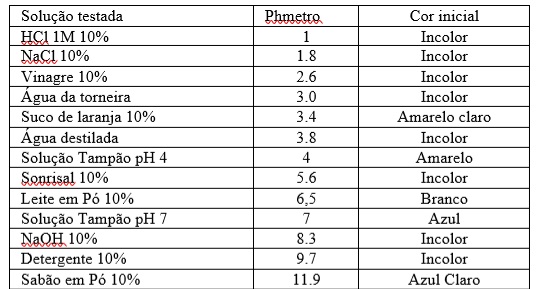
tabela de pH e cores das soluções antes de serem misturadas com o extrato de jambo.
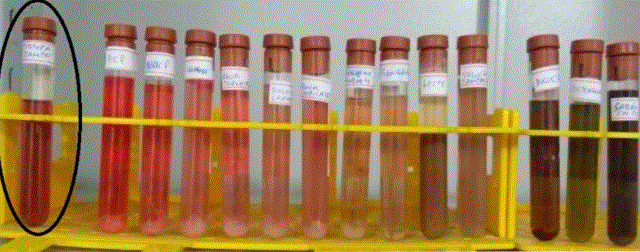
figura 1. Mostra as cores assumidas pelas soluções após misturados com o Extrato de Jambo.
Conclusões
A casca do jambo, fruto da região e de baixo valor de aquisição, por conter antocianina, é capaz de indicar soluções de caráter ácidas e básicas, se expressa com um significativo potencial em substituir indicadores convencionais. Proporcionando aos profissionais da educação, na disciplina de química, facilidade em seu processo de ensino através da utilização de corantes naturais como indicadores em experimentos e também em aulas práticas como auxilio didático. A partir dos resultados obtidos constatou-se que o extrato da casca do jambo serve para determinação de escalas de pH.
Agradecimentos
À Universidade Federal do Pará - Campus Universitário do Tocantins/Cametá, que possibilitou a realização deste trabalho em suas instalações.
Referências
AUGUSTA, I. M. Extração e secagem da casca de jambo vermelho (Syzygium malaccensis, (L) Merryl et Perry) para obtenção de corante. 2011. 134 f. Tese (Doutorado em Processos Químicos e Bioquímicos) – Universidade Federal do Rio de Janeiro, Rio de Janeiro, 2011.
COSTA, R. S.; OLIVEIRA, I. V. M.; MÔRO, F. V.; MARTINS, A. B. G. Aspectos morfológicos e influência do tamanho da semente na germinação do jambo-vermelho. Revista Brasileira de Fruticultura, v. 28, n. 1, p. 117-120, 2006.
GAMA, M. S.; AFONSO, J. C. De Svante Arrhenius ao peagâmetro digital: 100 anos de medida de acidez. Química Nova, v. 30, n. 1, p. 232-239, 2007.
SILVA, C. M.; BENCHIMOL, R. L.; VERZIGNASSI, J. R. Ocorrência de Colletotrichum sp. em jambo rosa (Syzygium jambos (l.) alston) na região metropolitana de Belém, PA. Reunião Anual da SBPC, 59., 2007 Belém, Resumos...Belém, PA: SBPC, 2007. 2p.
SOARES, M. H. F. B.; CAVALHEIRO, E. T. G.; ANTUNES, P. A. Aplicação de extratos brutos de flores de quaresmeira e azaléia e da casca de feijão preto em volumetria ácido-base. Um experimento para cursos de análise quantitativa. Química Nova, v. 24, n. 3, p. 232-239, 2001.
TEIXEIRA, L. N., STRINGHETA, P. C.; OLIVEIRA, F. A. Comparação de métodos para quantificação de antocianinas. Revista Ceres, v. 55, n. 4, p. 297- 304, 2008.
WOEHL JUNIOR, G. W.; BISPO, L. M. Corantes naturais extraídos de plantas para utilização como indicador de pH. 2010. Disponível em < http://www.ra-bugio.org.br/manutencao/uploaded/projetos/Artigo-Corantes_Naturais.pdf>. Acesso em: 20 de jul. 2018.











