Dimerização redutiva de haletos benzílicos via eletroquímica utilizando macroeletrodo bipolar de grafite em pó
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Lima, J.C. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Santos, J.A.M. (UNIVERSIDADE FEDERAL RURAL DE PERNAMBUCO) ; Navarro, M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO)
Resumo
Será descrito um novo método para redução de haletos benzílicos, sem a utilização de solventes e aditivos, através de reações de oxidação e redução eletroquímica em um macroeletrodo bipolar de grafite em pó. Foram utilizados o cloreto, brometo e iodeto de benzila, placas de platina atuando como eletrodos de acionamento, que ativam as extremidades do eletrodo de grafite em pó e uma solução aquosa de sulfato de sódio como eletrólito. O melhor resultado foi encontrado mantendo os eletrodos de acionamento em 0,5 cm de distância em relação às extremidades do eletrodo de acionamento, com corrente constante de 0,8 A e potencial constante de 30 V. Após extração dos produtos, os mesmos foram analisados em cromatógrafo a gás, apresentando taxas de conversão ao produto que variaram entre 25 e 92%.
Palavras chaves
eletroquímica bipolar; macroeletrodo bipolar; haletos benzílicos
Introdução
Da mesma forma que a eletricidade proveniente de fontes renováveis tem se tornado cada vez mais importante em nosso cotidiano, a síntese eletroquímica de compostos orgânicos está avançando cada vez mais para uma futura tecnologia chave na indústria química, representando então um método dentro dos parâmetros da química verde, rentável e sustentável (Hammerich e Speiser, 2015; Anastas e Eghbali, 2010). Frente a esses princípios, a utilização da eletroquímica bipolar surge como alternativa para o desenvolvimento de métodos eletroquímicos sem a utilização de solventes durante as reações, utilização de solução aquosa como eletrólito, e a formação ínfima de resíduos. Um eletrodo bipolar (EBP) é um material eletricamente condutor que promove reações eletroquímicas em suas extremidades (polos), na ausência de contato ôhmico direto (Karimian et al., 2019). Mais especificamente, quando uma tensão suficientemente alta (acima de 30 V) é aplicada entre os eletrodos de acionamento, em contato com a solução eletrolítica, ocorre a polarização nas extremidades do EBP, gerando um polo inverso ao polo do eletrodo de acionamento ao qual está direcionado, permitindo que ocorram reações de oxidação e redução nas extremidades de um único eletrodo (Crooks et al., 2013). Baseado nesse princípio, reações de oxidação e redução de espécies eletroativas podem ocorrer ao mesmo tempo, nessas extremidades, através de uma eletrolise pareada (Llorente et al., 2016). Por base no que foi descrito, esse trabalho tem como objetivo descrever um novo método eletroquímico empregando um macroeletrodo bipolar de grafite em pó para promover a redução eletroquímica de haletos benzílicos em condições baseadas no princípio da química verde.
Material e métodos
As eletrólises foram realizadas com uma fonte DC Power Supply FA-3005. Os haletos benzílicos foram obtidos pela Aldrich e o sulfato de sódio, utilizado como eletrólito, foi obtido através da Moderna, P.A. e foram usados sem tratamento prévio. O grafite utilizado foi obtido pela Aldrich e passou por tratamento térmico, sob temperatura de 280 ºC por 4h. O grafite utilizado como eletrodo bipolar foi adicionado a um tubo eppendorf confeccionado, e prensado sob peso de 2,5 kg por 10 minutos, com auxilio de um bastão de grafite. Os haletos benzílicos foram adicionados na extremidade catódica, onde sofrem redução, gerando o radical benzila com a saída do haleto correspondente. Após a preparação do eletrodo bipolar, o mesmo foi posicionado de forma perpendicular entre placas de platina (1,5 cm de largura e 4,0 cm de comprimento) utilizadas como eletrodos de acionamento nas eletrólises. Após as reações o material foi extraído do grafite através de filtração em papel filtro qualitativo, utilizando acetato de etila (3 x 10 mL), e analisado posteriormente em cromatógrafo a gás para obter a taxa de conversão do produto de interesse.
Resultado e discussão
No método desenvolvido foi empregado o sistema eletroquímico bipolar (Figura 1) onde foram realizadas reações de redução de haletos benzílicos (1a-c) adsorvidos na extremidade catódica do eletrodo bipolar, mantendo o potencial e corrente constantes (30 V e 800 mA respectivamente), com tempo de reação de 8h. Os resultados dos experimentos estão descritos na Tabela 1. Os resultados da Tabela 1, entrada 1, mostram uma proporção de rendimento do produto bibenzil (25%) e do tolueno (23%) quando partimos do reagente cloreto de benzila. Isso está de acordo com o elevado potencial de redução da ligação C-Cl (E = -1,45 V), que está acima do potencial de redução do radical benzila (E = -1,40 V). Isso favorece a reação de redução com a transferência de 2 elétrons, gerando o carbânion, seguido da formação do tolueno através da abstração de um próton no meio reacional. A redução do iodeto de benzila apresentou um rendimento do dímero bibenzil (92%) superior à redução do brometo de benzila (80%). Portanto esses dois últimos reagentes permitem obter o bibenzil de forma seletiva devido aos potenciais de redução das ligações C-I e C-Br inferiores ao potencial de redução do radical benzila. O bibenzil obtido a partir da dimerização do iodeto de benzila apresentou massa do produto isolado igual a 83%.
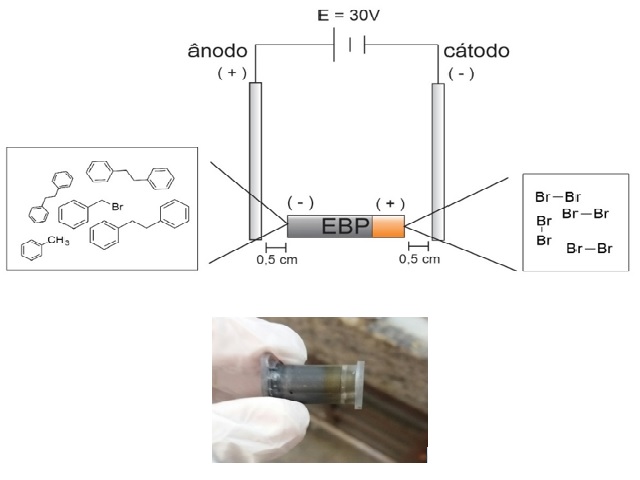
Figura 1 – representação do sistema eletroquímico bipolar na reação de dimerização redutiva do brometo de benzila.
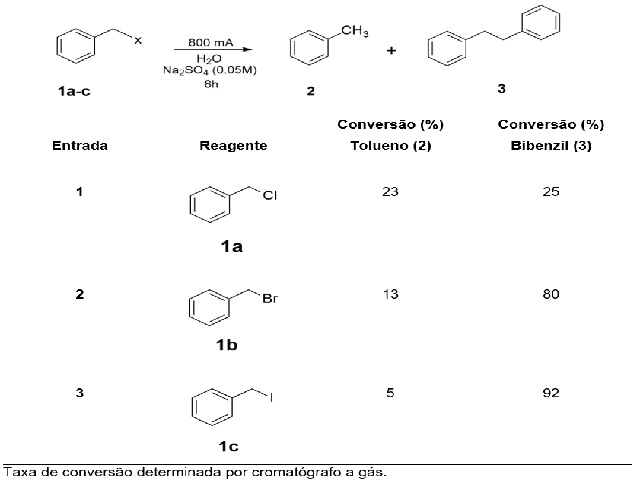
Tabela 1 - Resultados obtidos na redução de haletos de benzila (X = Cl, Br e I; 0,5 mmol). rendimento do produto de dimerização redutiva (bibenzil).
Conclusões
O método desenvolvido para eletrossíntese orgânica baseado na técnica eletroquímica bipolar apresentou bons rendimentos na formação do produto bibenzil nas reações de dimerização redutiva de haletos benzílicos, mostrando que o uso do EBP de grafite em pó apresenta potencial como método da química verde para aplicação em reações de síntese orgânica.
Agradecimentos
A CAPES pela bolsa fornecida.
Referências
ANASTAS, P.; EGHBALI, N. Green Chemistry: Principles and Practice. Chemical Society Reviews, v. 39, n. 1, p. 301–312, 2010.
CROOKS, S. E. et al. Bipolar Electrochemistry. Angewandte Chemie International Edition, v. 52, n. 40, p.10438-10456, 2013.
HAMMERICH, O; SPEISER, B. Organic Electrochemistry: Revised and expanded. 5. ed. New York: Taylor & Francis Group, p. 1716-1721, 2015.
KARIMIAN, N. et al. The principles of bipolar electrochemistry and its electroanalysis applications. Current Opinion in Electrochemistry, v. 17, p.30-37, 2019.
LLORENTE, Mark J. et al. Paired Electrolysis in the Simultaneous Production of Synthetic Intermediates and Substrates. Journal of The American Chemical Society, [s.l.], v. 138, n. 46, p.15110-15113, 2016.









