Síntese de 3-acetil-5-hidroxi-2-metil-1H-benzo[g]indóis via reação de anelação da bromo-benzoquinona catalisada por sal de cobre
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Leite, T.O.C. (UNIVERSIDADE FEDERAL FLUMINENSE) ; da Silva, M.F.V. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Dias, F.R.F. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Ferreira, V.F. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Cunha, A.C. (UNIVERSIDADE FEDERAL FLUMINENSE)
Resumo
Este trabalho descreve a síntese de derivados de 3-acetil-5-hidroxi-2-metil- 1H-benzo[g]indóis, os quais foram sintetizados com rendimentos que variaram de moderados a bons através da reação de condensação de β-enaminonas dicarboniladas derivadas de β-dicetona com 2-bromo-6-metoxi-1,4-benzoquinona, utilizando o acetato de cobre como agente oxidante e carbonato de potássio como base. As substâncias alvo tiveram suas estruturas elucidadas através das técnicas espectroscópicas como na região do Infravermelho (IV) e de Ressonância Magnética Nuclear de 1H e 13C.
Palavras chaves
indol; quinonas; estresse oxidativo
Introdução
Substâncias naturais e sintéticas contendo o grupo indólico têm grande importância do ponto de vista da Química Medicinal, devido apresentarem diversificadas atividades biológicas, dentre elas, antitumoral (AHMAD et al, p. 55, 2011), anti-inflamatória (CHOVATIYA et al, p. 281, 2014) e antiviral (DADASHPOUR et al, p.9, 2018). Relatos na literatura (BHADORIYA et al, p.466, 2015) mostram que o sistema indólico é considerado o grupo farmacofórico de inúmeros compostos bioativos. Além disso, a fusão do anel indólico ao sistema quinonoídico é uma estratégia bastante interessante por conta da diminuição da toxicidade cardíaca causada pelos inúmeros derivados de quinonas, como o fármaco doxorrubicina. Neste sentido, almeja-se a síntese de uma nova classe de quinonas aneladas com sistema pirrólico contendo diferentes grupamentos aromáticos ligados na posição N-1 do anel azólico.
Material e métodos
A determinação estrutural das substâncias foi realizada através de Ressonância Magnética Nuclear de Hidrogênio (RMN de 1H), Carbono (RMN de 13C) e Espectroscopia na região do Infravermelho (IV). As análises de Ressonância Magnética Nuclear (RMN) foram realizadas em espectrômetros Varian Unity (300 MHz e 500 MHz) tendo como referência interna o TMS. Os valores de deslocamentos químicos (δ) foram referidos em partes por milhão (ppm) em relação ao TMS e as constantes de acoplamento (J) em unidades de Hertz (Hz). A determinação das áreas dos sinais foi realizada por meio da integração eletrônica, sendo as multiplicidades descritas da seguinte forma: s- simpleto, d- dupleto, dd- duplo dupleto e m- multipleto. As análises de espectroscopia na região do Infravermelho foram realizadas em espectrofotômetro Perkin- Elmer FT-IR, modelos 1600 senes e espectrum One, de feixe duplo, em pastilhas de brometo de potássio anidro ou em feixe sobre janelas de cloreto de sódio em pastilhas de KBr anidro ou filme. Os valores para as absorções estão expressos em números de ondas, utilizando-se como unidade o centímetro recíproco (cm-1). Os pontos de fusão de todas as substâncias sintetizadas foram determinadas no aparelho de Fischer- Johns. O monitoramento das reações descritas anteriormente, foi realizado através da Cromatografia em camada delgada, em cromatofolhas de gel de sílica 60F-254, com 0,2 mm de espessura de camada (ref. 1.05554 Merck). As purificações das substâncias foram por técnicas cromatográficas como: cromatografia em coluna utilizando as sílicas dos tipos sílica gel 60; 0,063-0,200mm (ref.1.055554 Merck) ou sílica gel do tipo flash 230-400 Mesh ASTM (0,035-0,070mm, ref. Acros Organics) e por placa preparativa sílica gel do tipo 60 P F254P (ref. 1077472500 Merk).
Resultado e discussão
A síntese dos derivados de 1H-indol-4,7-dionas 5a-e está demonstrada no
Esquema 1. A reação da acetilacetona (1) com aminas aromáticas 2a-e na
presença de iodo molecular (XU et al, p. 2929, 2013) levou à obtenção dos
derivados de β-enaminonas correspondentes 3a-e com rendimentos que variaram
de moderados a bons. A purificação destes compostos foi feita por
cromatografia em coluna de gel de sílica, utilizando-se como eluente mistura
de n-hexano/acetato de etila 9:1 (v/v).
Por fim, a reação entre β-enaminonas carboniladas 3a-e com 2-bromo-6-metoxi-
1,4-benzoquinona (4) utilizando o acetato de cobre como agente oxidante e
carbonato de potássio como base (PUROHIT et al, p. 217, 2009) levou à
obtenção dos derivados de 3-acetil-5-hidroxi-2-metil-1H-benzo[g]indóis 5a-e
com rendimentos que variaram entre 43 a 55%. Esses compostos inéditos foram
purificados por cromatografia em coluna utilizando a mesma mistura de
solventes em concentração de 8:2 (v/v).
Os derivados de quinonas 5a-e tiveram suas estruturas confirmadas através de
análise por espectroscopia na região do infravermelho [(Pastilha de KBr 1
%), (cm-1)], RMN de 1H e de 13C - APT, em 1D e 2D, incluindo as técnicas de
COSY - 1H x 1H, HSQC (1H x 13C - 1JCH) e HMBC [1H x 13C – nJCH (n = 2 e 3)]
e espectrometria de massas de alta resolução.
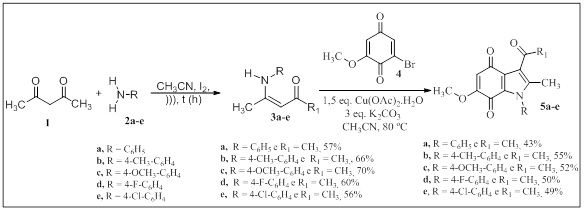
Síntese dos 3-acetil-5-hidroxi-2-metil-1H- benzo[g]indois 5a-e.
Conclusões
A rota sintética visando à preparação dos3-acetil-5-hidroxi-2-metil-1H- benzo[g]indóis 5a-e inéditas se mostrou eficiente, levando à obtenção dos derivados indólicos desejados com rendimentos que variaram de moderados a bons. Essas substâncias tiveram as suas estruturas confirmadas através de análise por espectroscopia na região do Infravermelho [(Pastilha de KBr 1%), (cm-1)], RMN de 1H e de 13C.
Agradecimentos
CAPES, Universidade Federal Fluminense (UFF), Programa de Pós-Graduação em Química da UFF (PPGQ-UFF), FAPERJ, PIBITI/CNPq e Laboratório de Compostos Bioativos (LaCBio).
Referências
AHMAD, A.; SAKR, W. A.; RAHMAN, K. M. W. Role of Nuclear Factor-kappa B Signaling in Anticancer Properties of Indole Compounds. Journal of Experimental & Clinical Medicine, v. 3, n. 2, 55-62, 2011.
BHADORIYA, K. S.; SHARMA, M. C.; JAIN, S. V.; Pharmacophore modeling and atom-based 3D-QSAR studies on amino derivatives of índole as potent isoprenylcysteine carboxyl methyltransferase (Icmt) inhibitors. Journal of Molecular Structure, v. 1081, 466-476, 2015.
CHOVATIYA, R.; MEDZHITOV, R. Stress, Inflammation, and Defense of Homeostasis. Molecular Cell. v. 54, 281-288, 2014.
DADASHPOUR, S.; EMAMI, S. Indole in the target-based design of anticancer agents: a versatile scaffold with diverse mechanism. European Journal of Medicinal Chemistry, n. 150, 9-29, 2018.
JAISHREE, B.; MANJULATHA, K.; GRISH, M.; ADIL, S.; PUROHIT, M. G. Synthesis and Biological Evaluation of Some N-substituted Indoles. Arkivoc, n. 12, 217-231, 2009.
XU, P.; HUANG, K.; LIU, Z.; ZHOU, M.; ZENG, M. An efficient and convenient synthesis of 1,2,3-trisubstituted pyrroles via iodocyclization from ethyl acetoacetate. Tetrahedron Letters, v. 54, 2929–2933, 2013.









