SÍNTESE DE UMA NOVA CLASSE DE FENILAMINO-1,4-BENZOQUINONAS
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Leite, T.O.C. (UFF) ; de Carvalho, B.L.C. (UFF) ; Silva, I.O. (UFF) ; Dias, F.R.F. (UFF) ; de Moraes, R.S.M. (UFF) ; Ferreira, V.F. (UFF) ; Cunha, A.C. (UFF)
Resumo
Este trabalho tem como objetivo a síntese de fenilamino-1,4-benzoquinonas com prospecção de sua atividade antimicrobiana. Os derivados de benzoquinonas foram preparados a partir da reação de adição do tipo 1,4 entre 2-bromo-6- metoxi-1,4-benzoquinona e anilinas para-substituídas. Surpreendentemente, os produtos obtidos desta reação foram originados do ataque nucleofílico das aminas aromáticas ao carbono adjacente ao carbono bromado da 2-bromo-6-metoxi- 1,4-benzoquinona. Os compostos alvo tiveram suas estruturas elucidadas através das técnicas de espectroscopia de infravermelho (IV) e de RMN de 1H e 13C.
Palavras chaves
Aminoquinona; Antimicrobiano; Estresse oxidativo
Introdução
As quinonas são amplamente distribuídas na natureza e participam de diversos processos bioquímicos vitais, tais como fotossíntese, produção de ATP e ação controladora da coagulação sanguínea (BOUFFIER et al, p. 103, 2012). Além disso, em estudos farmacológicos, estas substâncias e análogos relacionados mostram variadas biodinamicidades, destacando-se, dentre muitas, as propriedades microbicidas, tripanossomicidas, viruscidas, antitumorais e inibidoras de sistemas celulares reparadores (DA SILVA et al, p.407, 2003). A diversidade estrutural de derivados de quinonas de origens natural e sintética, associada às suas importâncias biológicas, tem despertado enorme interesse do nosso grupo de pesquisa com objetivo de propor modificações em suas estruturas que levem à formação de substâncias biologicamente mais potentes do que seus compostos correspondentes eleitos a protótipos (BOUFFIER et al, p. 103, 2012). Neste sentido, relatamos a síntese de derivados de fenilamino-1,4-benzoquinonas, os quais foram planejados a partir de estudos realizados recentemente em nosso grupo de pesquisa (DIAS et al, p. 1, 2018) sobre 7-anilino-isoquinolina-5,8-dionas possuidoras de atividade antimicrobiana promissora contra bactérias Gram-Negativas Escherichia coli e Pseudomonas aeruginosa.
Material e métodos
A determinação estrutural das substâncias sintetizadas foi realizada através dos métodos físicos de espectroscopia de Ressonância Magnética Nuclear de Hidrogênio (RMN de 1H) a 300 e 500 MHz e de Carbono 13 (RMN de 13C) a 75 e 125 MHz, por Espectroscopia de Infravermelho (IV) e por espectrometria de massas. Os espectros de RMN foram obtidos em aparelho VarianUnity de 300 ou 500 MHz e os deslocamentos químicos foram determinados utilizando-se TMS como referência interna. Os valores de deslocamentos químicos (δ) foram referidos em partes por milhão (ppm) em relação ao TMS e as constantes de acoplamento (J) em Hertz (Hz). Por intermédio dos sinais das integrações, as multiplicidades foram descritas da seguinte forma: s-simpleto; d-dupleto; t- tripleto; q-quarteto; qui-quinteto; m-multipleto, dd-duplo dupleto; ddd- duploduplo de dupleto. Os espectros na região do infravermelho foram obtidos em espectrofotômetro Perkin-Elmer, modelo 1600 senes e Spectrum One, de feixe duplo em pastilhas de KBr anidro. Os valores para as absorções foram expressos em número de onda, utilizando como unidade o centímetro recíproco (cm-1). Os pontos de fusão de todas as substâncias sintetizadas foram determinados em aparelho de Fisher-Johns. O espectro de massas de alta resolução (HRMS) foi realizado no espectrômetro de massas MICROMASS Q-TOF (Waters). No processo cromatográfico usado para purificação das substâncias foram usadas sílica gel do tipo flash 230 – 400 Mesh ASTM (0,035-0,070 mm, ref. AcrosOrganics) ou sílica gel 60, 0,063 – 0,200 mm (ref. 1.05554 MERCK).
Resultado e discussão
A reação de substituição eletrofílica aromática da vanilina (1) com bromo
molecular em meio de ácido acético levou à obtenção do 3-bromo-4-hidroxi-5-
metoxibenzaldeido (2) com rendimento de 95%, conforme Esquema 1 (CALDWELL et
al, p. 23, 2012). A reação de oxidação de Dakin da vanilina bromada (2) com
peróxido de hidrogênio em meio básico foi utilizada para preparação da 2-
bromo-6-metoxi-1,4-benzoquinona (3), com 65% de rendimento (MURAKAMI et al,
p. 383, 2002). Uma vez obtida a 2-bromo-6-metoxi-1,4-benzoquinona (3), esta
foi reagida em meio aquoso com anilina 4a e seus derivados para-substituídas
4b-e em banho de ultrassom (Esquema 2) (KROGER e DADAK, p. 328, 1969). Os
produtos que foram isolados através da técnica de cromatografia em coluna
não foram os formados pela substituição do átomo de bromo pelas aminas
aromáticas, mas sim os provenientes do ataque nucleofílico das aminas ao
carbono adjacente ao carbono bromado da substância 3. Os compostos 5a-e
foram obtidos com rendimentos que variaram entre 47 e 55%. Essas substâncias
tiveram suas estruturas confirmadas através das técnicas espectroscópicas de
RMN de 1H e 13C e de espectrometria de Massas.
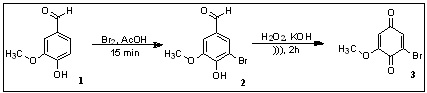
Preparação da 2-bromo-6-metoxi-1,4-benzoquinona (3).
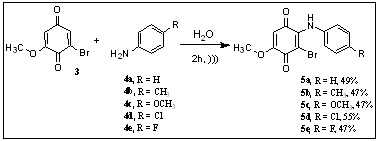
Preparação das fenilamino-1,4-benzoquinonas 5a-e.
Conclusões
A reação de bromação da vanilina foi realizada com sucesso, obtendo-se o 3- bromo-4-hidroxi-5-metoxibenzaldeido (2) com rendimento de 95%. A reação de oxidação de Dakin permitiu que o composto bromado fosse transformado em 2- bromo-6-metoxi-1,4-benzoquinona (3) com bom rendimento. Inesperadamente, a reação da substância 3 com anilinas aromáticas 4a-e levou à formação dos derivados de quinonas 5a-e, contendo um grupamento amino ligado ao carbono adjacente ao carbono bromado, ao invés dos produtos de substituição do átomo de bromo pelas espécies nucleofílicas nitrogenadas.
Agradecimentos
CAPES, Universidade Federal Fluminense (UFF), Programa de Pós-Graduação em Química da UFF (PPGQ-UFF), FAPERJ, PIBITI/CNPq e Laboratório de Compostos Bioativos (LaCBio).
Referências
BOUFFIER, L., GOSSE, I., DEMEUNYNCK, M., MAILLEY, P. Electrochemistry and bioactivity relationship of 6-substituted-4H-pyrido[4,3,2-kl]acridin-4-one antitumor drug candidates. Bioelectrochemistry, v. 88, 103-109, 2012.
CALDWELL, S.; MCPHAIL, D. B.; DUTHIE, C. G.; HARTLEY, R. Synthesis of Polyhydroxylated Flavonoids Bearing a Lipophilic Decyltailas Potential Therapeutic Antioxidants. Canadian Journal of Chemistry, v. 90, 23–33, 2012.
DA SILVA, M. N.; FERREIRA, V. F.; DE SOUZA, M. C. B. V. Um panorama atual da química e da farmacologia de naftoquinonas, com ênfase na b-lapachona e derivados. Química. Nova, v. 26, n. 3, 407-416, 2003.
DIAS, F. R. F.; NOVAIS, J. S.; DEVILLART, T. A. D. N. S.; DA SILVA, W. A.; FERREIRA, M. O.; LOUREIRO, R. S.; CAMPOS, V. R.; FERREIRA, V. F.; DE SOUZA, M. C. B. V.; CASTRO, H. C.; CUNHA, A. C. Synthesis and antimicrobial evaluation of amino sugar-based naphthoquinones and isoquinoline-5,8-diones and their halogenated compounds. European Journal of Medicinal Chemistry, v 156, 1-12, 2018.
KROGER, A.; DADAK, V. On the Role of Quinones in Bacterial Electron Transport. European Journal of Biochemistry, v. 11,328-340, 1969.
MURAKAMI, M.; NAKATANI, Y.; TANIOKA, T.; KUDO, I. Prostaglandin E synthase. Prostaglandis & Other Lipid Mediators, v. 68-69, 383-99, 2002.









