OBTENÇÃO E CARACTERIZAÇÃO DE (2E)-1-FENIL-3-(2-HIDRÓXI-FENIL)-PROP-2-EN-1-ONA E (2E)-1,3-BIS-FENIL-PROP-2-EN-1-ONA
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
do Rosário Costa, E. (UFPA) ; Victor F. da Luz, F. (UFPA) ; Rodrigues Bitencourt, H. (UFPA) ; P. S. Souza Filho, A. (EMBRAPA) ; L. dos Anjos, M. (UFPA) ; J. de Almeida Maciel, C. (UFPA) ; M. do Rosário Marinho, A. (UFPA) ; Ciriaco Pinheiro, J. (UFPA) ; P. da Costa Correa, J. (UFPA) ; Marcos F. Reis, A. (UFPA)
Resumo
Este trabalho relata síntese de duas chalconas: 2-hidróxi-chalcona (acetofenona condensando com salicilaldeído) e chalcona (acetofenona condensando com benzaldeído), utilizando a reação de condensação de Claisen- Schmidt. As substâncias foram obtidas com rendimento de 55,0% e 55,6%, respectivamente. Tendo sido caracterizadas por, RMN, EM e IV.
Palavras chaves
Chalcona; Métodos de Identificação; Condensação
Introdução
Chalconas são quimicamente definidas como cetonas alfa,beta-insaturadas, enonas, com o esqueleto 1,3-diaril-prop-2-en-1-ona. As Chalconas fazem parte da classe dos flavonóides, como uma de suas subclasses, onde tanto a carbonila quanto a porção olefínica estão ligadas a substituintes aromáticos. Possuem amplo espectro de atividade biológica, tais como antifúngica, antibacteriana, leishmanicida, entre outras (VOLTOLINI, 2010). São alvos de vários estudos de síntese, isolamento e identificação (DORNAS, et al., 2007). Existem alguns métodos relatados na literatura para a síntese desses compostos. No entanto, a síntese mais utilizada é a condensação de Claisen- Schmidt, entre derivados de acetofenona e benzaldeído. Essa reação é uma reação aldólica cruzada (SOLOMONS; FRYHLE, 2002). Este trabalho teve por objetivo sintetizar e caracterizar as substâncias 2- hidróxi-chalcona (1) e chalcona (2) (Figura 1), no decorrer do curso de Química Orgânica Experimental. Tais substâncias serão utilizadas posteriormente para preparação de derivados e testes biológicos.
Material e métodos
EQUIPAMENTOS UTILIZADOS: Espectrômetro de ressonância magnética nuclear Varian Mercury DX-300 e Espectrômetro de massas Waters Acquity TQD (Pós- Graduação em Química/ UFPA); espectrofotômetro de IV Thermo Electron Corporation modelo Nicolet 4700 FT-IR (Lacen-Eletronorte). PROCEDIMENTO DE OBTENÇÃO DAS SUBSTÂNCIAS: (2E)-1-fenil-3-(2-hidróxi-fenil)-prop-2-en-1-ona (2-HIDRÓXI-CHALCONA, 1): Em um Erlenmeyer de 250 mL foi adicionado, 20mL de MeOH, 10 mL de NaOH 50%, 3mL de acetofenona (~50mmol) e por último 5,2mL de aldeído salicílico (~50mmol). Essa mistura foi mantida em agitação (T.a.) por cerca de 3h e armazenada por 24 hs. Posteriormente, foi feita a acidificação utilizando ácido acético à 20% e armazenada em freezer para formação de um sólido que então foi submetido a filtração e lavagem com água. O sólido resultante foi recristalizado em metanol. Apresentou-se como um sólido cristalino caramelo amarelado. Fornecendo 6,2g (Rendimento de 55% %). (2E)-1,3-Bis-fenil-prop-2-en-1-ona (CHALCONA, 2): Em um Erlenmeyer de 250 mL foi adicionado, 20mL de MeOH, 10 mL de NaOH 50%, 6mL de acetofenona (50mmol) e por último 5,4mL de benzaldeído (50mmol). Essa mistura foi mantida em agitação (T.a.) por cerca de 3h e armazenada por 24 hs. Posteriormente, foi armazenada em freezer para formação de um sólido que então foi submetido a filtração e lavagem com água. O sólido resultante amarelo pálido foi recristalizado em metanol. Pf. 53,5-54ºC (MeOH). Fornecendo 5,8g (Rendimento de 55,6%).
Resultado e discussão
-(2E)-1-FENIL-3-(2-HIDRÓXI-FENIL)-PROP-2-EN-1-ONA:
RMN-1H (300MHz; CDCl3; ppm) 7,60 (dd, 1H, J=1,5Hz, J=7,5Hz; H-6), 6,90 (d,
1H, J=7,5Hz; H-3), 6,97 (dd, 1H, J=7,5Hz, J=7,8Hz; H-5), 7,28 (ddd, 1H,
J=7,8Hz, J=7,5Hz, J=1,5Hz; H-4), 8,15 (d, 1H, J=16Hz; H-7), 7,70 (d, 1H, J=
16Hz; H-8), 8,03 (dt, 2H, J=0,9Hz, J=8Hz; H-2´ e H-6´), 7,50 (dd, 2H, J=8Hz,
J=8Hz; H-3´ e H-5´), 7,57 (tt, 1H, J=8Hz, J=0,9Hz; H-4´).
IV (KBr): 3215, 2725, 1638, 1596, 1582, 1459, 1346, 1300, 1022, 858, 748.
EM: 224,4 (7%; [M-H]+), 105 (100%, A1+).
-(2E)-1,3-BIS-FENIL-PROP-2-EN-1-ONA:
RMN-1H (300MHz; CDCl3) : 7,65 (dd, J=7,1Hz e J=2,3Hz, 2H; H-2 e H-6), 7,42
(dd, J=7,1Hz e J=7,1Hz, 2H; H-3 e H-5), 7,42 (dd, J=7,1Hz e J=2,3Hz; H-4),
7,81 (d, 1H, J= 16Hz; H-7), 7,54(d, 1H, J= 16Hz; H-8), 8,02(dd, J=7,0Hz e
J=1,6Hz, 2H; H-2´ e H-6´), 7,51(tt, J=7,0Hz e 1,6Hz, 2H; H-3´ e H-5´),
7,59(tt, J=7,0Hz e J=1,6Hz, 1H; H-4´).
IV (KBr): 3082, 3025, 1663, 1606, 1574, 1496, 1447, 1335, 1309, 1033, 844,
752 .
EM: 209,26 (76%; [M-H]+), 131 (100%, B1+).
As substâncias em questão poderam ser caracterizadas pelo RMN de hidrogênio
verificando o sistema AB do tipo trans para H-8 e H-7 como um dupleto, com
J=16Hz, típico das chalconas. Ambos os espectros indicam outros sinais. No
infravermelho, é possível verificar entre outros o estiramento da carbonila,
(1638 e 1663cm-1). Enquanto no Espectro de massas ós picos dos íons
correspondente a massa molar de cada uma.
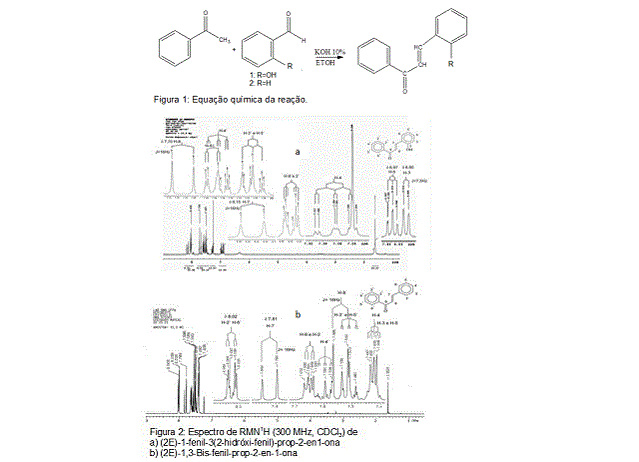
Equação química da reação e espectro de RMN-H das substâncias
Conclusões
As substâncias sintetizadas possuem interesse, tanto do ponto de vista de pesquisa em si, quanto do ponto de vista didático acadêmico. São substâncias potencialmente com atividades biológicas, que podem ser inclusive feitos derivados para a busca de outros derivados. Do ponto de vista acadêmico, os alunos da disciplina tiveram a oportunidade de utilizar as variadas técnicas estudadas no decorrer do curso. Sendo que tais técnicas confirmam e agregam dados necessários para a caracterização da estrutura das substâncias.
Agradecimentos
À instituição Universidade Federal do Pará e aos alunos e professores.
Referências
DORNAS, W. C.; OLIVEIRA, T. T.; RODRIGUES-DAS-DORES, R. G.; SANTOS, A. F.; NAGEM, T. J. Flavonóides: potencial terapêutico no estresse oxidativo. Rev. Ciênc. Farm. Básica Apl, v. 28, n.3, p. 241- 249, 2007
SOLOMONS, T. W. G.; FRYHLE, C. B. Química Orgânica 2. 7. ed. Rio de Janeiro: LTC, 2002.
VOLTOLINI, B.G.. Obtenção de Chalconas Heterocíclicas Via Condensação de Claisen-Schmidt e Avaliação do seu Potencial como Inibidores de Enzima YopH. 2010. 62 f. Relatório – Universidade Federal de Santa Catarina, Brasil, 2010.









