Derivados aminoquinolínicos com potencial atividade biológica: síntese e caracterização.
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Farias de Oliveira, T. (UFAL) ; Teixeira da Silva, E. (UFAL) ; Roberto Meneghetti, M. (UFAL) ; Costa Souza Barros, D. (UFAL)
Resumo
As quinolinas são um grupo de compostos bem conhecidos farmacologicamente pelo extenso espectro de atividades biológicas que apresentam, por exemplo, antifúngica, antibacteriana, antiviral, antimalárica, entre outras. Nesse trabalho são descritas a síntese e a caracterização de 4 derivados 4- aminoquinolínicos que foram obtidos ao reagir o composto 4,7-cloroquinolina, através de uma reação de substituição nucleofílica, com aminas primárias. Os compostos até agora obtidos, N-(2-aminoetil)-7-cloroquinolin-4-amina (CEQ), N-(2-aminoetil)-N-(naftalen-1-il)etano-1,2-diamina(MAQ),N-(prop-2- inil)-7-cloro-quinolin-4-amina (PCQ) e N-(7-cloroquinolin-4-il) benzeno-1,4- diamina (CPQ), apresentaram rendimentos entre 50-90%. E foram caracterizados utilizando-se as técnicas de análise de RMN H, RMN C.
Palavras chaves
Atividade farmacológica; Síntese; Aminoquinolínicos.
Introdução
Compostos contendo um núcleo quinolínico, muito encontrado em produtos naturais e fármacos sintéticos, apresentam uma grande aplicabilidade na química medicinal, pois constituem um grupo de moléculas bioativas relativamente grande, e em constante crescimento. Diante disso, a síntese de novos derivados quinolínicos vem se tornando, cada vez mais, uma ferramenta de grande interesse e destaque, advinda principalmente, da versatilidade desses novos compostos, em função da ampla atividade farmacológicas apresentada por essas moléculas, tais como atividade antimalárica, antifúngica, antibacteriana, antiviral, anti-inflamatória, antitumoral, entre outras. As posições mais reativas do anel quinolínico, nas reações de substituições nucleofílicas aromáticas, estão principalmente nos C2 e C4, devido à formação de intermediários mais estáveis nessa posição do anel contendo o átomo de nitrogênio. Apesar da grande potencialidade biológica dos compostos contendo o núcleo quinolínico, o surgimento de resistência por parte dos patógenos a vários desses derivados vem sendo um grande problema no controle das respectivas doenças que estes podem causar. Assim, torna-se extremamente importante visualizar novas moléculas que podem ser obtidas a partir de modificações estruturais daquelas já existentes e que apresentem uma eficácia similar ou maior que o composto inicial, além de uma menor toxidade. Nesse trabalho foram sintetizados alguns derivados 4- aminoquinolínicos para serem avaliados posteriormente quanto a sua potencial atividade farmacológica.
Material e métodos
Todas as etapas reacionais para obtenção dos derivados quinolínicos foram realizadas a partir da modificação do composto 4,7-dicloroquinolina. Essas transformações ocorreram sob refluxo, agitação magnética e tempo de reação não ultrapassando a mais de 8 horas de reação. Na primeira reação, o composto N-(2-aminoetil)-7-cloroquinolin-4-amina (CEQ) foi preparado reagindo-se 4,7-dicloroquinolina e etileno diamina. A mistura foi colocada em refluxo e tratada com solução aquosa de hidróxido de sódio. O composto N1-(2-aminoetil)-N2-(naftalen-1-il)etano-1,2-diamina (MAQ) foi obtido reagindo-se a 4,7-dicloroquinolina com o dietilenotriamina em etanol sob agitação e refluxo. Após a reação a mistura foi tratada com solução de hidróxido de sódio, extraída com acetato de etila e a fase orgânica recuperada foi seca à vácuo. O composto N-(prop-2-inil)-7-cloro-quinolin-4- amina (PCQ), foi sintetizado a partir de uma mistura de 4,7-dicloroquinolina e propargilamina tendo-se como solvente uma mistura de fenol/etanol que foi deixada sob agitação e refluxo. Ao final do período de reação, adicionou-se uma solução aquosa de hidróxido de sódio, a mistura foi lavada com acetato de etila. A fase orgânica foi recuperada, seca à vácuo e purificada em coluna cromatográfica. O composto N-(7-cloroquinolin-4-il)benzeno-1,4- diamina (CPQ) foi sintetizado utilizando 4,7-dicloroquinolina, p- aminoanilina, etanol e ácido p-toluenossulfônico, a mistura reacional foi aquecida sob refluxo e a solução resultante foi filtrada, lavada com etanol e seca à vácuo.
Resultado e discussão
A principal estratégia de síntese adotada foi a substituição nucleofílica na
posição C-4 do anel quinolínico utilizando como composto de partida a CEQ
(Esquema 1). Os derivados foram obtidos em tempo reacionais entre 3 e 8
horas e com rendimentos que variavam entre 50 e 90%, como mostrado na tabela
1. Também foram realizadas medições do ponto de fusão dos compostos isolados
(Tabela 1). As estruturas dos compostos sintetizados foram caracterizadas
pelas técnicas espectrométricas convencionais, RMN1H e 13C. A figura 1
apresenta o RMN 1H da CEQ e mostra os deslocamentos químicos para os cinco
sinais dos hidrogênios quinolínicos que apresentaram variações de δ=8,35 a
6,56 ppm, divergindo apenas no maior número de hidrogênios alifáticos, que
apresentaram dois sinais nos deslocamentos δ=3,44 e 2,96 ppm. No espectro da
MAC (Figura 2) é observado cinco sinais referentes aos hidrogênios
aromáticos com deslocamentos químicos (δ) entre 8,36 e 6,56 ppm, e três
sinais para os hidrogênios metilênicos com deslocamentos químicos (δ) entre
3,50 e 2,80 ppm o que comprova a formação do composto. A figura 3 apresenta
o RMN 1H da PCQ e mostra a presença de cinco sinais para hidrogênios
aromáticos com deslocamentos químicos entre δ=8,43 e 6,67 ppm e três sinais
para os hidrogênios alifáticos com δ=4,18 a 2,66 ppm. O sinal com δ= 2,66
ppm é referente ao sinal do hidrogênio ligado ao carbono metínico terminal.
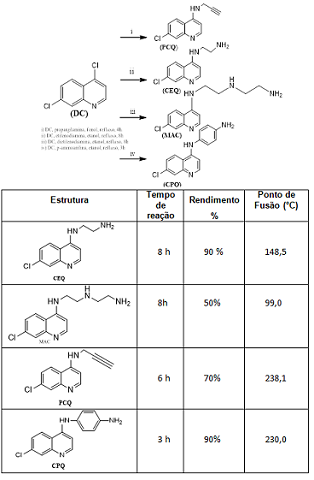
Esquema 1 – Síntese dos derivados aminoquinolínicos e Tabela 1 . Tempo de reação, rendimentos e ponto de fusão dos derivados aminoquinolínicos.
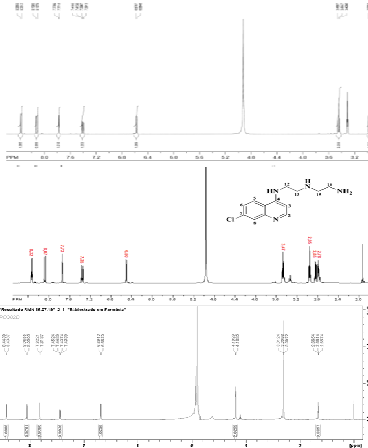
Espectro de RMN H dos compostos CEQ, MAC e PCQ, respectivamente.
Conclusões
Os derivados foram obtidos com bons rendimentos nas condições reacionais utilizadas e após a purificação dos compostos. As estruturas dos compostos foram e estão sendo elucidadas utilizando as técnicas de RMN de 1H, 13C e IV, e posteriormente serão enviadas para avaliar as possíveis atividades biológicas.
Agradecimentos
UFAL, IQB, ICF, PPGQB, PPGCF, IFAL, Capes, CNPq e Fapeal.
Referências
AHMAD, N. M. Quinolines. In: LI, J. J.; GRIBBLE, G. Palladium in Heterocyclic Chemistry. 2. ed; Elsevier, v. 26, Cap. 12, p. 658, 2006.
Benard, C.; Zouhiri, F.; Normand-Bayle, M.; Danet, M.; Desmaele, D.; Leh, H.; Bioorg. Med. Chem. Lett. 2004, 14, 2473.
Deady, L W.; Desneves, J. A.; Kaye, A. J.; Finlay, G. J.; Denny, W. A.; Bioorg. Med. Chem. 2000, 8, 977.
FRANÇA, T. C. C.; SANTOS, M. G.; FIGUEROA-VILLAR, J. D. 2008. Malaria: aspectos históricos e quimioterapia. Química Nova 31(5): 1271-1278.
Kouznetsov, V. V; Méndez, L. Y. V.; Meléndez, C. G. M.; Current Organic Chemistry 2005, 9, 141.
KUMAR, A. et al. 4-Anilinoquinoline triazines: A novel class of hybrid antimalarial agents. European Journal of Medicinal Chemistry, v. 46, p.676-690, 2011.
RYCKEBUSCH, A., Garcin, D., Lansiaux, A., Goossens, J.F., Baldeyrou, B., Houssin, R. Bailly, C.,Hénichart, J.P., 2008. J. Med. Chem. 51, 3617.
Review on Current Developments of Quinoline-Based Anticancer Agents. Arabian Journal of Chemistry. Etawah(UP) v. 74, p. 03-95, 2015.
RUDRAPAL, M.; CHETIA, D.; PRAKASH, A. Synthesis, antimalarial-, and antibacterial activity evaluation of some new 4-aminoquinoline derivatives. Medicinal Chemistry Research. v. 22, p. 3703–3711, 2013.
SRIVASTAVA, S.K., Khan, M. Khanuja, S.P.K., 2005. US 6,893,668 B2.
S. JAIN, V. Chandra, P. Kumar Jain, K. Pathak, D. Pathak, A. Vaidya. Comprehensive
THI, H. T. N. et al. Antiprion activity of functionalized 9-aminoacridines related to quinacrine. Bioorganic & Medicinal Chemistry. V. 16, p. 6737–6746, 2008.
Tempone, A. G.; da Silva, A. C. M. P.; Brandt, C. A.; Martinez, F. S.; Borborema, S. E. T.; da Silveira, M. A. B.; de Andrade, Jr., H. F.; Antimicrob. Agents Chemother. 2005, 49, 1076.









