Síntese, caracterização e atividade antibacteriana 1,2,4 oxadiazóis com o núcleo 3,4 metilenodioxi
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Bezerra, L.A.B. (UFRPE) ; Bezerra, G.B. (UFRPE) ; Ramos, C.S. (UFRPE)
Resumo
O grupo 3,4 metilenodioxi está presente em diversos compostos bioativos como safrol, metilenodioximetanfetamina, piperina e etc, sendo um grupo com potencial ação farmacológica. Os 1,2,4 oxadiazóis são uma classe de heterocíclicos bastante estudada, com diversas propriedades biológicas sendo constituinte nos fármacos Oxolamina e Ataluren. Nesse trabalho é relatado a síntese, caracterização e atividade antibacteriana de dois 1,2,4 oxadiazóis contendo o grupo 3,4 metilenodioxi sintetizados em micro-ondas doméstico, com rendimentos 45% a 84%, caracterizados por infravermelho, ressonância magnética nuclear 13C e 1H, onde os 1,2,4 oxadiazóis apresentaram bons resultados frente as bactérias Staphylococcus aureus, Bacillus subtilis, Enterococcus faecalis, Escherichia coli e Klebsiella pneumoniae.
Palavras chaves
Oxadiazois; antibacteriana; 3,4 metilenodioxi
Introdução
Diversas revisões destacam o potencial biológico de compostos com o grupo 3,4 metilenodioxi como percussor de moléculas biologicamente ativas, destaque para o safrol (LIMA ,2015) e a piperina (QU et al,2015).Os 1,2,4 oxadiazois são heterocíclicos de 5 membros composto por 2 carbonos, 2 nitrogênios e um oxigênio, sintetizados pela primeira vez em 1884, os principais estudos decorrentes dessa classe de compostos são na área de materiais e bioativos (FREITAS et al, 2012), cuja investigação farmacológica acarretou na descoberta dos fármacos: oxolamina ,um antipirretico, e o Ataluren, usado no tratamento da distrofia muscular de Duchenne. Os oxadiazois podem ser sintetizados por diversos métodos, destaque para os métodos que usam ésteres e amidoximas que são: refluxo, irradiação de micro-ondas (BARROS et al,2014) e super base (BAYKOV et al,2018). Nesse trabalho descrevemos a síntese dos 1,2,4 oxadiazois com o núcleo 3,4 metilenodioxi por micro-ondas doméstico, usando ésteres e amidoximas, e avaliação da atividade bacteriostática foi feita pelo método CMI (Concentração Mínima Inibitória).
Material e métodos
Os ésteres e amidoximas usados foram previamente purificados e caracterizados por Infravermelho, os solventes utilizados comercialmente obtidos grau P.A. Foram utilizados dois ésteres para a síntese dos 1,2,4 oxadiazóis, o 3,4 metilenodioxi cinamato de etila , a proporção usada 1.0 eq. dos ésteres, 1.3 eq. das amidoximas (4 piridina e p- toluil) e 1.5 eq. do carbonato de potássio anidro. misturou-se os reagentes em um reator de vidro aberto, adicionou-se 7 a 10 gotas de DMF (dimetiformolamida) e homogenizou-se a mistura, a reação foi conduzida por micro-ondas doméstico (Electrolux MEF41) na potência máxima do aparelho (esquema 1), as reações foram monitoradas por cromatografia de camada delgada (CCD) com clorofórmio como fase móvel, os espectros de RMN de 13C e 1H foram obtidos no espectrômetro VARIAN modelo Unity Plus (300 MHz), usando CDCl3 como solvente e tetrametilsilano como padrão interno . A atividade antimicrobiana foi realizada pelo método CMI (concentração mínima inibitória) através da técnica de micro diluição em multiplacas com 96 poços, conforme o Clinical and Laboratory Standards Institute, utilizando o meio liquido MH (Mueller Hinton) para as bactérias e o fármaco Metronidazol como padrão, os microrganismo testados foram Staphylococcus aureus, Bacillus subtilis , Enterococcus faecalis, Escherichia coli e Klebsiella pneumoniae, os compostos foram diluídos em DMSO (dimetilsulfoxido) nas concentrações de 2550; 1250; 625; 312,5; 156,2; 78,1; 39,0; 19,5µg/µL, as microplacas foram cultivadas em estufa a 37 ºC por 18 a 24 horas.
Resultado e discussão
Os compostos obtidos com reduzidos tempos reacionais foram purificados por cromatografia em coluna de sílica gel com fase móvel hexano/acetato de etila (7:3), sendo obtidos com rendimentos considerados de bom à moderado, e ponto de fusão característicos, como descrito na tabela 1.
Os compostos sintetizados foram caracterizados pelas técnicas espectroscópicas convencionais RMN 1H, 13C e IV. A análise de RMN 13C do composto 1, revelou deslocamento químico em δ 101,7ppm referente ao metileno do grupo metilenodioxi, em δ 148,3 e δ143,4 ppm correspondente aos carbonos quaternários na posição 3 e 4 do anel aromático e em δ 128,62 ppm o carbono quaternário da ligação insaturada da cadeia, em δ 167 e δ 176,05 ppm referente aos carbonos do núcleo oxadiazol, em δ 128 ppm atribuído ao carbono quaternário do anel piridinico e em δ 121,3 ppm e 150,47 ppm refrente aos outros carbonos desse anel.
Os 1,2,4 oxadiazóis submetidos aos testes antimicrobianos revelaram resultados promissores (Quadro 1), inibindo o crescimento na menor concentração testada 19,5μg/mL, frente à bactéria gram positiva Staphylococcus aureus, considerada uma bactéria resistente a antibióticos comercias. O composto 1 também apresentou um bom resultado frente à bactéria gram positiva B. subtilis com CMI 625 μg/mL. Os compostos sintetizados exibiram CMI de 19,5 e 312,5 μg/mL frente à bactéria gram negativa K. pneumoniae, correspondendo a um ótimo resultado, por ser considerada uma bactéria super-resistente a antibióticos comercias. Para as bactérias E. coli e E. faecalis os compostos exibiram CMI de 2500 μg/mL. O controle positivo, metronidazol, inibiu os microrganismos em todas as concentrações testadas (19,5–2500) μg/mL, o que não foi verificado para a bactéria K. pneumoniae.

Rendimento, tempo reacional e ponto de fusão dos 1,2,4 oxadiazóis sintetizados
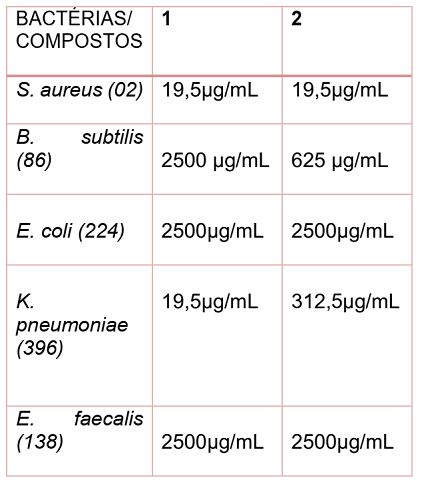
Concentrações mínimas inibitórias dos 1,2,4 oxadiazóis.
Conclusões
Os resultados obtidos demostram que os 1,2,4 oxadiazois contendo o núcleo 3,4 metilenodioxi possuem atividade antibacteriana frente aos microrganismos testados.
Agradecimentos
CAPES, CNPQ e FACEPE pelo suporte financeiro.
Referências
BARROS, C. J. P.; SOUZA, Z. C.; FREITAS, J. J. R.; DA SILVA, P. B. N.; MILITÃO, G. C. G.; SILVA, T. G.; FREITAS, J. C. R.; FILHO, J. R. F. J. Chil. Chem. Soc., 59, nº 1, 2359-2362. 2014.
BAYKOV, S.; SHARONOVA, T.; OSIPYAN, A.; ROZHKOV, S.; SHETNEV, A.; SMIRNOV, A.. Tetrahedron Letters., 57, 2898, 2016.
FREITAS, J. J. R.; SILVA, E. E.; REGUEIRA, J. L. L. F.; DE ANDRADE, S. A.; CALVALCANTE, P. M. M.; OLIVEIRA, R. N.; FREITAS FILHO, J. R, Rev. Virtual Quim., 4 (6), 670-691, 2012.
H. QU, M. LV e H. XU, Mini-Reviews in Medicinal Chemistry, Vol 15, No. 2, 2015.
LIMA, L.M , Rev. Virtual Quim.,7 (2), 495-538, 2015.









