Análise do Ponto de Fusão de Sais em degradação para utilização acadêmica.
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Simpson da Luz, M. (CEULM/ULBRA) ; Rocha Fonseca de Assis, J. (CEULM/ULBRA) ; Teixeira Pismel, R. (CEULM/ULBRA) ; Coutinho de Souza, J. (CEULM/ULBRA) ; de Lima Basilio, M.A. (CEULM/ULBRA) ; Colares dos Santos, W. (CEULM/ULBRA) ; Santana Soares, H.M. (CEULM/ULBRA) ; Silva da Paz, I. (CEULM/ULBRA) ; de Oliveira Rodrigues, P. (CEULM/ULBRA) ; Bentes de Vasconcelos, E. (CEULM/ULBRA) ; de Souza Oliveira, L.G. (CEULM/ULBRA)
Resumo
Esta análise visa verificar a pureza de sais, através de seu ponto de fusão correspondente ao determinado produto, quando sujeitos a fatores de alterações como: prazo de validade e condicionamento do reagente, qualificando-o para descarte, contudo ainda válido para fins acadêmicos. Os sais foram transferidos para tubo de Duran, levados aos aquecimento em imersão de óleo mineral, até atingir o seu ponto de fusão correspondente ou aproximado e observou-se a temperatura inicial, até que a substância presente fundisse por completo. Estes testes qualitativos são válidos para detectar alterações, adulterações, contaminações ou erros grosseiros. Para investigar a conformidade do reagente, este teste é de suma importância para informar o grau de pureza do material, mesmo em pequenas quantidades.
Palavras chaves
Tubo de Duran; Ponto de Fusão; Pureza.
Introdução
Os pontos de fusão são usados para ajudar a determinar a pureza e identificação dos sólidos. O ponto de fusão é a temperatura na qual o material funde à pressão atmosférica (Fessenden, Fessenden, & Feist, 2000). A maioria dos compostos orgânicos cristalinos tem pontos de fusão característicos que são suficientemente baixos (50 - 300 °C) para serem convenientemente determinados com equipamento simples (Klepper, 2009), e os compostos inorgânicos são superiores. Químicos orgânicos rotineiramente usam pontos de fusão (a) para obter uma indicação da pureza dos compostos cristalinos e (b) para ajudar a identificar tais compostos. Quanto a indicação de pureza, a presença de uma pequena quantidade de impureza modifica o ponto de fusão do composto em alguns graus e ampliará a faixa de temperatura do ponto de fusão (Brittain, 2009). Um amplo intervalo de fusão (mais de 5 °C) geralmente indica que a substância é impura; um intervalo de ponto de fusão estreito (0.5 - 2 °C) geralmente indica que a substância é razoavelmente pura (Klepper, 2009). No entanto, existem algumas exceções para essas duas generalizações. Pequenas diferenças no ponto de fusão (na ordem de 2 - 3 ° C) também podem resultar de variações na técnica, precisão do termômetro e a experiência da pessoa que faz a determinação do ponto de fusão (Klepper, 2009).Com o objetivo de verificar a pureza dos reagentes utilizados no ambiente de ensino, este trabalho reporta um estudo em uma amostra de reagentes químicos diferentes.
Material e métodos
Todo o procedimento experimental foi realizado no Laboratório de Química Analítica do Centro Universitário Luterano de Manaus (CEULM/ULBRA). Os reagentes analisados estavam todos fora do prazo de validade e muitos não se obtém informação do fabricante. Primeiramente foram separados os reagentes e buscou-se na literatura os seus respectivos pontos de fusão. Para montagem do sistema foram utilizados os seguintes materiais: béquer de 125 mL, barbante, chapa aquecedora, espátulas, garra metálica, tubos de Durham, termômetros de até 150 º C, suporte universal e óleo mineral.Com o sistema montado, transferiu-se cada sal para o tubo de Durham até atingir a metade, em seguida amarrou-se com barbante juntamente com o tubo de ensaio e o termômetro (formando um conjunto). Esse conjunto foi submerso em óleo mineral previamente colocado em béquer de aproximadamente 125 mL, de forma que o tubo de Durham não fosse coberto por completo pelo óleo e então ligou- se a chapa aquecedora. Em seguida, observou-se atentamente cada tubo de ensaio até que eles iniciassem o processo de fusão, anotou-se todas as temperaturas em planilha, com tempo inicial em 0 min., e variando a cada 5 min., até que a substância fundisse por completo (totalizando aproximadamente 20 min.).
Resultado e discussão
Para os reagentes analisados, observou-se que seis fundiram e três não. Os
que não alcançaram o resultado esperado foram: 1- Sulfato de Níquel
hexahidratado (Ni2SO4.6H2O), 2 - Sulfato de ferro II heptahidratado (FeSO4
.7H2O) e 3 -Tartarato de sódio anidro (Na2C4H4O6), com P.F. 53 ° C (Lidén,
2011), P.F > 60 ° C (Roth, 2017) e P.F ˃ 100 ° C (Tyner & Francis, 2018),
respectivamente. Isso se deve ao seu elevado estado de degradação
qualitativamente. Já os seis sais que fundiram estão apresentados na tabela
1. Os três primeiros sais apresentaram variação abaixo de 10 °C e os três
restantes atingiram seus P.F superiores a 10 °C de diferença, quando
comparados à literatura. O Nitrofenol foi o que apresentou maior pureza,
fundindo exatamente como o especificado na referência. O Tiossulfato de
Sódio Pentahidratado apresentou maior quantidade de impureza, pois há uma
diferença de 17 ° C entre o obtido e a referência. A figura 1, apresenta a
comparação dos sais analisados com seus respectivos pontos de fusão e os
valores reportados na literatura. É importante determinar em laboratório
qual é o grau de pureza da substância, pois, para ser usada no processo
industrial, essas impurezas terão que ser eliminadas. No entanto, para
didática acadêmica, os materiais analisados se encontram aptos a serem
utilizados.
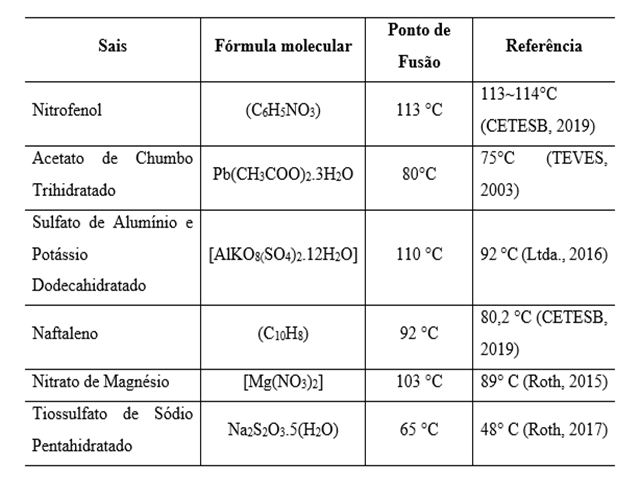
Dados obtidos via a análise e comparação com o referencial teórico.
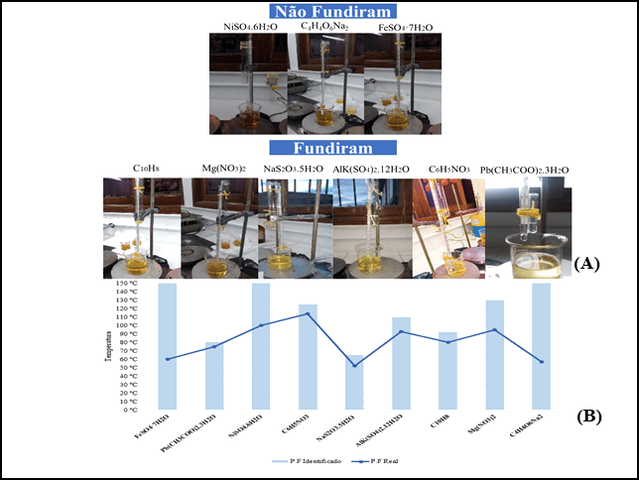
(A) Sistema utilizado para a análise e (B) Gráfico dos dados obtidos comparados com o embasamento bibliográfico.
Conclusões
O teste qualitativo utiliza-se para detectar alterações e contaminações, assim investigar a conformidade do sal. Esta análise é relevante para informar o grau de pureza, mesmo em pequenas quantidades, a presença de impureza na amostra produz considerável aumento no intervalo de fusão. Dos sais analisados, o Sulfato de Níquel, Sulfato de ferro II heptahidratado e o Tartarato de sódio anidro não fundiram. Dos demais, apenas o Nitrofenol pode ser considerado puro, no entanto, conclui-se que para fins didáticos, todos podem ser usados em laboratório, desde que não comprometam as análises.
Agradecimentos
Agradecemos primeiramente a Deus, após ao Centro Universitário Luterano de Manaus (CEULM/ULBRA), pelo incentivo a pesquisa, por nos proporcionar esta oportunidade, cedendo os materiais e reagentes.
Referências
ANIDROL. Ficha de Informação de Segurança de Produtos Químicos – FISPQ (TIOSSULFATO DE SÓDIO PA - 5H2O), 2015.
BIOQUÍMICA E QUÍMICA LTDA. Ficha de Informação de Segurança de Produtos Químicos – FISPQ (SULFATO DE ALUMÍNIO E POTÁSSIO DODECAHIDRATADO), 2016.
BRITTAINC. G. Using Melting Point to Determine Purity of Crystalline Solids – University of Rhode Island, 2009. Disponível em: <http://www.chm.uri.edu/mmcgregor/chm228/use_of_melting_point_apparatus.pdf>. Acesso em: 27 jun. 2019.
BROWN, Theodore; LEMAY, H. Eugene; BURSTEN, E. Bruce. Química: A Ciência Central. 9. ed. Prentice – Hall, 2005.
CETESB. Naftaleno 6-8. Disponível em: <https://sistemasinter.cetesb.sp.gov.br/produtos/ficha_completa1.asp?consulta=NAFTALENO>. Acesso em: 27 jun. 2019.
CETESB. Nitrofenol 1-3. Disponível em: <https://sistemasinter.cetesb.sp.gov.br/produtos/ficha_completa1.asp?consulta=p%20-%20NITROFENOL>. Acesso em: 27 jun. 2019.
CETUS, Indústria e Comercio de Produtos Químicos Ltda. Ficha de Informaçao de Segurança de Produtos Químicos – FISPQ, 2007. (NITRATO DE MAGNÉSIO).
CONSTANTINO, M. G; SILVA, G. V. J; DONATE, P. M. Fundamentos de Química Experimental. Editora da Universidade de São Paulo. São Paulo, 2004.
FESSENDEN, R. J; FESSENDEN, J. S; FEIST, P. Organic Laboratory Techniques, 3. ed. 2000.
KLEPPER, R. R. Melting Point determination: Purity and Identity of Crystalline, 2009.
LENZI, E.; TANAKA, A. S.; VIANNA FILHO, E. De A.; BORTOTTI, L.; GIMENES, M. J. G.; SILVA, M. B. da. Química Geral Experimental. Rio de Janeiro: Freitas Bastos Editora, 2004.
LIDÉN, C. Nickel Sulfate. Management of positive Patch Test Reactions, (Ii) 7 – 9, 2011. Disponível em: <https://doi.org/10.1007/978-3-642-55706-4_2>. Acesso em: 27 jun. 2019.
LTDA, B. e Q. Ficha de Segurança, 2016. Disponivel em: <http://www.quimicabrasileira.com.br/site/wp-ontent/uploads/2018/06/SULFATO-DE-ALUM%C3%8DNIO-E-POT%C3%81SSIO.pdf>. Acesso em: 27 jun. 2019.
ROTH, 2015. Nitrato de Magnesio, p. 1-13. Disponível em: <http://www.carlroth.com/dowloads/sdb/pt/4/SDB_4625_PT_PT.pdf>. Acesso em: 27 jun. 2019.
ROTH, 2017a. Sulfato de ferro. Disponível em: <https://carlroth.com/downloads/sdb/pt/4/SDB_4625_PT_PT.pdf>. Acesso em: 27 jun. 2019.
ROTH, 2017b. Tiossulfato de Sódio Pentahidratado, p. 1-12. Disponível em: <https://carlroth.com/downloads/sdb/pt/T/SDB_T109_PT_PT.pdf>. Acesso em: 27 jun. 2019.
RUSSEL, J. B. Química Geral. 2. ed. São Paulo: Pearson Makron Books, 1994. vol 1.
TEVES, M. L. U. (2003). Acetato de Chumbo. p. 0-2. Disponível em: <https://www.oswaldocruz.br/download/fichas/Acetato%20de%20chumbo2003.pdf>. Acesso em: 27 jun. 2019.
TYNER, T; FRACIS, J. (2018). Sodium tartrate Dihydrate. ACS Reagent Chemicals, 77(58). p. 1-6. Disponível em: <https://doi.org/10.1021/acsreagents.4372.20160601>. Acesso em: 27 jun. 2019.
VETEC. Ficha de Informação de Segurança de Produtos Químicos – FISPQ (ACETATO DE CHUMBO BÁSICO PA - SEG.HORNE), 2015.
VETEC. Ficha de Informação de Segurança de Produtos Químicos – FISPQ (NAFTALENO OS), 2015.









