Síntese e elucidação estrutural do derivado tiossemicarbazônico 2-[(5-bromotiofen-2-il)metileno]-hidrazinocarbiotioamida (Ju-770)
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Pinto, J.C.O. (UFPE) ; Dantas, H.B. (UFPE) ; Gabu, M.A.G. (UFPE) ; Silva, M.A.F. (UFPE) ; Barata, R.R.S. (UFPE) ; Gomes, R.K.M. (UFPE) ; Abreu, N.G.R. (UFPE) ; Albuquerque, J.F.C. (UFPE) ; Ximenes, R.M. (UFPE) ; Albuquerque, J.F.C. (UFPE)
Resumo
A Síntese Orgânica é uma ferramenta de modificação molecular que permite elaborar rotas, encontrando também intermediários biologicamente ativos. Um desses é a classe das tiossemicarbazonas que podem ser utilizadas em reações de fechamento de anel para formação de tiazois, que também possuem atividade. Estas abrangem ações antiprotozoária, anticancerígena, antiviral, antibacteriana, etc. A síntese aconteceu a partir de tiossemicarbazida e 5-Bromotiofeno-2- carbaldeído, catalisada por ácido sob aquecimento e refluxo. O composto sintetizado e purificado foi analisado quanto às suas características físico- químicas (PF, Rf e solubilidades). Sua estrutura foi elucidada pelos métodos físicos convencionais de Ressonância Magnética Nuclear de Hidrogênio e de Carbono Treze, Infra Vermelho.
Palavras chaves
tiossemicarbazona; heterocíclicos; planejamento molecular
Introdução
A Química Farmacêutica faz parte da química e se relaciona com invenção, descoberta, planejamento, identificação e preparação de novos compostos biologicamente ativos. Isto acontece, devido aos estudos de seu metabolismo, com a interpretação do mecanismo de ação e relação estrutura-atividade com alteração de grupos específicos (LIMA, 2007). Tiossemicarbazonas são moléculas bioativas de fácil obtenção, comumente utilizadas como intermediários para produção de compostos heterocíclicos. Estes compostos apresentam uma gama de atividades como antiprotozoária, antitumoral, antiviral, antibacteriana, dentre outras. (Husain et. al., 2007). A ciclização das tiossemicarbazonas permite obtenção de derivados tiazólicos também com potencial atividade farmacológica. A presença de átomos de enxofre e nitrogênio na cadeia é uma característica que reflete em propriedades como complexação com metais (PAULA et. al. 2011). As tiossemicarbazonas são bases de Schiff (azometina) que podem ser obtidas a partir de duas rotas principais: reação quimiosseletiva entre tiossemicarbazidas e aldeídos (ou cetonas); ou preparação de tiossemicarbazida, utilizando hidrazinas, e posterior condensação com compostos carbonilados. Esses compostos formam sistemas com extrema deslocalização eletrônica, principalmente na presença de grupos aromáticos ligados ao carbono da imina, podendo coexistir em equilíbrio tautomérico tiona-tiol (TENÓRIO et al., 2005). É fundamental ressaltar que o processo de síntese da série das tiossemicarbazonas geram compostos de elevado rendimento com tempo de obtenção normalmente curto. Estas moléculas reagem sem necessidade de altas temperaturas. Estes fatos são verificados tanto na literatura como na prática, ressaltando que, às vezes, esta rapidez ocasiona a formação de impurezas.
Material e métodos
A um balão de fundo redondo (50 mL) foram adicionados 0,3480 g (1,832 x 10-3 moles) de 5-Bromotiofeno-2-carbaldeído (AM-41) e 2 mL de isopropanol. A reação foi homogeneizada, por agitação magnética, durante 15 minutos (Chapa aquecedora c/ a. m. IKA, m. C-MAG H57). Concomitantemente, uma solução catalisadora foi preparada com 1 gota de HCl concentrado para 33 mL de isopropanol. A seguir foram retiradas 5 gotas dessa solução e adicionadas à reação. Após esperar 15 minutos para formar o ânion foram acrescentados lentamente, 0,1500 g (1,647 x 10-3 moles) de tiossemicarbazida (AMD-03) parcialmente solubilizados em 2 mL de isopropanol. A reação foi mantida em banho de óleo a 65 ºC durante 30 minutos, em refluxo do solvente. O processo reacional foi acompanhado por cromatografia de camada delgada fase normal, utilizando o sistema cloreto de metileno/metanol 99:1 como fase móvel. O término da reação foi constatado por meio de revelação em luz UV a 254 nm (Cabine Fluorescente Spetroline, m. CM- 10A). A solução foi transferida para um béquer (25 mL) e deixada em repouso para cristalização do produto. Os cristais foram filtrados em funil de Buckner sinterizado, com aplicação de vácuo (Bomba Vácuo Fisatom, m. 826-T) e colocados para secar em estufa a 37 ºC (Estufa J-Prolab, m. B-1). Após três horas, os cristais foram transferidos para um frasco de penicilina onde foram pesados e calculado o rendimento correspondente (Balança analítica BEL, m. Mark 210-A). O procedimento foi repetido também para as águas-mães. Para cada filtrado foram realizadas as análises de ponto de fusão (Fusiômetro microprocessado QUIMIS, m. Q340-M23), Rf, solubilidade a frio e a quente. O derivado tiazolidínico seguiu para a confirmação estrutural pelos espectros de RMN1H, IV, RMN13C e espectroscopia de massas.
Resultado e discussão
O composto 2-[(5-bromotiofen-2-
il)metileno]-hidrazinocarbiotioamida
cristalizou em pó amarelado. A massa de
composto obtida foi 0,0901 g,
apresentando rendimento de 21 %. A análise
do ponto de fusão (PF) resultou
na faixa de fusão de 160 a 161 ºC. O fator
de retenção (Rf) foi 0,53 no
sistema Hexano/Acetato de Etila 6:4. Para
melhor leitura da placa
cromatográfica foi feita repetição com
outro sistema de fase móvel com maior
poder de separação dos componentes,
observando uma mancha na placa, o
segundo fator de retenção ficou em 0,51 no
sistema diclorometano/MeOH
(0.9:0.1). A partir dessas análises
básicas de propriedades físico-químicas,
foi confirmada a pureza da substância, por
apresentar uma mancha isolada em
CCD e o PF menor que 2 ºC. O produto
apresentou solubilidade a frio em
tolueno, THF, clorofórmio, DMSO, dioxano,
cloreto de metileno, etanol, ácido
acético, acetona e água; parcialmente
solúvel em metanol, Tween e acetato de
etila; e, apresentou insolubilidade em n-
hexano, cicloexano e éter etílico.
A elucidação estrutural foi determinada
por RMN1H (300 MHz, ppm), espectros
de IV (v cm-1) e RMN13C (ppm) confirmou
juntamente com a espectroscopia de
massas a estrutura do composto. O
infravermelho (IV) mostrou picos variando
na faixa de 3038-1065 cm-1 para C=S, 1580-
1680 cm-1 para C=N. O RMN1H
apresentou singlete em 8,51 ppm referente
ao Hidrogênio do NH2, 7,3 para NH
e singlete em 7,52 ppm do hidrogênio da
dupla ligação da posição 5. Os
hidrogênios do anel pentagonal
apresentaram como picos em 7,01 e 7.15
ppm. O
RMN13C indicou os carbonos da molécula e
confirmou o peso molecular.
Baseando-se no trabalho de TENÓRIO et al
(2005) essa classe de compostos
comumente apresenta elevado rendimento,
porém não seguiu o padrão.
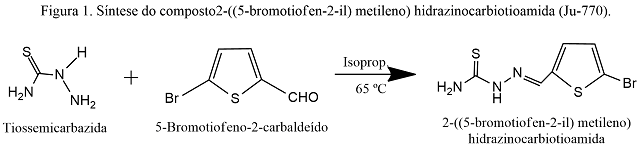
Esquema de síntese do composto 2-((5-bromotiofen- 2-il)metileno)hidrazinocarbiotioamida a partir de tiossemicarbazida e 5-bromotiofeno-2-carbaldeído.
Conclusões
O composto sintetizado foi apresentado puro. O ponto de fusão e os espectros realizados comprovaram pureza do produto. Os dados de Rf também apontaram para um produto puro apesar do baixo rendimento. Também foi determinada a solubilidade do produto não havendo necessidade de recristalização ou método de purificação equivalente. As constantes físicas foram determinadas e o rendimento da reação foi 21 %, sendo considerado baixo, o ideal seria maior que 50 %. Este composto está sendo submetido ao teste microbiológico, principalmente contra Candida albicans que acomete um grande número de pessoas.
Agradecimentos
Ao CNPq pelo financiamento e a Central Analítica do Departamento de Química Fundamental da UFPE pela realização dos espectros.
Referências
BERALDO, Heloisa. Semicarbazonas e tiossemicarbazonas: o amplo perfil farmacológico e usos clínicos. Química Nova, [s.l.], v. 27, n. 3, p.461-471, jun. 2004. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s0100-40422004000300017.
HUSAIN, K.; ABID, M.; AZAM, A. 2007. Synthesis, characterizationandantiamoebicactivityof new indole-3-carboxaldehydethiosemicarbazones andtheirPd (II) complexes. EuropeanJournalof Medicinal Chemistry, v. 42, p. 1300-1308.
LIMA, Lídia M. Química Medicinal Moderna: desafios e contribuição brasileira. Química Nova, [s.l.], v. 30, n. 6, p.1456-1468, dez. 2007. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s0100-40422007000600015.
PAULA. P; DATTA, S.; HALDER, S.; ACHARYYA, R.; BASULI, F.; BUTCHER, R. J.; PENG, S.; LEE, G.; CASTINEIRAS, A.; DREW, M. G. B.; BATTACHARRYA, S. Syntheses, structuresandefficientcatalysis for C–C couplingof some benzaldehydethiosemicarbazone complexes ofpalladium. Journalof Molecular Catalysis A: Chemical; v.344, p.62–73, 2011.
TENÓRIO, R.P.; GOES, A.J.S.; LIMA, J.G.; FARIA, A.R.; ALVES, A.J.; AQUINO, T.M. Tiossemicarbazonas: métodos de obtenção, aplicações sintéticas e importância biológica. Quim. Nova. v. 28, n. 6, p. 1030-1037, 2005.









