Síntese e elucidação estrutural do derivado tiazolidínico 5-(2-bromo-6-fluorobenzilideno)tiazolidina-2,4-diona (Ju-603).
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Pinto, J.C.O. (UFPE) ; Dantas, H.B. (UFPE) ; Gabu, M.A.G. (UFPE) ; Silva, M.A.F. (UFPE) ; Barata, R.R.S. (UFPE) ; Gomes, R.K.M. (UFPE) ; Abreu, N.G.R. (UFPE) ; Ximenes, R.M. (UFPE) ; Albuquerque, J.F.C. (UFPE) ; Albuquerque, J.F.C. (UFPE)
Resumo
Em química medicinal compostos heterocíclicos têm fundamental importância. Dentre esses estão as tiazolidinas que podem sofrer modificações moleculares planejadas a partir do conhecimento de relação estrutura-atividade. Dentre suas ações se encontram: antimicrobiana, antitumoral, antidiabética, etc. Neste trabalho, foi sintetizada uma molécula a partir de tiazolidina-2,4- diona e 2-Bromo-6-Fluor-benzaldeído, ocorrendo formação de um composto 5- arilideno, em solvente polar sob refluxo, com catalisador pirrolidina/etanol. O composto foi analisado quanto a características físico-químicas (PF, Rf e solubilidade), e realizada a elucidação estrutural por RMN1H, RMN13C, IV e espectroscopia de massas. A quantidade de produto obtida validou a metodologia de síntese e permitiu avaliar sua atividade.
Palavras chaves
tiazolidina; biodesign; heterocíclicos
Introdução
Os compostos heterocíclicos têm múltiplos usos na química medicinal por estarem presentes em fármacos, de origem natural ou sintética. Um dos anéis mais comuns é o anel tiazolidínico, que se apresenta com ampla variedade de derivados e ações farmacológicas, como antimicrobiana, antitumoral, antidiabética, etc. (MACCARI et. al., 2005). As tiazolidiona-2,4-dionas derivam do núcleo tiazolidina (anel de 5 membros, sendo enxofre na posição 1 e nitrogênio na posição 3 do anel heterocíclico) contendo ainda duas carbonilas nas posições 2 e 4 do anel heterocíclico. O caminho que melhor explica essas reações é a condensação de Knoevenagel, com perda de água,que acontece ciclização de ácido alfa-haloacético com tioureia, em solventes polares sob refluxo,com presença de base, pois o grupo imino é susceptível à hidrólise ácida (LIESEN et al., 2008). A tizolidina-2,4-diona apresenta alternativas para a introdução de substituintes e formação de derivados e análogos estruturais, nos seus sítios reativos: oxidação (S-1); reações de N-alquilação (N-3); e, condensação com aldeídos e reações com sais de diazônio (C-5) (LIBERMAN et. al., 1998). Lima et. al. (1993) descreveram a formação dos 5-arilidenos como uma modificação de incremento da atividade antimicrobiana. Isto demonstra sua importância para o desenvolvimento de novos fármacos, visto o avanço de resistência a antibióticos beta- lactâmicos. Segundo Gouveia et. al. (2005), a alquilação do carbono 5 pode gerar configuração Z e E na molécula, sendo prevalente a configuração Z por sua maior estabilidade nas reações de condensação. Para essas há ampla utilização de aldeídos, que refletem na atividade quando presentes elementos com efeitos biológicos importantes reconhecidos por estudos de bioisosterismo e de relação estrutura-atividade.
Material e métodos
A um balão de fundo redondo (50 mL) foram adicionados 0,1010 g (8,633 x 10-4 moles) de tiazolidina-2,4-diona (C3H2NO2S) solubilizados em 4 mL de etanol. A reação foi homogeneizada, por agitação magnética, durante 15 minutos (Chapa aquecedora c/ a. m. IKA, m. C-MAG H57). A seguir, foram adicionadas 2 gotas de solução pirrolidina (C4H9N) /Etanol com pipeta de Pasteur, em contato por 10 minutos. Após o tempo decorrido, necessário à formação do ânion, foram adicionados, lentamente, 0,1746 g (8,646 x 10-4 moles) do aldeído dissubstituído, 2-Bromo-6-Fluorobenzaldeído (Ad-2) (C7H4BrFO) (Fig. 1).A reação aconteceu instantaneamente sendo observada pela mudança da cor para amarelo. A reação foi mantida em banho de óleo a 80 ºC, com refluxo do solvente. O processo reacional foi acompanhado por cromatografia de camada delgada fase normal, utilizando o sistema Hexano/AcOEt 5:5 (fm). O término da reação foi constatado por meio de revelação em luz UV a 254 nm (Cabine Fluorescente Spetroline, m. CM-10A). A solução foi transferida para um béquer (25 mL) e deixada em repouso para cristalização do produto. Os cristais foram filtrados em funil de Buckner sinterizado, com aplicação de vácuo (Bomba de Vácuo Fisatom, m. 826-T), e colocados para secar em estufa a 37 ºC (Estufa J-Prolab, m. B-1). Após três horas, os cristais foram transferidos para um frasco de penicilina onde foram pesados e calculado o rendimento correspondente (Balança analítica BEL, m. Mark 210-A). O procedimento foi repetido também para as águas-mães. Para cada filtrado foram realizadas as análises: ponto de fusão (Fusiômetro microprocessado QUIMIS, m. Q340-M23), Rf, solubilidade a frio e a quente. O derivado tiazolidínico seguiu para a confirmação estrutural pelos espectros de RMN1H, IV, RMN13C e espectroscopia de massas.
Resultado e discussão
O composto 5-(2-Bromo-6-Fluorobenzilideno)tiazolidina-2,4-diona cristalizou
em forma de esferoides brancos com aparência de algodão. A massa de composto
obtida foi de 0,1869 g (6,211 x 10-4 moles), apresentando rendimento de 72
%. A análise do ponto de fusão (PF) resultou em faixa de fusão de 165,0 a
165,7 ºC. O fator de retenção (Rf) foi de 0,50 no sistema Hexano/Acetato de
etila 5:5. Para melhor leitura da placa cromatográfica foi idealizado
repetir a cromatografia em outro sistema tendo sido usado desta vez o
sistema de fase móvel com maior poder de separação dos componentes. Deste
modo foi observado apenas uma mancha na placa. O segundo fator de retenção
foi 0,63 no sistema cloreto de metileno / metanol (0,97:0,03). A partir
dessas análises básicas de propriedades físico-químicas foi confirmada a
pureza da substância, por apresentar uma mancha isolada em CCD e PF menor
que 2 ºC. O produto apresentou solubilidade a frio em tolueno, éter etílico,
tetrahidrofurano, ácido acético, acetato de etila, clorofórmio,
dimetilsulfóxido, dioxano, etanol e metanol; tendo sido parcialmente solúvel
em cloreto de metileno; e, insolúvel em n-hexano, cicloexano e também água e
Tween. A elucidação estrutural foi realizada por Ressonância Magnética
Nuclear de Hidrogênio e Carbono Treze. (RMN1H) (300 MHz, ppm). O
Infravermelho (IV) mostrou picos na faixa de 3200, 1728 e 850 cm-1
referentes ao NH das carbonilas e do anel aromáticos. O RMN1H apresentou
singlete em 10,73 ppm referente ao hidrogênio da posição 5 do anel
pentagonal tiazolidínico. Outros sinais em 7,18, 7,28 e 7,40 ppm. Assim,
foram identificados para os hidrogênios aromáticos das posições 3,4 e 5. O
RMN13C indicou todos os carbonos da molécula e o Espectrômetro de massas
(EM) confirmou o peso molecular do produto sintetizado.
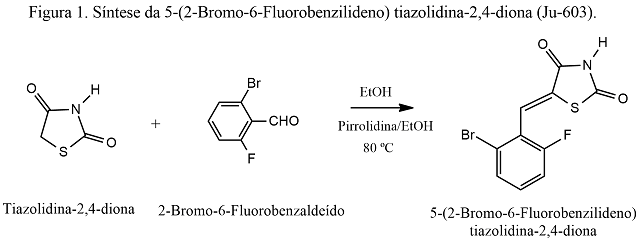
Esquema de síntese do composto 5-(2-Bromo-6- Fluorobenzilideno)tiazolidina-2,4-diona (Ju-603).
Conclusões
A pureza do produto foi confirmada por meio dos testes físico-químicos (PF e Rf), não havendo necessidade de recristalização ou método de purificação equivalente. A solubilidade também foi comprovada. As constantes físicas foram determinadas. O rendimento da reação foi 72 %, sendo considerado muito bom. A estrutura química foi comprovada por métodos físicos de Ressonância Magnética Nuclear (RMN1H e RMN13C), Infravermelho (IV) e massas (EM). Este composto está sendo submetido aos testes microbiológicos com microorganismos de diferentes classes para verificar se apresenta de fato tal atividade.
Agradecimentos
A Central Analítica do Departamento de Química Fundamental da Universidade Federal de Pernambuco pelos espectros realizados.
Referências
GOUVEIA, F. L.; OLIVEIRA, R. M. B.; OLIVEIRA, T. B.; SILVA, I. M.; NASCIMENTO, S. C.; SENA, K. X. F. R.; ALBUQUERQUE, J. F. C. Synthesis, antimicrobialandcytotoxicactivitiesof some 5-arylidene-4-thioxo-thiazolidine-2-ones. EuropeanJournalof Medicinal Chemistry, v 44, p 2038-2043, 2009.
LIBERMAN, D.; HIMBERT, J.; HENGL, L. Bull. Soc. Chim. Fr., p. 1120-1124, 1948. In: LIMA, J.G. Alguns aspectos químicos do anel tiazolidina-2,4-diona. Rev. Uni. Rural, Sér. Ciênc. Exatas e da Terra, v. 18/20, n. 1/2, p. 1-8, 1998.
LIESEN, A. P.; AQUINO, T. M.; GOES, A. J. S.; LIMA, J. G.; FARIA, A. R.; ALVES, A. G. Métodos de obtenção, reatividade e importância biológica de 4-tiazolidinonas. Química Nova, [s.l.], v. 31, n. 2, p.369-376, 2008. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s0100-40422008000200033.
LIMA, J. G. de, GALDINO, S., DA ROCHA PITTA, I., CATANHO, M. D. A., PERRISSIN, M., & LUU-DUC, C. (1993). Relationsquantitativeestructure-activitéhypoglycémiante de quelquesthiazolidine-et imidazolidine-2, 4-diones. InAnnalespharmaceutiquesfrançaises (Vol. 51, No. 6, pp. 283-291). Masson.
MACCARI, R; OTTANÀ, R; CURINGA, C; VIGORITA, M. G.; RAKOWITZ, D.; STEINDL T; LANGERB, T. Structure–activityrelationshipsand molecular modellingof 5-arylidene-2,4-thiazolidinediones active as aldosereductaseinhibitors. Bioorganic& Medicinal Chemistry, v. 13, p. 2809–2823, 2005.









