CONCENTRAÇÃO DE BETALAÍNAS EXTRAÍDAS DE BETERRABA EM ESFERAS DE BIOPOLÍMEROS ATRAVÉS DA ADSORÇÃO CONTINUA EM LEITO FIXO
ISBN 978-85-85905-25-5
Área
Alimentos
Autores
Pinheiro, C.P. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Castro, J.O. (Universidade Federal do Rio Grande) ; Ignácio, G.R. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Moreira, L.M.K. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Cadaval Jr., T.S. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Alves, S.S. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Pinto, L.A.A. (UNIVERSIDADE FEDERAL DO RIO GRANDE)
Resumo
Betalaínas de beterraba apresentam diversos aspectos positivos para saúde humana. A quitosana e o alginato de sódio são biopolímeros provenientes de materiais naturais atóxicos e renováveis. Devidas as suas funcionalidades, podem ser sintetizados na forma de esferas, através do gotejamento em uma solução coagulante apropriada. Isso permite sua aplicação em um leito fixo de adsorção, pois, materiais com pequenos diâmetros ou na forma de pó levam a problemas hidrodinâmicos no leito. Assim, o objetivo deste trabalho foi a concentração de betalaínas de beterraba em esferas de quitosana (pH 7) e alginato de sódio (pH 4) através da adsorção contínua em um leito fixo. O percentual de remoção para altura de 10 cm foi de 52,1% para esferas de alginato de sódio e 49,8% para as esferas de quitosana.
Palavras chaves
alginato de sódio; quitosana; betacianinas
Introdução
O vermelho intenso das beterrabas deriva de altas concentrações de betalaínas, que representam um grupo de fenólicos obtidos de metabólitos secundários de vegetais. As betalaínas são usadas como corantes naturais pela indústria alimentícia, mas também recebem atenção crescente devido a possíveis benefícios para a saúde humana, especialmente suas atividades antioxidantes e anti-inflamatórias (GEORGIEV et al, 2010; ZIELINSKA- PRZYJEMSKA et al, 2009). Outros benefícios incluem a inibição da peroxidação lipídica (REDDY et al, 2005), o aumento da resistência à oxidação de lipoproteínas de baixa densidade (TESORIERE et al, 2003) e os efeitos quimiopreventivos (ZHANG et al, 2013). As betalaínas que são encontradas principalmente na beterraba são divididas em dois grupos, betaxantinas e betacianinas (GANDIA-HERRERO et al, 2010). O primeiro grupo é o produto da condensação do ácido betalâmico com aminoácidos ou aminas. O segundo grupo é o produto da condensação do ácido betalâmico com glicosídeos. Atletas, especialmente aqueles em esportes de resistência, são os principais alvos de vários produtos de beterraba atualmente no mercado. Esses produtos comerciais, tanto sucos como pó, são anunciados como suplementos nutricionais legais para melhorar o desempenho (WRUSS et al, 2015). A quitosana apresenta características interessantes, por exemplo, é um adsorvente eficaz para remoção de corantes. A adsorção utilizando quitosana tem sido reconhecida na literatura quando comparada aos adsorventes convencionais, como carvão ativado. A aplicação de quitosana para adsorção de um adsorbato em leito fixo apresenta dificuldades devido a alguns fatores, como características das partículas, que podem introduzir limitações ao sistema, como queda de pressão hidrodinâmica e obstrução de coluna. Além disso, as partículas de quitosana podem ser solubilizadas ou arrastadas, formando caminhos preferenciais (VIEIRA et al, 2018). Assim, a quitosana na forma de esferas é uma alternativa para melhorar suas estabilidades mecânica e química. O alginato de sódio é um composto químico que forma uma goma quando extraído das paredes celulares de algas marinhas de tonalidade castanha, sendo usado pela indústria de alimentos para aumentar a viscosidade e como emulsificante. Assim como a quitosana, alginato de sódio pode ser sintetizado em um formato esférico (NADAVALA et al, 2009). O princípio básico para síntese de esferas de quitosana consiste em dissolver quitosana geralmente em ácido acético, e gotejar em uma solução de NaOH, como foi demonstrado por THAKHIEW et al (2010). O princípio é semelhante para alginato de sódio, porém, este é dissolvido em água e gotejado em uma solução de CaCl2. CHIOU e LI (2002), ao estudarem esferas de quitosana puras, demonstraram que não foi possível medir a capacidade de adsorção para pH menor que 5,5, pois, elas formaram gel para essa região. Porém, as esferas de alginato de sódio são estáveis em pH ácido, no entanto, dissolvem em meio alcalino (KIMURA et al, 1996). Neste contexto, o processo de adsorção utilizando biopolímeros pode configurar uma forma de preservar as propriedades das betalaínas. Assim, o objetivo desse trabalho foi o estudo da adsorção contínua em um leito fixo de betalaínas extraídas de beterrabas utilizando esferas de quitosana e alginato de sódio.
Material e métodos
A quitina foi obtida de resíduos de camarão (Penaeus brasiliensis) segundo WESKA et al (2007), e sua purificação foi realizada segundo DOTTO et al (2011). A quitosana foi caracterizada quanto a massa molar segundo WESKA et al (2007), e grau de desacetilação por titulação potenciométrica (TOLAIMATE et al, 2000). As esferas de quitosana foram preparados através da dissolução de 2 g de quitosana em 50 ml ácido acético (1% v/v). Esta solução foi mantida sob agitação (400 rpm) por 2 h em temperatura ambiente. Posteriormente, foi gotejada em uma solução de NaOH (1M) através de uma bureta (50 ml) posicionada a 1,5 cm da superfície da solução. As esferas foram mantidas na solução de NaOH até decantarem. Posteriormente, foram filtradas e lavadas com água destilada até pH neutro. As esferas de alginato de sódio (Exodo Científica) foram preparadas pela dissolução de 2 g de alginato de sódio em 50 mL de água destilada, sob agitação de 600 rpm por 2 h à temperatura ambiente (25±2 °C). Posteriormente, foram gotejadas em uma solução coagulante de CaCl2 (10%, m/v). Estas esferas permaneceram na solução por 4 h. Após foram filtradas e lavadas com 0,85% NaCl (m/v). As esferas foram caracterizadas quanto a umidade e diâmetro médio (Dmédio) por paquimetria. As beterrabas foram obtidas no comércio local de Rio Grande-RS. Os caules e a raizes foram retirados e, posteriormente, foram lavadas. Então, foram fracionadas em partículas de 5 cm de comprimento, 0,5 cm de espessura e 0,08 cm de altura, e o conteúdo de umidade da amostra foi determinado. A condição de extração foi usando água destilada como solvente, à 328 K e a relação solvente:sólido de 15:1 (v/m). A concentração de betalaínas foi calculada pela soma das concentrações de betacianinas e betaxantinas, através do método espectrofotômetro. As absorções de betacianinas e betaxantinas foram medidas em 536 nm e em 485 nm, respectivamente, e as concentrações foram calculadas usando a equação proposta por WRUSS et al (2015). A adsorção foi realizada em um leito fixo, constituído por uma coluna acrílica, com 3,4 cm de diâmetro interno e 30 cm de altura, acoplada a uma bomba peristáltica (Master Flex, 07553–75, Canadá). Foram utilizados 5 e 10 cm de esferas de biomateriais, e o restante da coluna foi preenchido por esferas de vidro. A solução de betalaínas (150 mg/L) foi bombeada em fluxo ascendente com 5 mL min-1, temperatura ambiente (25 ± 2 °C). Foi utilizado pH 7 para esferas de quitosana e pH 4 para esferas de alginato de sódio. A concentração na saída foi determinada pelo método espectrofotômetro. Os tempos de ruptura (tb) e de exaustão (te) estão associados a concentração na saída da coluna quando esta atingir 5% e 95% da concentração inicial de betalaínas, respectivamente. A quantidade total de betalaínas adsorvidas, mad (mg), capacidade de adsorção da coluna, qeq (mg/g), massa total alimentada (mtotal) e o percentual de remoção (%R) de betalaínas foram calculados segundo PINHEIRO et al (2019).
Resultado e discussão
A beterraba apresentou uma umidade de 86,8±0,4% (m/m), base úmida), a
concentração de betalaínas extraídas foi de 151,1 ± 2,2 mg L-1. Portanto, a
beterraba apresentou uma concentração de betalaínas de 9,62 g kg-1 (base
seca). A proporção de betacianinas e betaxantinas foi de 1,43 ± 0.07,
próximo de dados apresentados na literatura (WRUSS et al, 2015).
Considerando a diferença de solventes empregados pode-se indicar que a
composição de betalaínas é similar na beterraba, apesar de sua variedade. A
quitosana apresentou um grau de desacetilação de 85,2 ± 0,9% e massa molar
de 145,0 ± 4,7 (kDa). O grau de desacetilação está associado ao número de
grupos amino livres, que em meio ácido podem ser protonados (PINHEIRO et al,
2019).
A umidade e o diâmetro médio dos adsorventes foram de 89,0 ± 2,0% (m/m,
b.u.) e 3,247 ± 0,083 mm para as esferas de quitosana, e 92,0 ± 1,8% (m/m,
b.u.) e 2,921 ± 0,073 mm para as esferas de alginato de sódio. As esferas de
quitosana foram sintetizadas devido ao fato que a quitosana em meio alcalino
é insolúvel, e em meio ácido a quitosana cria uma característica catiônica,
devido aos grupos aminos livres que podem ser protonados, levando a
dissolução da quitosana devido à repulsão eletrostática. O alginato de
sódio, por sua vez, é solúvel em meio alcalino, devido aos grupos
carboxílicos presentes. O aumento do pH leva a dissociação dos grupos
carboxílicos dos íons de sódio, assim, permitindo a interação com o meio
aquoso.
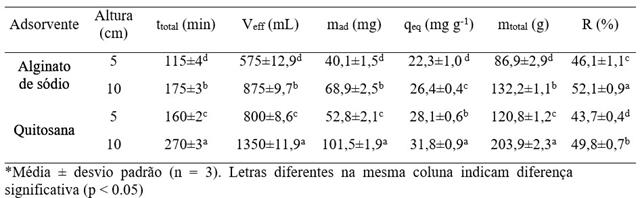
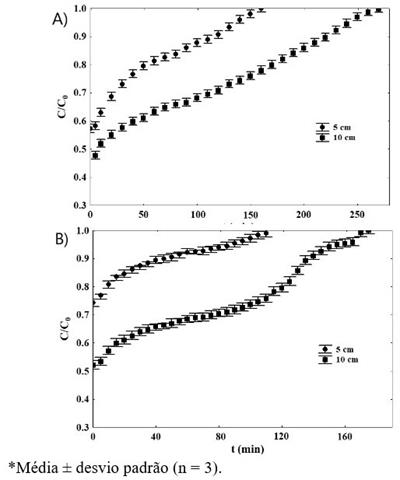
Em relação à adsorção em um leito fixo, o aumento na quantidade de esferas
de alginato de sódio acarretou um aumento significativo na capacidade de
adsorção (Tabela 1). Porém, o aumento na capacidade de adsorção foi pequeno,
isso pode ter ocorrido pelo fato que a redução na concentração da solução
leva a redução da capacidade de adsorção, que pode ser observado pelas
isotermas de adsorção (dados obtidos em estudos preliminares). Como pode se
observar na Figura 1, quando a relação C/C0 atingiu 0,9 para altura de 5 cm,
se observou uma leve inclinação na curva da altura de 10 cm, isso ocorreu
devido a saturação da parte inicial da coluna.
Na Figura 1 pode-se observar que não houve tempo de ruptura para as esferas
de alginato de sódio e de quitosana, então seria necessário aumentar a massa
de adsorvente ou diminuir a concentração do adsorbato. A capacidade de
adsorção da quitosana foi significativamente maior para as alturas 5 e 10 cm
em relação às esferas de alginato de sódio. Isso ocorreu devido aos grupos
funcionais da quitosana, além da betanina (principal pigmento das
betalaínas) que em meio ácido apresenta duas estruturas protonadas em
ressonância, devido à presença de dois átomos de nitrogênio, no grupo
glicosídeo e outro no ácido betalâmico. Assim existe uma competição de íons
pelos grupos carboxílicos do alginato de sódio. A betanina entre pH 3,5 e 7
apresenta uma estrutura de diânion, com a desprotonação dos três grupos
carboxílicos, esses grupos podem sofrer repulsão eletrostática pelos grupos
carboxílicos presentes no alginato de sódio. Entre pH 7 e 9,5 ocorrem a
formação de um triânion, com a desprotonação dos três grupos carboxílicos e
o grupo -OH do anel fenólico (ŚWIGLO, SZYMUSIAK e MALINOWSKA 2006). Em pH
elevado, a interação entre quitosana e betanina pode ocorrer pela formação
de amidas, devido à presença dos grupos amino da quitosana e o ácido
carboxílico presente na betanina.
Em relação à porcentagem de remoção, as esferas de alginato apresentaram uma
porcentagem maior que as esferas de quitosana. Enquanto a beterraba
apresentou uma concentração de 9,62 (g/kg) (b. s.) para as betalaínas, esta
foi muito menor que as capacidades de adsorção obtidas. Isso demonstra a
alta concentração de betalaínas nas esferas de biopolímeros, e como estes
são comestíveis, ambos se tornam viáveis para consumo humano.
Conclusões
Foi possível sintetizar as esferas de quitosana e de alginato de sódio. Os adsorventes não demonstraram nenhuma alteração visual dentro do leito fixo de adsorção para as alturas de 5 e 10 cm. Ambos adsorventes foram capazes de adsorver betalaínas em um leito fixo de adsorção, e apresentaram altas concentrações de betalaínas em relação à concentração de betalaínas nas beterrabas. As capacidades de adsorção para esferas de alginato de sódio para as alturas de 5 e 10 cm foram 22,3 e 26,4 (mg/g), e as porcentagens de remoção foram de 46,1% e 52,1%, respectivamente. A maior capacidade de adsorção foi de 31,8 mg g-1 para as esferas de quitosana (10 cm). Assim, adsorção em um leito fixo se mostra viável para a concentração de betalaínas usando esferas de quitosana e alginato de sódio.
Agradecimentos
Referências
CHIOU, M. S.; LI, H. Y. Equilibrium and Kinetic Modeling of Adsorption of Reactive Dye on Cross-Linked Chitosan Beads. Journal of Hazardous Materials B, n°. 93 p. 233–248, 2002.
DOTTO, G. L.; SOUZA, V. C.; MOURA, J. M.; MOURA, C. M.; PINTO, L. A. A. Influence of Drying Techniques on The Characteristics of Chitosan and the Quality of Biopolymer Films. Drying Technology, n° 29, 1784–1791, 2011.
GANDIA-HERRERO, F.; ESCRIBANO, J.; GARCIA-CARMONA, F. Structural Implications on Color, Fluorescence, and Antiradical Activity in Betalains. Planta, n°232 (2), 449–460, 2010.
GEORGIEV, V. G.; WEBER, J.; KNESCHKE, E. M.; DENEV, P. N.; BLEY, T.; PAVLOV, A. I. Antioxidant Activity and Phenolic Content of Betalain Extracts from Intact Plants and Hairy Root Cultures of the Red Beetroot Beta Vulgaris CV. Plant Foods for Human Nutrition, n° 65, 105–111, 2010.
GLISZCZYŃSKA-ŚWIGLO, A.; SZYMUSIAK, H.; MALINOWSKA, P. Betanin, The Main Pigment of Red Beet - Molecular Origin of Its Exceptionally High Free Radical Scavenging Activity. Food Additives & Contaminants, n° 23, 1079-1087, 2006.
KIMURA, Y.; WATANABE, K.; OKUDA, H. Effects of Soluble Sodium Alginate on Cholesterol Excretion and Glucose Tolerance in Rats. Journal of Ethnopharmacology n° 54, 47-54, 1996.
NADAVALA, S. K.; SWAYAMPAKULA, K.; BODDU, V. M.; ABBURi, K. Biosorption of Phenol And O-Chlorophenol From Aqueous Solutions on to Chitosan–Calcium Alginate Blended Beads. Journal of Hazardous Materials, n° 162, 482-489, 2009.
PINHEIRO, C. P.; MELLO, T. G.; VIEIRA, M. L. G.; PINTO, L. A. A. Chitosan-Coated Different Particles in Spouted Bed and their use in Dye Continuous Adsorption System. Environmental Science and Pollution Research, n° press, 1-14, 2019.
REDDY, M. K.; ALEXANDER-LINDO, R. L.; NAIR, M. G. Relative Inhibition of Lipid Peroxidation, Cyclooxygenase Enzymes, and Human Tumor Cell Proliferation by Natural Food Colors. Journal of Agricultural and Food Chemistry, n°53, 9268– 9273, 2005.
TESORIERE, L.; BUTERA, D.; D’ARPA, D.; GAUDIO, F.; ALLEGRA, M.; GENTILE, C.; LIVREA, M. A. Increased Resistance to Oxidation of Betalain-Enriched Human Low-Density Lipoproteins. Free Radical Research n° 37, 689–696, 2003.
THAKHIEW, W.; DEVAHASTIN, S.; SOPONRONNARIT, S. Effects of Drying Methods and Plasticizer Concentration on Some Physical and Mechanical Properties of Edible Chitosan Films. Journal of Food Engineering, n° 99, 216–224, 2010.
TOLAIMATE, A.; DESBRIÈRES, J.; RHAZI, M.; ALAGUI, A.; VINCENDON, M.; VOTTERO, P. On the Influence of Deacetylation Process on the Physicochemical Characteristics of Chitosan from Squid Chitin. Polymer, n° 41, 256–269, 2000.
VIEIRA, M. L. G.; MARTINEZ, M. S.; SANTOS, G. B.; DOTTO G. L.; PINTO, L. A. A. Azo Dyes Adsorption in Fixed Bed Column Packed with Different Deacetylation Degrees Chitosan Coated Glass Beads. Journal of Environmental Chemical Engineering, n° 6, 3233-3241, 2018.
WESKA, R. F.; MOURA, J. M.; BATISTA, L. M.; RIZZI, J.; PINTO L. A. A. Optimization of Deacetylation in the Production of Chitosan from Shrimp Wastes: Use of Response Surface Methodology. Journal of Food Engineering, n° 80, 749-753, 2007.
WRUSS, J.; WALDENBERGER, G.; HUEMER, S.; UYGUN, P.; LANZERSTORFER, P.; MULLER, U.; HOGLINGER, O.; WEGHUBER J. Compositional Characteristics of Commercial Beetroot Products and Beetroot Juice Prepared from Seven Beetroot Varieties Grown in Upper Austria. Journal of Food Composition and Analysis, n° 42, 46–55, 2015.
ZHANG, Q.; PAN, J.; WANG, Y.; LUBET, R.; YOU, M. Beetroot Red (Betanin) Inhibits Vinyl Carbamate and Benzo(A)Pyrene Induced Lung Tumorigenesis Through Apoptosis. Molecular Carcinogenesis n° 52, 686–691, 2013.
ZIELINSKA-PRZYJEMSKA, M.; OLEJNIK, A.; DOBROWOLSKA-ZACHWIEJA, A.; GRAJEK, W. In Vitro Effects of Beetroot Juice and Chips on Oxidative Metabolism and Apoptosis In Neutrophils From Obese Individuals. Phytotherapy Research, n° 23, 49–55, 2009.









