CONCENTRAÇÃO DE ANTOCIANINAS DE BAGAÇO DE UVA EM ESFERAS DE BIOPOLÍMEROS UTILIZANDO ADSORÇÃO CONTINUA EM LEITO FIXO
ISBN 978-85-85905-25-5
Área
Alimentos
Autores
Pinheiro, C.P. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Castro, J.O. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Ignácio, G.R. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Moreira, L.M.K. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Alves, S.S. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Vieira, M.L.G. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Cadaval Jr., T.S. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Pinto, L.A.A. (UNIVERSIDADE FEDERAL DO RIO GRANDE)
Resumo
As antocianinas apresentam inúmeras funcionalidades e associação com benefícios positivos à saúde. No entanto, dependendo das condições de processo as antocianinas podem ser degradadas. Uma maneira de preservar antocianinas é através da concentração delas em biopolímeros. Assim, antocianinas foram adsorvidas em um leito fixo usando esferas de quitosana e de alginato de sódio como adsorventes. As esferas foram sintetizadas através do gotejamento em uma solução coagulante apropriada. Os bioadsorventes apresentaram uma alta concentração de antocianinas em relação à concentração original nas cascas de uva. As capacidades de adsorção foram de 51,4 e 60,8 mg/g para esferas de alginato de sódio e quitosana, respectivamente, para altura de 10 cm.
Palavras chaves
quitosana; alginato de sódio; Pinot Noir
Introdução
As antocianinas apresentam diversos fatores positivos para saúde humana. São encontradas naturalmente em produtos como uva, berinjela, repolho roxo, açaí entre outros. Porém, não são produtos que fazem parte da rotina de inúmeros brasileiros. Além disso, muitas das espécies de uvas concentra as antocianinas em suas cascas, por isso, bagaço de uvas gerados por vinícolas se tornam fontes ricas de antocianinas, a Pinot Noir é um exemplo, além disso, apresenta apenas 5 estruturas de antocianinas e nenhuma estrutura acilada (DIMITROVSKA et al, 2011). As antocianinas podem ser utilizadas como substitutos de corantes artificiais, principalmente devido à variação de cor conforme o pH do meio, assim podem ser aplicados em diferentes produtos quando sua cor for pertinente (OVANDO et al, 2009). Para incorporação de antocianina em um produto, é necessário disponibilizar antocianinas em condições de processamento e armazenamento adequados. A extração das antocianinas de alguma fonte pode ser realizada por diversos métodos, porem alguns métodos são economicamente inviáveis ou podem degradar as antocianinas. Porém, após a extração das antocianinas de alguma fonte, pode- se realizar sua fixação em um adsorvente que mantenha sua funcionalidade, sejam comestíveis e capazes de serem estocados por longos períodos. Assim, adsorção se demonstra interessante por utilizar condições brandas que não degradam a antocianina (CARVALHO et al, 2019). A aplicação da quitosana como adsorvente vem largamente sendo estudada devido à sua característica catiônica apresentada, entre outras funcionalidades. Devidas as inúmeras formas que a quitosana pode ser produzida, como filmes, géis, pó, esferas e entre outras. Ela pode ser empregada tanto na adsorção descontínua como contínua. Porém, antocianinas em meio ácido forma o cátion flavilium (KHOO et al, 2017), enquanto a quitosana tem seus grupos amino livres protonados. Assim ocorre a repulsão entre quitosana e antocianinas. No entanto, alginato de sódio não é solúvel em meio ácido e pode atuar como adsorvente para antocianinas. Alginato de sódio é um composto químico, ele forma uma goma quando extraído das paredes celulares de algas marinhas de coloração castanha, é usado pela indústria de alimentos para aumentar a viscosidade e como emulsificante. Assim como a quitosana, alginato de sódio pode ser sintetizado em uma forma esférica (NADAVALA et al, 2009). O princípio básico para síntese de esferas de quitosana consiste em sua dissolução, geralmente em ácido acético, e gotejar em uma solução de NaOH, como foi demonstrado por THAKHIEW et al (2010). O princípio é semelhante para alginato de sódio, porém, alginato de sódio é dissolvido em água e gotejado em uma solução de CaCl2. Adsorção contínua em coluna apresenta vantagem devida ao grande volume que pode ser processado. Independente do fato da quitosana apresentar alta capacidade de adsorção para inúmeros corantes, seu emprego na coluna de leito fixo é restrito a suas características físicas. Assim, adsorventes na forma de esferas reduzem os problemas hidrodinâmicos que na forma de pó podem causar (VIEIRA et al, 2018). Neste contexto, o processo de adsorção utilizando biopolímeros pode configurar uma forma de preservar as propriedades das antocianinas. Assim, o objetivo desse trabalho foi o estudo da adsorção contínua em um leito fixo de antocianinas extraídas de cascas de uvas de Pinot Noir, utilizando esferas de quitosana e alginato de sódio.
Material e métodos
A quitosana foi obtida de resíduos de camarão (Penaeus brasiliensis), primeiramente foi obtido a quitina (WESKA et al, 2007), seguido da desacetilação da quitina (DOTTO; SOUZA; PINTO, 2011). A quitosana foi caracterizada quanto a umidade (nº 950.46), cinzas (nº 920.153) conforme as normas da A.O.A.C. (1995), massa molar através do método viscosimétrico (WESKA et al, 2007) e grau de desacetilação através de titulação potenciométrica (TOLAIMATE et al, 2000). As sementes e outras impurezas foram separadas das cascas de uva de Pinot Noir manualmente. O bagaço de uva foi caracterizado em relação ao conteúdo de umidade através do método gravimétrico. A extração de antocianinas foi realizada utilizando água destilada, temperatura de 50 °C, 120 min, utilizando uma relação de massa e solvente de 1:10 (m/v). Após a extração, o extrato foi filtrado e centrifugado (5000 × g). A quantificação da concentração de antocianinas foi realizada segundo CARVALHO et al (2019). As esferas de quitosana foram preparados através da dissolução de 2 g de quitosana em 50 ml ácido acético (1% v/v). Esta solução foi mantida sob agitação (400 rpm) por 2 h em temperatura ambiente. Posteriormente, foi gotejada em uma solução de NaOH (1M) através de uma bureta (50 ml) posicionada a 1,5 cm da superfície da solução de NaOH. As esferas foram mantidas na solução de NaOH até decantarem. Posteriormente foram filtradas e lavadas com água destilada até pH neutro. Esferas de alginato de sódio (Exodo Científica) foram preparadas pela dissolução de 2 g de alginato de sódio em 50 mL de água destilada, sob agitação de 600 rpm por 2 h à temperatura ambiente (25±2 °C). Após, foram gotejadas em uma solução coagulante de CaCl2 (10%, m/v). Estas esferas permaneceram na solução por 4 h. Posteriormente foram filtradas e lavadas com 0,85% NaCl (m/v). As esferas foram caracterizadas quanto a umidade e diâmetro médio (Dmédio) por paquimetria. As esferas foram utilizadas como adsorvente de antocianinas em uma coluna de leito fixo com 3,4 cm de diâmetro interno e 30 cm de altura, acoplada a uma bomba peristáltica (Master Flex, 07553–75, Canadá). Foram utilizadas lturas de 5 cm e 10 cm de adsorvente, e o restante da coluna foi empacotada com esferas de vidro. As soluções de antocianinas foram bombeadas em fluxo ascendente com vazão de 5 (mL/min), temperatura ambiente (25 ± 2 °C), concentração de 230 (mg/L), usando pH 7 para esferas de quitosana e pH 4 para esferas de alginato de sódio. Amostras foram retiradas no topo da coluna, sendo a concentração das antocianinas determinada segundo CARVALHO et al (2019). Os tempos de ruptura (tb) e de exaustão (te) são de 5% e 95% da concentração inicial de antocianinas, respectivamente. A quantidade total, mad (mg), capacidade de adsorção da coluna, qeq (mg/g), massa total alimentada (mtotal) e o percentual de remoção (%R) de antocianinas foi calculado segundo PINHEIRO et al (2019).
Resultado e discussão
As cascas de uva apresentaram uma umidade de 83,5 ± 0,8% (base úmda, m/m), o
teor de antocianinas extraídas foi de 231.5 ± 1,8 (mg/L). As antocianinas se
acumulam principalmente na casca da uva, apenas as variedades conhecidas
como tintoreras contém antocianina na sua polpa. Fatores genéticos foram
determinantes para cada espécie apresentar um específico padrão de
antocianinas. Assim o conteúdo relativo das antocianinas presentes na Pinot
Noir é independente das condições ambientais. Pinot Noir apresenta apenas 5
estruturas de antocianinas e nenhuma é acilada (LEE e SKINKIS, 2013). O grau
de desacetilação e massa molar da quitosana foram de 85,7 ± 0,7% e 144,9 ±
3,9 (kDa), respectivamente. O grau de desacetilação está associado ao número
de grupos amino livres, que em meio ácido podem ser protonados, assim,
gerando uma característica catiônica para quitosana em meio ácido (PINHEIRO
et al, 2019).
As esferas de quitosana e alginato de sódio apresentaram uma umidade de 89,0
± 1,2% (base úmida) e 92,0±1,4% (base úmida). respectivamente, e diâmetro
médio de e 3,197 ± 0.078 mm e e 2,881 ± 0.081 mm, respectivamente. A
sintetize dos adsorventes na forma de esferas foi possível, devido ao fato
que quitosana em meio alcalino é insolúvel, e apenas solúvel em meio ácido
devido a protonação de seus grupos aminos livres. O alginato de sódio
apresentou um comportamento oposto, solúvel em meio alcalino, devido aos
grupos carboxílicos presentes. Em meio ácido, seus grupos carboxílicos podem
interagir com os íons do meio, assumindo uma forma neutra. A antocianina em
meio ácido apresenta características catiônicas, devido ao cátion flavílio
que é protonado. As repulsões de quitosana e antocianinas em meio ácido
foram demonstradas por GAO et al (2014) ao variar o grau de desacetilação da
quitosana.
A maior capacidade de adsorção foi de 60 mg g-1 para as esferas de quitosana
com altura de 10 cm (Tabela 1), esse valor foi superior às esferas de
alginato de sódio, pois, em meio ácido o cátion flavilium disputa com os
outros íons do meio pelos grupos de alginato de sódio. Enquanto, os grupos
aminos da quitosana estão disponíveis para interagirem com as antocianinas
em meio alcalino. ÁVILA et. al. (2019) realizaram adsorção de antocianinas
de repolho roxo utilizando esferas de vidro recobertas com solução de
quitosana como adsorvente. A capacidade de adsorção foi de 85 (mg/g) para pH
11, em meio descontínuo. CARVALHO et al (2019) utilizando filmes de
quitosana para adsorver antocianinas extraída de repolho roxo, em um meio
descotínuo, obtiveram uma capacidade de adsorção de 140 (mg/g) para pH 5,5.
Isso demonstra que a capacidade de adsorção para ambas esferas em um leito
fixo é viável para ambos adsorventes. Além disso, as esferas de quitosana
apresentaram um percentual de remoção maior que 50% para ambas alturas
utilizadas. Obtendo assim uma alta concentração de antocianinas.
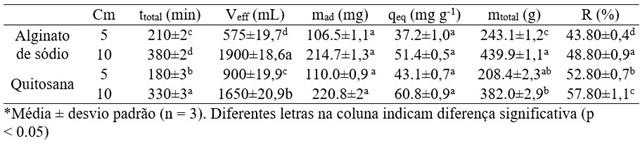
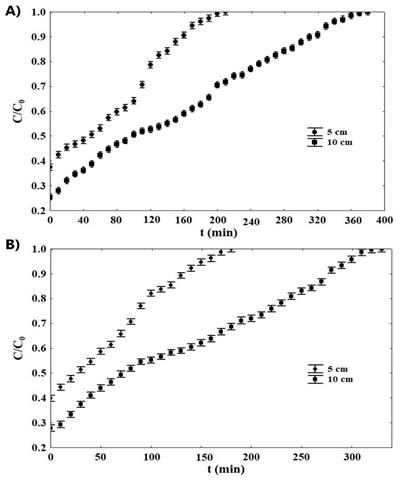
Como pode se observar na Figura 1, não ocorreu tempo de ruptura, então seria
necessário aumentar a quantidade de adsorvente ou diminuir a concentração da
solução de antocianina para se obter um tempo de ruptura. Na adsorção
contínua em um leito fixo é desejável se obter altos tempos de ruptura junto
com curvas com altas inclinações, mas esse tipo de comportamento geralmente
é obtido apenas para materiais ideais.
Conclusões
As sínteses de esferas de quitosana e de alginato de sódio foram possíveis para diferentes pH. As esferas atuaram como adsorvente para alturas de 5 e 10 cm num leito fixo sem demonstrar nenhuma alteração visível, apenas alteração na cor após a adsorção. Ambas as esferas foram capazes de adsorver antocianinas obtidas de cascas de uva de Pinot Noir em um leito fixo, e apresentaram altas concentrações de antocianinas em relação à concentração original nas cascas de uva. As capacidades de adsorção foram de 51,4 e 60,8 (mg/g) para esferas de alginato de sódio e de quitosana, respectivamente, para altura de 10 cm. Assim, adsorção em um leito fixo se mostra viável para a concentração de antocianinas usando esferas de quitosana e alginato de sódio
Agradecimentos
Referências
Association of Official Analytical Chuimists, A.O.A.C. Oficial Methods of Analysis, ed.14, v. 1, Washington D.S.1995.
ÁVILA, M. F.; BUENO, P. D. F.; PINTO, L. A. A.; LOPES, T. J.; FELIPE, C. A. S. Parametrization of particle coating process with chitosan in spouted bed. Particulate Science and Technology, v. press, p. 1-9, 2019.
CARVALHO, V. V. L.; GONÇALVES, J. O.; SILVA, A.; CADAVAL, T. R.; PINTO, L. A. A.; LOPES, T. J. Separation of anthocyanins extracted from red cabbage by adsorption onto chitosan films. International Journal of Biological Macromolecules, v, 131, p. 905-911, 2019.
DIMITROVSKA, M.; BOCEVSKA, M.; DIMITROVSKI, D.; MURKOVIC, M. Anthocyanin composition of Vranec, Cabernet Sauvignon, Merlot and Pinot Noir grapes as indicator of their varietal differentiation. European Food Research and Technology, v. 232, p. 591–600, 2011.
DOTTO, G.L.; SOUZA, V.C.; PINTO, L.A.A. Drying of chitosan in a spouted bed: The influences of temperature and equipment geometry in powder quality. LWT - Food Science and Technology, v. 44, p. 1786-1792, 2011.
GAO, R.; JING, P.; RUAN. S.; ZHANG, Y.; ZHAO, S.; CAI, Z.; QIAN, B. Removal of off-flavours from radish (Raphanus sativus L.) anthocyanin-rich pigments using chitosan and its mechanism(s). Food Chemistry, v. 146, p. 423–428, 2014.
KHOO, H. E.; AZLAN, A.; TANG, S. T.; LIM, S. M. Anthocyanidins and anthocyanins: colored pigments as food, pharmaceutical ingredients, and the potential health benefits. Food e Nutrition Research, v. l61, p. 1-22, 2017.
LEE, J.; SKINKIS, P. A. Oregon ‘Pinot noir’ grape anthocyanin enhancement by early leaf removal. Food Chemistry , v. 139, p. 893-901, 2013.
NADAVALA, S. K.; SWAYAMPAKULAA, K.; BODDUB, V. M.; ABBURI, K. Biosorption of phenol and o-chlorophenol from aqueous solutions on to chitosan–calcium alginate blended beads. Journal of Hazardous Materials, v. 162, p. 482–489, 2009.
OVANDO, A. C.; HERNANDEZ, E. P.; RODRIGUEZ, J. A.; VIDAL, C. A. G. Chemical studies of anthocyanins: A review. Food Chemistry, v. 113, p. 859–871, 2009.
PINHEIRO, C. P.; MELLO, T. G.; Vieira, M. L. G.; PINTO, L. A. A. Chitosan-coated different particles in spouted bed and their use in dye continuous adsorption system. Environmental Science and Pollution Research, v. press, p. 1-14, 2019.
THAKHIEW, W.; DEVAHASTIN, S.; SOPONRONNARIT, S. Effects of drying methods and plasticizer concentration on some physical and mechanical properties of edible chitosan films. Journal of Food Engineering, v. 99, p. 216–224, 2010.
TOLAIMATE, A.; DESBRIÈRES, J.; RHAZI, M.; ALAGUI, A.; VINCENDON, M.; VOTTERO, P. On the influence of deacetylation process on the physicochemical characteristics of chitosan from squid chitin. Polymer, v. 41, p. 256–269, 2000.
VIEIRA, M. L. G.; PINHEIRO, C. P.; SILVA, K. A.; LUTKE, S. F.; CADAVAL, T. R. S.; DOTTO, G.; PINTO, L. A. A. Chitosan and cyanoguanidine-crosslinked chitosan coated glass beads and its application in fixed bed adsorption. Chemical Engineering Communications, v. press, p. 1-13, 2019.
WESKA, R. F.; MOURA, J. M.; BATISTA, L. M.; RIZZI, J.; PINTO L. A. A. Optimization of deacetylation in the production of chitosan from shrimp wastes: Use of response surface methodology. Journal of Food Engineering, v. 80, p. 749-753, 2007.









