Utilização de sistema aquoso bifásico para recuperação de proteínas de [i]Spirulina platensis[/i]
ISBN 978-85-85905-25-5
Área
Alimentos
Autores
Menegotto, A.L.L. (URI - ERECHIM) ; Ostrowski, G.M. (URI - ERECHIM) ; Balestieri, B.P. (URI - ERECHIM) ; Franco, A. (URI - ERECHIM) ; Valduga, E. (URI - ERECHIM) ; Steffens, J. (URI - ERECHIM)
Resumo
Os sistemas aquosos bifásicos (SABs) vêm se destacando como técnica alternativa para purificar proteínas. Contudo, ainda é pouco estudado para recuperar proteínas da S. platensis. O objetivo deste trabalho foi aplicar planejamentos fatoriais completos visando a otimização da purificação de proteínas de S. platensis através de SAB composto por polietileno glicol (PEG) e citrato de sódio. Diferentes massas molares de PEG (1500, 4000, 6000 e 8000 Da) foram estudadas, obtendo-se fatores de purificação entre 0,92 a 1,38. A máxima recuperação de proteínas foi de 74,96% e fator de purificação de 1,38, utilizando 20% de citrato de sódio e 28% de PEG de 1500 Da.
Palavras chaves
Polietileno glicol (PEG); citrato de sódio; purificação de proteínas
Introdução
O sistema aquoso bifásico (SAB) envolve o isolamento do composto de interesse a partir da concentração do mesmo em uma de suas fases (LEONG et al., 2015), sendo uma técnica que envolve simplicidade operacional, rápida separação, baixa desnaturação e com potencial de aumento de escala (RAJA et al., 2011). Estes sistemas ocorrem principalmente pela mistura de dois polímeros, de um polímero e um sal ou de um solvente orgânico e um sal (AMID; ABDUL MANAP; MUSTAFA, 2013; PHONG et al., 2017). Desta forma, torna- se uma alternativa a recuperação de proteínas. A eficiência da partição de biomoléculas aplicando esta técnica se deve, principalmente, pela possibilidade em alcançar as melhores condições, sendo possível manipular seus parâmetros, tais como: concentração dos seus componentes, pH, temperatura, entre outros (RAJA et al., 2011; FU et al., 2015). A obtenção do composto de interesse ocorre de forma complexa, envolvendo interações hidrofóbicas e ligações de hidrogênio entre a molécula alvo e os componentes das fases (MARCOS et al., 2002). Na literatura são descritas várias técnicas de fracionamento de proteína para obtenção e purificação deste componente (PONTIS, 2016; CHAIKLAHAN et al., 2011; AMID; ABDUL MANAP; MUSTAFA, 2013). Afim de substituir os procedimentos tradicionais de separação de proteínas, os quais, geralmente consomem um longo período de tempo, são complexos e de alto custo (WU et al., 2014), os sistemas aquosos bifásicos (SABs) vêm se destacando, principalmente pela sua facilidade e baixo custo (LEONG et al., 2015). Neste contexto, a concentração e/ou purificação das proteínas de S. platensis pode facilitar seu consumo, favorecendo sua aplicação na indústria de alimentos. As proteínas obtidas a partir desta microalga podem apresentar conteúdo balanceado de aminoácidos (MENEGOTTO et al., 2019; BASHIR et al., 2016) e promissoras características funcionais, tais como propriedades emulsificantes e espumantes e capacidade de absorção de água e óleo (LUPATINI et al., 2017b; MENEGOTTO et al., 2019). A fração proteica da S. platensis, também, pode conter cerca de 20% de ficocianina, uma ficobiliproteína com coloração esverdeada, que além do poder colorante pode apresentar algumas propriedades terapêuticas, tais como atividade antioxidante, anti-inflamatória e anticâncer (CHAIKLAHAN; CHIRASUWAN; BUNNAG, 2012; SOUZA et al., 2006). Desta forma, este estudo tem por objetivo aplicar maximizar o processo de purificação de proteínas de S. plantesis através de SAB composto por polietileno glicol (PEG) e citrato de sódio, empregando metodologia de planejamento de experimentos.
Material e métodos
A biomassa de S. platensis foi obtida comercialmente da Fazenda Tamandúa (Santa Terezinha, Paraíba). A extração proteica foi realizada conforme Lupatini et al. (2017a) e adaptações. A biomassa foi suspendida em água purificada (30 g/L) e o pH foi ajustado com NaOH 0,1 M para 9,0. A suspensão foi submetida ao tratamento ultrassônico em banho de ultrassom (Unique, USC-1800A, Indaiatuba) na frequência de 40 kHz, amplitude de 90% por 35 min e, em seguida à agitação mecânica (Fisatom, 712, São Paulo) na velocidade de 100 rpm por 50 min. Para separação das fases realizou-se a centrifugação à 7000 rpm, 25ºC por 15 min (Biosystems, MPW-351R, Curitiba). O extrato proteico de S. platensis (EPSp), obtido pelo sobrenadante resultante da centrifugação, foi submetido aos ensaios de purificação proteica através da aplicação de SAB compostos por citrato de sódio e PEG de diferentes massas molares (1500, 4000, 6000 e 8000 Da). A faixa de pH foi fixada em 9,0, considerando a solubilidade das proteínas de S. platensis (MENEGOTTO et al., 2019) e a necessidade de padronização do pH devido sua interferência no equilíbrio das fases do SAB. Assim, foram aplicados planejamentos fatoriais (PF) 22 (3 pontos centrais, total de 7 ensaios) para a avaliação de duas variáveis sobre o processo de purificação de proteínas: concentração de citrato de sódio (%, m/m) e concentração de PEG (%, m/m); para cada massa molar de PEG foi desenvolvido um PF. Os níveis reais e codificados das variáveis estudadas nos PFs (Tabela 1) foram definidos conforme diagramas de fases os quais foram construídos segundo metodologia descrita por Minami (1997). As concentrações das soluções estoques, PEG e citrato de sódio, foram 50 e 40% (m/m), respectivamente. Os ensaios foram conduzidos em tubos graduados tipo falcon de 50 mL onde foram adicionadas as soluções estoques de PEG e de citrato de sódio, conforme os níveis propostos (Tabela 1). Após a separação das duas fases, o EPSp foi adicionado (20% da massa final do sistema). Na sequência os tubos foram homogeneizados por agitação em vortex (Quimis, Q220B1, Diadema) e mantidos em repouso por 15 min. Por fim ocorreu a centrifugação por 20 min a 4000 rpm a 25 ºC (Biosystems, MPW-351R, Curitiba). As fases topo e fundo foram separadas sendo que cada fase foi submetida à análise de concentração de nitrogênio (g/L) determinada pelo método de oxidação por combustão catalítica a 720ºC com detecção por infravermelho (Shimadzu, TOC-VCSH, Japão); para o cálculo de proteína (g/L) levou-se em consideração o fator geral 6,25 multiplicado pelo nitrogênio. Os parâmetros de purificação, fator de purificação (FP), recuperação (RE), razão volume (Rv) e coeficiente de partição (Kp) foram calculados de acordo com Albertson (1986). Todos os ensaios foram realizados aleatoriamente e as respostas foram tratadas com o programa STATISTICA 11.0 (Statsoft Inc., USA); para tal, considerou-se 90% de nível de confiança.
Resultado e discussão
A Tabela 1 apresenta as matrizes dos PFs 22 (valores reais e codificados)
das variáveis estudadas para os SABs compostos por PEG e citrato de sódio e
respostas dos parâmetros de purificação (FP, RE, Kp e Rv). Em todos os
sistemas, a maior concentração de proteínas ocorreu nas fases topo (Kp >
1,0), indicando maior solubilidade deste componente em solução composta por
PEG. Por este motivo, somente os resultados da fase topo são apresentados e
discutidos.
O SAB composto com PEG e citrato de sódio foi utilizado como estratégia para
recuperar as proteínas de S. platensis previamente extraídas com
ondas ultrassônicas e agitação mecânica. A partição de proteínas utilizando
SAB pode ser influenciada por diversos fatores, tais como: massa molar do
polímero, tipo do sal, concentração do sal e do polímero, pH do sistema,
tamanho da proteína, entre outros (LEONG et al., 2015). O pH é uma variável
importante do processo, considerando-se a solubilidade das proteínas (FRANCO
et al., 2005), portanto este parâmetro foi fixado em 9,0 sendo um ponto de
alta solubilidade das proteínas de S. platensis (MENEGOTTO et al.,
2019). Entre os polímeros, o PEG vem sendo muito utilizado em SAB devido sua
característica inerte e de carga neutra (PEREIRA et al., 2012).
Os maiores FPs ocorreram nos ensaios 4, podendo-se afirmar que maiores
percentuais de sal e PEG favoreceram a purificação proteica. A máxima
purificação ocorreu ao utilizar PEG 1500 e 20% de citrato de sódio (nível
+1); resultando em 1,38 de FP (ensaio 4) e 74,96% de RE (ensaio 1). Em
geral, o fracionamento das proteínas pode ser favorecido com PEG de menor
peso molar, pois em pesos molares mais altos (> 1500 Da), o volume livre da
solução é reduzido, dificultando a solubilidade das proteínas-alvo na fase
rica em polímero e devido ao mecanismo de exclusão molecular, leva as
proteínas a migrarem à fase salina (GOJA et al., 2013; FRANCO et al., 2005).
A Figura 1 representa a análise dos efeitos estimados para os PFs estudados,
os quais estão representados por gráficos de Pareto.
Ao mudar o nível de -1 a +1, a variável citrato de sódio (%) apresentou
efeito positivo para o FP, sendo significativa (p≤0,10) para os SAB
compostos por PEG 1500 e 4000 Da. Os resultados indicam que os máximos FPs
ocorrem em maiores concentrações de sal. Os efeitos positivos se devem,
principalmente, pelo salting-out das proteínas, que ao reduzir a
solubilidade deste componente na fase salina, favorece a migração para fase
topo (NG et al., 2018; SOUZA et al., 2015). Já o efeito negativo na resposta
RE (%) é decorrente da redução de volume da fase topo, muitas vezes,
consequência do aumento da concentração salina (XIN-YING et al., 2012), onde
o sal se liga com as moléculas de água devido a solvatação dos íons (FRANCO
et al., 2005), aumentando o volume da fase fundo.
Em geral, o aumento da concentração do PEG favorece a partição das
proteínas, aumentando o Kp do sistema (PEREIRA et al., 2012). Contudo,
valores intermediários de PEG são recomendados, garantindo uma adequada
separação e purificação (GOJA et al., 2013). Em altas concentrações do
polímero, ocorre o aumento da viscosidade do sistema, dificultando a
homogeneização e, consequentemente, a separação das fases (PEREIRA et al.,
2012).
A aplicação da metodologia de planejamento de experimentos permitiu a
seleção das variáveis estatisticamente significativas em relação ao processo
de purificação de proteínas de S. platensis utilizando SAB composto
por PEG e citrato de sódio, além de identificar em qual massa molar de PEG
ocorreu a melhor performance. De forma geral, o SAB composto com PEG 1500 Da
com maior concentração de polímero e sal (28% de PEG e 20% de sal),
apresentou melhores resultados, possibilitando FP de 1,38 e RE de 63%. Desta
forma, para a otimização do processo, essas variáveis serão redimensionadas,
atendendo os resultados dos efeitos encontrados no PF.
Antelo, Costa e Kalil (2015) estudaram a purificação de ficocianina de S.
platenis com SAB de PEG/Fosfato de potássio, e encontraram resultados
satisfatórios para as massas molares de 1500, 4000, 6000 e 8000 Da, com
faixa de pureza de 0,8 a 1,2. Porém, o sistema composto pelo polímero de
massa molar de 1500 Da proporcionou uma recuperação total da proteína na
fase de topo, enquanto que o de 8000 Da permitiu recuperação de 57%.
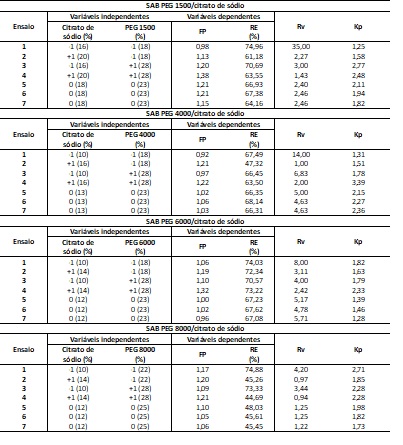
Matriz do PF 2² para concentração de proteínas com SAB PEG/citrato de sódio com as respostas FP e RE (%) e Rv e Kp do sistema.
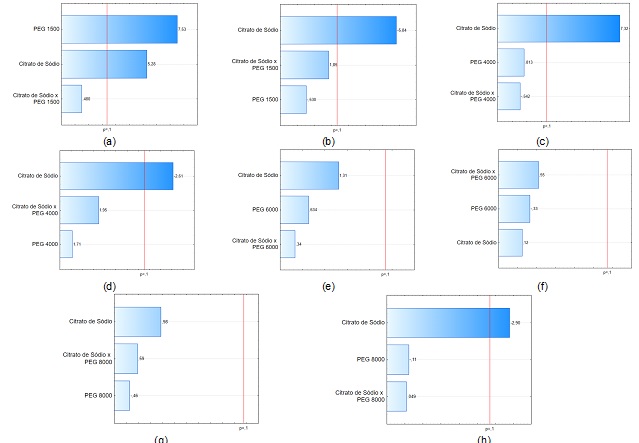
Gráficos de Pareto dos efeitos de FP (a, c, e, f) e RE (b, d, g, h) para SAB com PEG 1500, PEG 4000, PEG 6000 e PEG 8000, respectivamente.
Conclusões
A aplicação da metodologia de planejamento de experimentos possibilitou a seleção das variáveis com efeitos significativos sobre o processo de purificação e recuperação de proteínas de S. platensis utilizando SAB composto por PEG e citrato de sódio. Os maiores resultados das variáveis dependentes (FP e RE) ocorreram nas fases topo dos SABs, demonstrando maior afinidade das proteínas de S. platensis com a fase composta por PEG. Os FP obtidos pelos sistemas aplicando diferentes massas molares de PEG (1500, 4000, 6000 e 8000 Da) foram de 0,92 a 1,38, para os SAB compostos por PEG 4000 e 1500, respectivamente. A máxima purificação das proteínas de S. platensis ocorreu ao utilizar 20% de citrato de sódio e 28% de PEG 1500.
Agradecimentos
Os autores agradecem a CAPES, CNPq, FAPERGS e URI pela concessão de bolsas de estudo e/ou apoio financeiro.
Referências
ALBERTSON, P. A. Partioning of cell particles and macromolecules. Nova York: John Wiley & Sons, 1986.
AMID, M.; ABDUL MANAP, M. Y.; MUSTAFA, S. Purification of pectinase from mango (Mangifera indica L. cv. Chokanan) waste using an aqueous organic phase system: A potential low cost source of the enzyme. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, v. 931, 17–22, 2013.
ANTELO, F. S.; COSTA, J. A. V.; KALIL, S. J. Purification of C-phycocyanin from Spirulina platensis in aqueous two-phase systems using an experimental design. Brazilian Archives of Biology and Technology, v. 58, 1–11, 2015.
BASHIR, S.; SHARIF, M. K.; BUTT, M. S.; SHAHID, M. Functional properties and amino acid profile of Spirulina platensis protein isolates. Pakistan Journal of Scientific and Industrial Research, v. 59, 12–19, 2016.
CHAIKLAHAN, R.; CHIRASUWAN, N.; BUNNAG, B. Stability of phycocyanin extracted from Spirulina sp.: Influence of temperature, pH and preservatives. Process Biochemistry, v. 47, 659–664, 2012.
CHAIKLAHAN, R.; CHIRASUWAN, N.; LOHA, V.; TIA, S.; BUNNAG, B. Separation and purification of phycocyanin from Spirulina sp. using a membrane process. Bioresource Technology, v. 102, 7159–7164, 2011.
FRANCO, T. T.; KILIKIAN, B. V.; COIMBRA, J. S. R.; MEIRELLES, A. J. A. Extração líquido-líquido em sistemas de duas fases aquosas. In: PESSOA JR, A.; KILIKIAN, B. V. Purificação de Produtos Biotecnológicos. Barueri: Manole, 2005.
FU, H.; DAI, H.; SUN, Y.; ZHANG, D.; XIU, Z. Partition behavior of hydrophilic diols in an ethanol/ammonium sulfate salting-out extraction system. Engineering in Life Sciences, v. 15, 797–803, 2015.
GOJA, A. M.; YANG, H.; CUI, M.; LI, C. Aqueous two-phase extraction advances for bioseparation. Journal of Bioprocessing & Biotechniques, v. 4, 1–8, 2013.
LEONG, Y. K.; KOROH, F. E.; SHOW, P. L.; LAN, J. C.-W.; LOH, H.-S. Optimisation of extractive bioconversion for green polymer via aqueous two-phase system. Chemical Engineering Transactions, v. 45, 1495–1500, 2015.
LUPATINI, A, L.; BISPO, L. O.; COLLA, L. M.; COSTA, J. A. V.; CANAN, C.; COLLA, E. Protein and carbohydrate extraction from S. platensis biomass by ultrasound and mechanical agitation. Food Research International, v. 99, 1028–1035, 2017a.
LUPATINI, A. L.; COLLA, L. M.; CANAN, C.; COLLA, E. Potential application of microalgae Spirulina platensis as a protein source. Journal of the Science of Food and Agriculture, v. 97, 724–732, 2017b.
MARCOS, J. C.; FONSECA, L. P.; RAMALHO, M. T.; CABRAL, J. M. S. Application of surface response analysis to the optimization of penicillin acylase purification in aqueous two-phase systems. Enzyme and Microbial Technology, v. 31, 1006–1014, 2002.
MINAMI, N. M. Extração líquido-líquido aplicada à separação e purificação de amiloglicosidase. 1997. Dissertação (Mestrado em Engenharia Química) – Engenharia Química, Escola Politécnica da Universidade de São Paulo, São Paulo.
MENEGOTTO et al.; SOUZA, L. E. S.; COLLA, L. M.; COSTA, J. A. V.; SEHN, E.; BITTENCOURT, P. R. S.; FLORES, E. L. M.; CANAN, C.; COLLA, E. Investigation of techno-functional and physicochemical properties of Spirulina platensis protein concentrate for food enrichment. LWT – Food Science and Technology, v. 114, 108267, 2019.
NG, H. S.; CHAI, C. X. Y.; CHOW, Y. H.; LOH, W. L. C.; YIM, H. S.; TAN, J. S.; LAN, J. C.-W. Direct recovery of Bacillus subtilis xylanase from fermentation broth with an alcohol/salt aqueous biphasic system. Journal of Bioscience and Bioengineering, v. 125, 585–589, 2018.
PEREIRA, J. F. B.; SANTOS, V. C.; JOHANSSON, H.-O.; TEIXEIRA, J. A. C.; PESSOA JR, A. A stable liquid-liquid extraction system for clavulanic acid using polymer-based aqueous two-phase systems. Separation and Purification Technology, v. 98, 441–450, 2012.
PHONG, W. N.; SHOW, P. L.; TEH, W. H.; TEH, T. X.; LIM, H. M. Y.; NAZRI, N. S. B.; TAN, C. H.; CHANG, J.-S.; LING, T. C. Proteins recovery from wet microalgae using liquid biphasic flotation (LBF). Bioresource Technology, v. 244, 1329–1336, 2017.
PONTIS, H. G. Methods for analysis of carbohydrate metabolism in photosynthetic organisms. Plants, green algae, and cyanobacteria. London: Elsevier Inc., 2016.
RAJA, S.; MURTY, V. R.; THIVAHARAN, V.; RAJASEKAR, V.; RAMESH, V. Aqueous two phase systems for the recovery of biomolecules – a review. Science and Technology, v. 1, 7–16, 2011.
SOUZA, R. L.; LIMA, R. A.; COUTINHO, J. A. P.; SOARES, C. M. F.; LIMA, A. S. Novel aqueous two-phase systems based on tetrahydrofuran and potassium phosphate buffer for purification of lipase. Process biochemistry, v. 50, 1459–1467, 2015.
SOUZA, F. T.; MARGARITES, A. C.; COLLA, L. M.; COSTA, J. A. V.; BERTOLIN, T. E. Avaliação do potencial antioxidante da ficocianina em sistema lipídico óleo de soja e azeite de oliva. Alimentos e Nutrição, v. 17, 275–279, 2006.
WU, Y.; WANG, Y.; ZHANG, W.; HAN, J.; LIU, Y.; HU, Y.; NI, L. Extraction and preliminary purification of anthocyanins from grape juice in aqueous two-phase system. Separation and Purification Technology, v. 124, 170–178, 2014.
XIN-YING, Z.; FENG, Q.; MIN, D.; FAN, C.; AI-QIN, L.; JING-HUA, Z. Separation of proteins by aqueous two-phase extraction system combined with liquid chromatography. Chinese Journal of Analytical Chemistry, v. 40, 38–42, 2012.









