Purificação de proteínas de Spirulina platensis através de sistema aquoso bifásico composto por etanol e fosfato de potássio
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Menegotto, A.L.L. (URI - ERECHIM) ; Balestieri, B.P. (URI - ERECHIM) ; Bucior, D. (URI - ERECHIM) ; Puton, B.M.S. (URI- ERECHIM) ; Steffens, J. (URI - ERECHIM) ; Valduga, E. (URI - ERECHIM)
Resumo
A Spirulina platensis é considerada uma fonte alternativa de proteínas, podendo ser comparada às proteínas de fonte animal e vegetal. Com o intuito de avaliar a purificação e recuperação deste componente, este trabalho avaliou a performance de sistema aquoso bifásico composto (SAB) por fosfato de potássio e etanol. Para tal, foi aplicado um delineamento composto central rotacional (DCCR) considerando as variáveis concentração de fosfato de potássio e de etanol. A máxima recuperação foi de 78,80%, com coeficiente de partição de 2,91 e fator de purificação 1,29; utilizando 30% etanol e 19% fosfato de potássio.
Palavras chaves
DCCR; Proteína; Microalga
Introdução
As microalgas são consideradas uma fonte alternativa de proteínas (ROY; PAL, 2015). O seu cultivo para esta finalidade teve início entre os anos 60 e 70, quando alguns pesquisadores mencionaram a possibilidade de falta de alimentos devido ao crescimento exponencial da população (MATASSA et al., 2016). Entre as microalgas, a Spirulina spp. tem recebido grande atenção principalmente devido seu alto percentual proteico, além da sua facilidade de cultivo (LUPATINI et al., 2017b). Além do apreciável teor de proteínas com presença de aminoácidos de qualidade, a S. platensis apresenta alta concentração de vitaminas, ácidos graxos essenciais e minerais (MENEGOTTO et al., 2019; EL-TANTAWY, 2015). O processo de obtenção de proteínas de microalgas envolve sua extração e em seguida o isolamento e recuperação do componente (PHONG et al., 2017). Para extração de proteínas de S. platensis muitas técnicas de ruptura celular vêm sendo avaliadas, entre elas a utilização de ultrassom (GERDE et al., 2013) destaca-se por apresentar vários benefícios, além de ser considerado um método alternativo aos convencionais (HOSSAIN et al., 2012); a combinação entre diferentes técnicas de rompimento celular pode aperfeiçoar o processo de extração (WANG; ZHANG, 2012). Após a extração, as proteínas devem ser recuperadas e separadas dos demais constituintes, para tal fim técnicas como tratamentos enzimáticos, precipitações baseadas na solubilidade destas proteínas, incluindo salting-out e precipitação isoelétrica (CHAIKLAHAN et al., 2011), cromatografia (PONTIS, 2016), sistemas aquosos bifásicos (SAB) (AMID; ABDUL MANAP; MUSTAFA, 2013) e processos de separação por membranas (PSM) (NAGARAJ; PATIL; BIRADAR, 2006) vem sendo estudadas. O sistema aquoso bifásico (SAB) é uma alternativa para recuperação de biomoléculas, consistindo na mistura ternaria heterogênea formada por duas fases líquidas imiscíveis em equilíbrio (AMID; ABDUL MANAP; MUSTAFA, 2013). Estes sistemas, na maioria das vezes, são compostos por dois polímeros ou um polímero e um sal (OOI et al. 2009). Contudo a utilização de polímeros possui grande desvantagens, incluindo o alto custo e a dificuldade de recuperação deste material, além da lenta separação das fases. Neste contexto, SABs compostos por solventes orgânicos e soluções salinas vem se destacando, principalmente pela simplicidade, baixo custo (TIANWEI; QING; QIANG, 2002) e facilidade de reciclo dos componentes o que contribui para a aplicação industrial (TAN; LI; XU, 2013). Baseado no exposto, o objetivo desta pesquisa foi a avaliar a purificação e recuperação de proteínas de S. platensis , previamente extraídas por ultrassom e agitação mecânica, aplicando SAB composto por fosfato de potássio e etanol.
Material e métodos
A biomassa de S. platensis foi obtida comercialmente da Fazenda Tamanduá (Santa Terezinha, Paraíba). A extração proteica foi realizada conforme Lupatini et al. (2017a) e adaptações. A biomassa foi suspendida em água purificada (30 g.L-1) e o pH foi ajustado com NaOH 0,1 M para 9,0. A suspensão foi submetida ao tratamento ultrassônico em banho de ultrassom (Unique, USC-1800A, Indaiatuba) na frequência de 40 kHz, amplitude de 90% por 35 min e, em seguida à agitação mecânica (Fisatom, 712, São Paulo) na velocidade de 100 rpm por 50 min. Para separação das fases realizou-se a centrifugação à 7000 rpm, 25ºC por 15 min (Biosystems, MPW- 351R, Curitiba). O extrato proteico de S. platensis (EPSp), obtido pelo sobrenadante resultante da centrifugação, foi submetido aos ensaios de purificação proteica através da aplicação de SAB composto por fosfato de potássio e etanol mediante o emprego de um delineamento composto central rotacional (DCCR) 22, 3 pontos centrais, total de 11 ensaios, para a avaliação de duas variáveis sobre o processo de purificação de proteínas: concentração de fosfato de potássio (%, m/m) e concentração de etanol (%,m/m). Os níveis reais e codificados das variáveis estudadas no DCCR (Tabela 1) foram determinados conforme as curvas binodais obtidas por Leong et al. (2018) e Wang et al. (2010). A concentração da solução estoque salina foi de 40% (m/m). Os ensaios foram conduzidos em tubos graduados tipo falcon de 50 mL onde foram adicionadas as soluções estoques de fosfato de potássio e etanol, conforme os níveis propostos (Tabela 1). Após a separação das duas fases, o EPSp foi adicionado (20% da massa final do sistema). Na sequência os tubos foram homogeneizados por agitação em vortex (Quimis, Q220B1, Diadema) e mantidos em repouso por 15 min. Por fim ocorreu a centrifugação por 20 min a 4000 rpm a 25 ºC (Biosystems, MPW-351R, Curitiba). As fases topo e fundo foram separadas sendo que cada fase foi submetida à análise de concentração de nitrogênio (g.L-1) determinada pelo método de oxidação por combustão catalítica a 720ºC com detecção por infravermelho (Shimadzu, TOC-VCSH, Japão); para o cálculo de proteína (g.L-1) levou-se em consideração o fator geral 6,25 multiplicado pelo nitrogênio. Os parâmetros de purificação, fator de purificação (FP), recuperação (RE), razão volume (Rv) e coeficiente de partição (Kp) foram calculados de acordo com Albertson (1986). Todos os ensaios foram realizados aleatoriamente e as respostas foram tratadas com o programa STATISTICA 11.0 (Statsoft Inc., USA); para tal, considerou-se 90% de nível de confiança.
Resultado e discussão
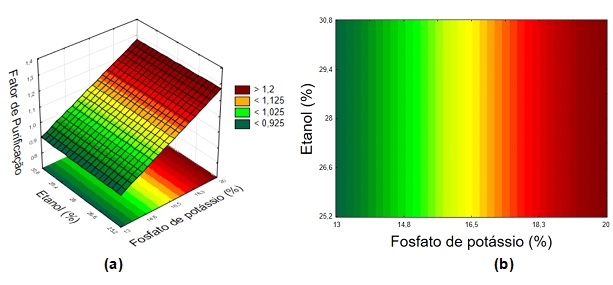
A Tabela 1 apresenta as matrizes do DCCR 22 (valores reais e
codificados) das variáveis estudadas para os SABs compostos por fosfato de
potássio e etanol e respostas dos parâmetros de purificação (FP, RE, Kpe
Rv). Em todos os sistemas, a maior concentração de proteínas ocorreu nas
fases topo, indicando que esta foi mais solúvel na fase rica em etanol. A
preferência pela fase topo resultou em valores de Kp maiores que 1 para
todos os ensaios. Desta forma, somente os resultados da fase topo são
apresentados e discutidos.
Os FP para o SAB composto por fosfato de potássio e etanol variaram entre
0,90 a 1,29 na fase topo (ensaios 5 e 4) e a recuperação entre 68,73 a
80,28% (ensaios 8 e 7). Analisando-se os resultados dos DCCRs foi possível
determinar os coeficientes de regressão para os parâmetros de purificação e
com os parâmetros significativos foi obtido um modelo codificado de segunda
ordem, dentro da faixa estudada. Para o FP, o modelo obtido foi:
FP=1,09+0,13x1 , onde x1 é a concentração de fosfato
de potássio. O modelo foi validado pela análise de variância pois o
Fcalculado foi aproximadamente 18 vezes maior que o
Ftabelado, bem como o coeficiente de correlação que foi 0,93.
Para RE não foi possível obter um modelo matemático visto que o percentual
de variação explicado pelo modelo não foi adequado, com coeficiente de
correlação igual 0,56 e Fcalculado menor que o
Ftabelado.
Desta forma foi possível construir a superfície de resposta e as curvas de
contorno (Figura 1) para o FP. Além disso, os desvios relativos – DR (Tabela
1) foram inferiores à 20%, comprovando o ajuste adequado do modelo aos dados
experimentais.
Observa-se pela superfície de resposta e curvas de contorno (Figura 1) que a
combinação entre 18 a 20% de fosfato de potássio e qualquer concentração de
etanol, dentro da faixa estudada (25,2 a 30,8%), resultaram em maiores
fatores de purificação (>1,2).
O efeito positivo da concentração de fosfato de potássio, indica que a
medida que aumenta a concentração de sal tem-se maior teor de purificação da
proteína desejada. Na literatura há relatos que conforme o aumento da
concentração salina, a proteína tende a migrar para fase topo (SOUZA et al.,
2015; LI; TENG; XIU, 2011; OOI et al., 2009). Ao aumentar a concentração
salina ocorre a redução da solubilidade das proteínas na fase rica em sal
(fase fundo) levando a concentração deste componente na fase topo, resultado
decorrente do efeito salting-out (NG et al., 2018).
A variável concentração de etanol (%) não apresentou efeito significativo,
sendo que qualquer concentração dentro da faixa estudada (25,2 a 30,8%),
proporcionou resultados semelhantes. Contudo, avaliando a Tabela 1, é
possível verificar que menores concentrações de etanol possibilitaram
maiores valores de recuperação. Isso ocorre, pois em baixos percentuais de
álcool, as proteínas permanecem mais solúveis (DAMODARAN, 2017).
Na literatura não foram encontrados dados aplicando a estratégia de
purificação com SAB composto de fostato de potássio e etanol para
recuperação de proteínas de microalgas S. platensis , mesmo que o SAB
seja utilizado há anos para concentrar e/ou purificar biomoléculas (LAM et
al., 2018). Entretanto, os dados obtidos neste estudo são coerentes com a
literatura, revelando a afinidade das proteínas pela fase topo (etanol) e
confirmando que a concentração salina é o principal interferente na partição
proteica utilizando SAB, devido seu efeito salting-out (BABU et al.,
2008).
Conclusões
A partir do uso de técnicas de planejamento de experimentos foi possível realizar a maximização da purificação de proteínas de S. Platensis pela aplicação de SAB composto por fosfato de potássio e etanol. Os maiores parâmetros de purificação ocorreram na fase topo do SAB, demonstrando maior afinidade das proteínas de S. platensis com a fase composta por etanol. O SAB composto por 19% de fosfato de potássio e 30% de etanol apresentou a melhor performance para purificar as proteínas de S. platensis, com coeficiente de partição de 2,91, FP de 1,29 e 78,80% de RE.
Agradecimentos
Os autores agradecem a CAPES, CNPq, FAPERGS e URI pela concessão de bolsas de estudo e/ou apoio financeiro.
Referências
ALBERTSON, P. A. Partioning of cell particles and macromolecules. Nova York: John Wiley & Sons, 1986.
AMID, M.; ABDUL MANAP, M. Y.; MUSTAFA, S. Purification of pectinase from mango (Mangifera indica L. cv. Chokanan) waste using an aqueous organic phase system: A potential low cost source of the enzyme. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, v. 931, p. 17–22, 2013.
BABU, B. R.; RASTOGI, N. K.; RAGHAVARAO, K. S. M. S. Liquid-liquid extraction of bromelain and polyphenol oxidase using aqueous two-phase system. Chemical Engineering and Processing, v. 47, p. 83–89, 2008.
CHAIKLAHAN, R.; CHIRASUWAN, N.; LOHA, V.; TIA, S.; BUNNAG, B. Separation and purification of phycocyanin from Spirulina sp. using a membrane process. Bioresource Technology, v. 102, p. 7159–7164, 2011.
DAMODARAN, S. Amino acids, peptides, and proteins. In: DAMODARAN, S.; PARKIN, K. L. (eds.), Fennema’s Food Chemistry. 5. ed. Boca Raton: CRC Press, 2017.
EL-TANTAWY, W. H. Antioxidant effects of Spirulina supplement against lead acetate-induced hepatic injury in rats. Journal of Traditional Chinese Medical Sciences, p. 0–4, 2015.
GERDE, J. A.; WANG, T.; YAO, L.; JUNG, S.; JOHSON, L. A.; LAMSAL, B. Optimizing protein isolation from defatted and non-defatted Nannochloropsis microalgae biomass. Algal Research, v. 2, p. 145–153, 2013.
HOSSAIN, M. B.; BRUNTON, N. P.; PATRAS, A.; TIWARI, B.; O'DONNELL, C. P.; MARTIN-DIANA, A. B.; BARRY-RYAN, C. Optimization of ultrasound assisted extraction of antioxidant compounds from marjoram (Origanum majorana L.) using response surface methodology. Ultrasonics sonochemistry, v. 19, p. 582–90, 2012.
LAM, G. P.; VERMUË, M. H.; EPPINK, M. H. M.; WIJFFELS, R. H.; BERG, C. Multi-product microalgae biorefineries from concept towards reality. Trends in Biotechnology, v. 36, p. 216–227, 2018.
LEONG, H. Y.; OOI, C. W.; LAW, C. L.; JULKIFLE, A. L.; SHOW, P. L. Betacyainins extraction from Hylocereuspolyrhizus using alcohol/salt-based liquid biphasic patitioningsystem and antioxidant activity evaluation. Separation Science and Technology, DOI: 10.1080/01496395.2018.1517795, 2018.
LI, Z.; TENG, H.; XIU, Z. Extraction of 1,3-propanediol from glycerol-based fermentation broths with metanol/phosphate aqueous two-phase system. Process Biochemistry, v. 46, p. 586–591, 2011.
LUPATINI, A, L.; BISPO, L. O.; COLLA, L. M.; COSTA, J. A. V.; CANAN, C.; COLLA, E. Protein and carbohydrate extraction from S. platensis biomass by ultrasound and mechanical agitation. Food Research International, v. 99, 1028–1035, 2017a.
LUPATINI, A. L.; COLLA, L. M.; CANAN, C.; COLLA, E. Potential application of microalgae Spirulina platensis as a protein source. Journal of the Science of Food and Agriculture, v. 97,724–732, 2017b.
MATASSA, S.; BOON, N.; PIKAAR, I.; VERSTRAETE, W. Microbial protein: future sustainable food suply route with low environmental footprint. Microbial Biotechnology, v. 9, p. 568–575, 2016.
MENEGOTTO et al.; SOUZA, L. E. S.; COLLA, L. M.; COSTA, J. A. V.; SEHN, E.; BITTENCOURT, P. R. S.; FLORES, E. L. M.; CANAN, C.; COLLA, E. Investigation of techno-functional and physicochemical properties of Spirulina platensis protein concentrate for food enrichment. LWT – Food Science and Technology, v. 114, 108267, 2019.
NAGARAJ, N.; PATIL, B. S.; BIRADAR, P. M. Osmotic membrane distillation – a brief review. International Journal of Food Engineering, v. 2, p. 1–22, 2006.
NG, H. S.; CHAI, C. X. Y.; CHOW, Y. H.; LOH, W. L. C.; YIM, H. S.; TAN, J. S.; LAN, J. C.-W. Direct recovery of Bacillus subtilis xylanase from fermentation broth with an alcohol/salt aqueous biphasic system. Journal of Bioscience and Bioengineering, v. 125, p. 585–589, 2018.
OOI, C. W.; TEY, B. T.; HII, S. L.; MAZLINA, S.; KAMAL, S. M. M.; LAN, J. C. W.; ARIFF, A.; LING, T. C. Purification of lipase derived from Burkholderia pseudomallei with alcohol/salt-based aqueous two-phase systems. Process Biochemistry, v. 44, p. 1083–1087, 2009.
PHONG, W. N.; SHOW, P. L.; TEH, W. H.; TEH, T. X.; LIM, H. M. Y.; NAZRI, N. S. B.; TAN, C. H.; CHANG, J.-S.; LING, T. C. Proteins recovery from wet microalgae using liquid biphasic flotation (LBF). Bioresource Technology, v. 244, p. 1329–1336, 2017.
PONTIS, H. G. Methods for analysis of carbohydrate metabolism in photosynthetic organisms. Plants, green algae, and cyanobacteria. London: Elsevier Inc..
ROY, S. S.; PAL, R. Microalgae in aquaculture: A review with special references to nutritional value and fish dietetics. Proceedings of the Zoological Society, v. 68, p. 1–8, 2015.
SOUZA, R. L.; LIMA, R. A.; COUTINHO, J. A. P.; SOARES, C. M. F.; LIMA, A. S. Novel aqueous two-phase systems based on tetrahydrofuran and potassium phosphate buffer for purification of lipase. Process biochemistry, v. 50, p. 1459–1467, 2015.
TAN, Z.-J.; LI; F.-F.; XU, X.-L. Extraction and purification of anthraquinones derivatives from Aloe veraL. using alcohol/salt aqueous two-phase system. Bioprocess and Biosystems Engineering, v. 36, p. 1105–1113, 2013.
TIANWEI, T.; QING, H.; QIANG, L. Purification of glycyrrhizin from Glycyrrhiza uralensis Fisch with ethanol/phosphate aqueous two phase system. Biotechnology Letters, v. 24, p. 1417–1420, 2002.
WANG, Y., MAO, Y.; HAN, J.; LIU, Y.; YAN, H. Liquid-liquid equilibrium of potassium phosphate/potassium citrate/sodium citrate + ethanol aqueous two-phase systems at (298,15 and 313,15) K and correlation. Journal Chemical Engineering, v. 55 p. 5621–5626, 2010.
WANG, X.; ZHANG, X. Bioresource Technology Optimal extraction and hydrolysis of Chlorella pyrenoidosa proteins. Bioresource Technology, v. 126, p. 307–313, 2012.









