PARÂMETROS CINÉTICOS DA BIOPRODUÇÃO DE CAROTENOIDES POR PHAFFIA RHODOZYMA Y-17268 EM BIORREATOR SISTEMA SEMICONTÍNUO EMPREGANDO RESIDUOS AGROINDUSTRIAIS
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Colet, R. (URI) ; Melo, R.N. (URI) ; Gayeski, L. (URI) ; Reato, P. (URI) ; Steffens, C. (URI) ; Valduga, E. (URI)
Resumo
A produção de carotenoides por rota biotecnológica tem se expandido nos últimos anos, essa resulta em produtos seguros, sendo considerados produtos naturais. Este trabalho teve por objetivo a avaliação dos parâmetros cinéticos da produção de carotenoides por Phaffia rhodozyma Y-17268 em biorreator sistema semicontínuo empregando resíduos agroindustriais. A produção foi realizada em biorreator com 1,5 vvm, 250 rpm, 25°C e pH inicial 4,0, por 288h, com corte de 50%,cada 96h de bioprodução. Com o corte de 50% se obteve uma maior bioprodução de carotenoides totais de 5851μg/L (886 μg/g de carotenoides específicos) em 192 h de cultivo. Desta forma, foi demonstrado que o sistema semicontínuo empregando matérias-primas agroindustriais é uma alternativa promissora para o aumento de escala.
Palavras chaves
pigmentos; processo semicontínuo; resíduos agroindustriais
Introdução
A vasta aplicabilidade dos carotenoides resultam no aumento da demanda pelas indústrias de alimentos, cosméticos e fármacos, cujo mercado mundial foi avaliado em 1,5 bilhões em 2017, com uma expectativa de crescimento para 2,0 bilhões em 2022 e uma taxa de crescimento anual de 5,7% (BCC RESEARCH, 2018). Tal fato proporcionou o aumento do interesse dos pesquisadores em descobrir novas fontes, processos e técnicas que pudessem ser empregadas para intensificar a produção destes pigmentos por microrganismos, considerando que os carotenoides obtidos por síntese química envolvem um grande número de reações complexas, enquanto que estes mesmos carotenoides estão presentes naturalmente em microalgas, bactérias, leveduras e fungos (FÁBREGAS et al., 2001; BHOSALE et al., 2004; DIAS et al., 2015; COLET et al., 2015; TSAI et al., 2016; CARDOSO et al., 2016). O grande interesse na exploração destes pigmentos ocorreu em função da variabilidade de suas aplicações. Além da utilização como corante nas indústrias alimentícias e de ração animal, estes compostos possuem propriedades antioxidantes, o que torna possível o emprego em tratamentos de prevenção ao câncer, às doenças do coração e da degeneração macular (KRINSKY e JOHNSON, 2005; VENIL et al., 2013; AKUFFO et al., 2015; WU et al., 2015; ESTEBAN et al., 2015; SONG et al., 2016; BERNSTEIN et al., 2016). A maioria dos processos biotecnológicos têm sido desenvolvidos em frascos agitados e a utilização industrial dependerá da capacidade de ampliar esses processos. Os biorreatores apresentam-se, assim, como uma alternativa ao desenvolvimento dos bioprocessos pois fornecem um ambiente favorável ao crescimento dos micro-organismos (MANOWATTANA et al., 2018). Visando os benefícios dos carotenoides, regimes de condução, semicontínuo, são considerados eficientes e versáteis para a produção de carotenoides. Em tais processos, especialmente naqueles com altas densidades celulares, a produtividade é alta devido ao grande número de células viáveis no meio de bioprodução. O processo semicontínuo consiste em uma série de operações em sequência, no qual coleta-se parte do meio fermentado (cortes da fermentação) em períodos sequenciais e adiciona-se ao reator um volume de meio de fermentação igual ao volume de meio fermentado retirado, e o meio fermentado que permanece no reator serve de inoculo ao meio adicionado (SCHMIDELL et al., 2007; FERREYRA et al., 2014; CALDEIRA, 2015). Além disso, ressalta-se a possibilidade da utilização de subprodutos agrícolas de baixo custo e/ou resíduos, como matéria-prima, o que pode aumentar a viabilidade econômica do processo. Países com grande biodiversidade, como o Brasil, apresentam um grande potencial a ser explorado na utilização dessas matérias primas (AKSU e EREN, 2005; FONTANA et al., 1996; VALDUGA et al., 2008; SAENGE et al., 2011; VALDUGA et al., 2014; MACHADO e BURKERT, 2014; COLET et al., 2015; CARDOSO et al., 2016). Neste sentido, é de interesse estudar os parâmetros cinéticos da produção de carotenoides pela levedura Phaffia rhodozyma Y-17268 em processo semicontínuo em biorreator com corte de 50% com resíduos agroindustriais, visando obter pigmentos naturais capazes de catalisar reações, tendo como produtos compostos com alto valor agregado.
Material e métodos
2.1 Micro-organismo e bioprodução de carotenoides A produção de carotenoides foi realizada com a levedura Phaffia rhodozyma Y-17268, gentilmente cedida pelo Laboratório de Engenharia de Bioprocessos da FURG-Universidade Federal de Rio Grande. Para o preparo do inoculo, uma alçada de células da cultura estoque foi transferida para um erlenmeyer de 250 mL contendo 100 mL de meio YM (Yeast Malt Extract): 3 g/L de extrato de levedura, 3 g/L de extrato de malte, 5 g/L de peptona e 10 g/L de glicose. O meio foi previamente esterilizado em autoclave a 121 °C por 15 min, e então, realizou-se a incubação em agitador orbital a 25°C, 180 rpm por aproximadamente 48 h. Os ensaios da bioprodução de carotenoides em sistema semicontínuo, realizando-se corte de 50 % a cada 96 h de bioprodução, foram realizados em Biorreator Biostat B de 2 L, 25 °C, em ambiente com 1,2 lux, 250 rpm e 1,5 vvm de aeração. O meio foi composto por misturas de subprodutos agroindustriais (100 g/L de AMM, 100 g/L de glicerol bruto e 20 g/L de APA). A cada 24 horas foram obtidas amostras para a determinação da cinética de bioprodução de carotenoides, biomassa e pH. 2.2 Recuperações de carotenoides 2.2.1 Preparo da amostra As amostras foram centrifugadas a 3.000x g, 5 °C por 10 minutos e realizada lavagem com álcool etílico e posterior lavagem com água destilada para remoção de resíduos de glicerol na célula. As mesmas foram congeladas em freezer a ~-80°C por 5 horas e secas em liofilizador por 36h. 2.2.2 Rompimento celular À 0,05 g de células secas, foram adicionados 2 mL de dimetilsufóxido – DMSO. As amostras foram submetidas a intervalos de 60 minutos de agitação a 180 rpm e aquecimento de 30°C em shaker. 2.2.3 Extrações dos pigmentos Em seguida, adicionou-se 4 mL de acetona, seguido de centrifugações (3.000 g, 5 °C, 10 min). O sobrenadante foi separado e realizaram-se extrações sucessivas, até que o solvente e as células apresentam-se sem coloração. Nas fases solventes (sobrenadante) foram adicionados 10 mL da solução de NaCl 20% (p/v) e 10 mL de éter de petróleo. Após agitação e separação de fases foi realizado uma filtração com a adição de 2 g de sulfato de sódio e retirada a fase sobrenadante com o auxílio de uma pipeta. 2.2.4 Determinação de carotenoides A absorbância da amostra após extração foi medida em espectrofotômetro. A concentração total de carotenoides foi estimada através do valor medido da máxima absorbância a 474 nm, utilizando a equação descrita por DAVIES (1976). O coeficiente de absorbância utilizado foi o referente a astaxantina: E 1%1cm = 2100, para o solvente éter de petróleo (SILVA et al., 2004). 2.2.5 Cinética de Bioprodução A biomassa foi determinada após extração dos carotenoides, onde as células foram lavadas com água destilada, centrifugadas (6.500 xg e 5°C por 10 min) e a massa celular foi quantificada através de secagem em estufa (Fanem SE- 320) a 105°C. O pH dos ensaios foi determinado usando o potenciômetro (DMPH- 2, Digimed).
Resultado e discussão
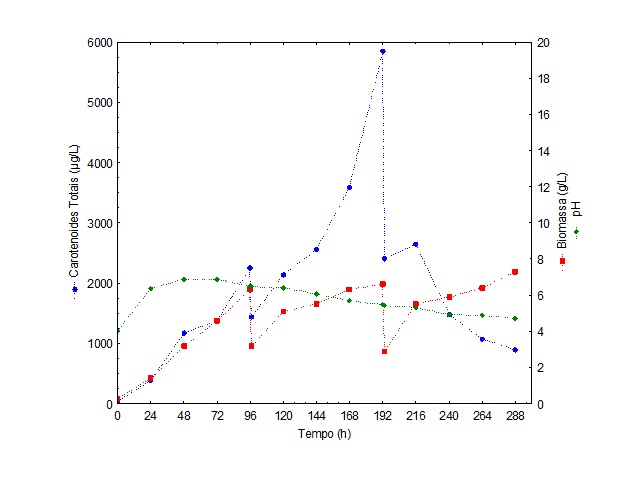
A Figura 1 apresenta a cinética de crescimento celular da bioprodução de
carotenoides totais e a evolução do pH em processo semicontínuo com corte de
50% a cada 96 h. A concentração máxima de carotenoides foi de 5851 µg/L em
192 h de bioprodução.
Comparando-se o início da produção com o sistema após cada corte a adaptação
da levedura P. rhodozyma com o meio ocorreu em menos tempo de
bioprodução, necessitando cerca de 24 h para a adaptação com o meio após 96
h e 192 h. Isto se deve ao menor tempo da fase lag (pré-adaptação), devido o
processo semicontínuo, no qual o meio não retirado do biorreator serviu de
inóculo ao meio de bioprodução adicionado, sendo esta considerada uma das
vantagens deste processo.
Verificou-se que após os cortes (Figura 1) ocorreu diminuição momentânea da
concentração da biomassa, possivelmente devido à diluição proveniente do
meio novo adicionado, mas ocorreu um aumento ao longo da bioprodução,
alcançando 7,3 g/L em 288 h. Porém, esta alta concentração de biomassa não
significou incremento da concentração de carotenoides, isto pode ser
explicado a fato que à medida que os cortes vão sendo realizados à
concentração celular aumenta, mas possíveis inibidores produzidos pelo
micro-organismo acabam dificultando seu metabolismo e a produção do produto
desejado (OTERO et al., 1998).
O pH é um dos parâmetros ambientais mais importantes que exercem influência
no crescimento celular e formação de produto, e de forma geral este aumenta
nas primeiras horas de fermentação (FRENGOVA et al., 1994). No início da
fermentação ocorreu uma elevação do pH (Figura 1), onde possivelmente isto
esteja relacionado a proteólise do micro-organismo, fenômeno natural que
ocorre após elevado consumo do substrato, principalmente quando a linhagem
não utiliza outra fonte de carbono; como consequência da degradação de
aminoácidos, há formação de amônia e esta pode ser responsável pela elevação
do pH. O pH no meio agroindustrial diminuiu após o segundo corte, chegando a
maior produção de carotenoides no pH de 5,48.
COLET. et al (2017) obtiveram a máxima produção de carotenoides em sistema
semicontínuo de 7388 μg/L em 288 h com a levedura Sporoidiobolus
salmonicolor, com corte de 50% a cada 96 h, ao utilizar meio otimizado à
base de resíduos agroindustriais (80g/L de AMM, 80g/L de glicerol bruto e
20g/L de APA), demonstrando um incremento de aproximadamente 55% na
concentração quando comparado ao processo de batelada alimentada (4753 μg/L
em 96 h).
Ao comparar os resultados do presente estudo, do sistema semicontínuo em
relação ao sistema batelada alimentada houve um incremento dos carotenoides
totais de aproximadamente 30% e de 258% se comparado aos frascos agitados
(URNAU, 2018)com a levedura P. rhodozyma.
O sistema semicontínuo tem uma boa eficiência, por apresentar algumas
vantagens principais: a redução do tempo de preparo de substratos e inóculo
e também o corte na fase lag do micro-organismo o que facilita com que o
mesmo se adapte mais rapidamente ao meio e assim produza os metabolitos de
interesse.
O uso dos substratos de baixo custo (água de parboilização, água de
maceração de milho e glicerol) fazem com que o processo seja viável e
aplicável em grande escala e consideravelmente vantajoso.
Conclusões
Ao analisar os resultados obtidos na bioprodução de carotenoides de P. rhodozyma Y-17268, o processo semicontínuo com corte de 50% e tempo de 192h seria um processo recomendado para aumento de escala industrial, levando assim a um incremento na produção e consequente aumento nos rendimentos se comparado a processo em batelada alimentada e simples. A utilização de glicerol, água de maceração de milho e água de parboilização de arroz é uma alternativa viável para produção de carotenoides, principalmente por que o Brasil é rico nestes substratos, de baixo custo, ou seja, o uso de resíduos (coprodutos) além de tornar o processo menos dispendioso, apresenta-se como uma alternativa ao descarte inadequado desses coprodutos, visto que são ricos em material orgânico. Diante do presente estudo apresentasse uma opção viável de produção de carotenoides, levando-se em consideração que o bioproduto gerado é considerado natural e pode ser aplicado em alimentos sem apresentar riscos à saúde do consumidor. Além disso, o uso de substratos de menor valor, torna a bioprodução aplicável.
Agradecimentos
À URI, FAPERGS e a CAPES pelo apoio financeiro e bolsas de estudos disponibilizadas para a realização deste trabalho.
Referências
AKSU, Z.; EREN, A. T. Carotenoids production by the yeast Rhodotorula mucilaginosa: use of agricultural wastes as a carbon source. Process Biochemistry, v. 40, p. 2985–2991, 2005.
Akuffo, K. O.; Nolan, J. M.; Howard, A. N.; Moran, R.; Stack, J.; Klein, R.; Klein, B. E.; Meuer, S. M.; Sabour-Pickett, S.; Thurnham, D. I.; Beatty, S. Sustained supplementation and monitored response with differing carotenoid formulations in early age-related macular degeneration. Eye – Clinical Study, v. 29, p. 902-912, 2015.
BCC Research: The global market for carotenoids, julho de 2018 [https://www.bccresearch.com/market-research/food-and-beverage/the-global-market-for-carotenoids.html] - acessado em 02/07/2019.
Bernstein, P. S.; Li, B.; Vachali, P. P.; Gorusupudi, A.; Shyam, R.; Henriksen, B. S.; Nolan, J. M. Lutein, zeaxanthin, and meso-zeaxanthin: The basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease. Progress in Retinal and Eye Research, v. 50, p. 34-66, 2016.
BHOSALE, P. Environmental and cultural stimulants in the production of carotenoids from microrganism. Applied Microbiogy and Biotechnology, v. 63, p. 351-361, 2004.
CALDEIRA, J. P. R. A. Production of lipids (for biodiesel) and carotenoids from the yeast Rhodotorula glutinis grown in a bench reactor, in a fed-batch system. Dissertação de Mestrado de Microbiologia Aplicada, Universidade de Lisboa, 2015.
CARDOSO, L. A. C.; JACKEL, S.; KARP, S. G.; FRAMBOISIER, X.; CHEVALOT, I.; MARC, I. Improvement of Sporobolomyces ruberrimus carotenoids production by the use of raw glycerol. Bioresource Technology, v. 200, p. 374-379, 2016.
COLET, R.; DI LUCCIO, M.; VALDUGA, E. Fed-batch production of carotenoids by Sporidiobolus salmonicolor (CBS 2636): kinetic and stoichiometric parameters. European Food Research & Technology, v. 240, p. 173-182, 2015.
COLET, R.; URNAU, L.; BAMPI, J.; ZENI, J.; DIAS, B. B.; RODRIGUES, E.; JACQUES, R. A.; DI LUCCIO, M.; VALDUGA, E. . Use of low-cost agro products as substrate in semi-continuous process to obtain carotenoids by Sporidiobolus salmonicolor. Biocatalysis and agricultural biotechnology, v. 11, p. 268-274, 2017.
DIAS, C.; SOUSA, S.; CALDEIRA, J.; REIS, A.; SILVA, T. L. New dual-stage pH control fed-batch cultivation strategy for the improvement of lipids and carotenoids production by the red yeast Rhodosporidium toruloides NCYC 921. Bioresource Technology, v. 189, p. 309-318, 2015.
DAVIES, B. H; Carotenoid. In: Goodwin, T. W. (ed.), Chemistry and Biochemistry of Plants and Pigments, p. 138-165, Academic Press, New York, 1976.
ESTEBAN, R.; MORANA, J. F.; BECERRILB, J. M.; GARCÍA-PLAZAOLA, J. I. Versatility of carotenoids: An integrated view on diversity, evolution, functional roles and environmental interactions. Environmental and Experimental Botany, v. 119, p. 63-75, 2015.
FÁBREGAS, J.; OTERO, A.; MASEDA, A.; DOMÍNGUEZ, A. Two-stage cultures for production of astaxanthin from Haematococcus pluvialis. Journal of Biotechnology, v. 89, p. 65-71, 2001.
FERREYRA, M. M.; SCHVAB, M. C.; DAVIES, C. V.; GERARD, L. M.; SOLDA, C. A. Obtención de vinagre de naranja en proceso semicontinuo, a escala laboratório. Ciencia, Docencia y Tecnología, v. 25, n. 49, p. 154-165, 2014.
FONTANA, J. D.; CZECZUGA, B.; BONFIM, T. M. B.; CHOCIAI, M. B.; OLIVEIRA, B. H.; GUIMARÃES, M. F.; BARON, M. Bioproduction of carotenoids: the comparative use of raw sugarcane juice and depolymerized bagasse by Phaffia Rhodozyma. Bioresource Technology, v. 58, p. 121-125, 1996.
FRENGOVA, G.; SIMOVA E.; PAVLOVA, K.; BESHKOVA, D. Formation of carotenoids by Rhodotorula glutinis in whey ultrafiltrate. Biotechnology and Bioengineering, v. 44, p. 888-894, 1994.
KRINSKY, N. I.; JOHNSON, E. J. Carotenoid actions and their relation to health and disease. Molecular Aspects of Medicine, v. 26, p. 459-516, 2005.
MACHADO, W. R. C.; BURKERT, J. F. M. Produção de carotenoides microbianos pela levedura Sporidiobolus pararoseus utilizando coprodutos. Revista de Engenharia e Tecnologia, v. 6, n. 2, p. 59-69, 2014.
MANOWATTANA, A.; TECHAPUN, C.; WATANABE, M.; CHAYASO, T. Bioconversion of biodiesel-derived crude glycerol into lipids and carotenoids by an oleaginous red yeast Sporidiobolus pararoseus KM281507 in an airlift bioreactor. Journal of Bioscience and Bioengineering, v. 125, p. 59-66, 2018.
OTERO, A.; DOMÍNGUEZ, A.; LAMELA, T.; GARCÍA, D.; FÁBREGAS, J. Steady-states of semicontinuous cultures of a marine diatom: Effect of saturating nutrient concentrations. Journal of Experimental Marine Biology and Ecology, v. 227, p. 23-34, 1998.
SAENGE, C.; CHEIRSILP, B.; SUKSAROGE, T. T.; BOURTOOM, T. Potential use of oleaginous red yeast Rhodotorula glutinis for the bioconversion of crude glycerol from biodiesel plant to lipids and carotenoids. Process Biochemistry, v. 46, p. 210–218, 2011.
SCHMIDELL, W.; SOARES, H. M.; ETCHEBEHERE, C.; MENES, R.J.; BERTOLA, N. C.; CONTREAS, E. M. Tratamento Biológico de Águas Residuárias. Florianópolis: Ed. Tribo da Ilha, 2007.
SILVA, M. C. Alterações na biossíntese de carotenóides em leveduras induzidas por agentes químicos. Tese de Doutorado em Ciência de Alimentos– Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas (Unicamp), Campinas, 2004.
SONG, J.; LI, D.; HE, M.; CHEN, J.; LIU, C. Comparison of Carotenoid Composition in Immature and Mature Grains of Corn (Zea Mays L.) Varieties. International Journal of Food Properties, v.19, n. 2, p. 351-358, 2016.
TSAI, H.; CHUANG, L.; CHEN, C. N. Production of long chain omega-3 fatty acids and carotenoids in tropical areas by a new heat-tolerant microalga Tetraselmis sp. DS3. Food Chemistry, v. 192, p. 682-690, 2016.
URNAU, L.; COLET, R. ; SOARES, V. F.; FRANCESCHI, E.; VALDUGA, E.; STEFFENS, C. Extraction of carotenoids from Xanthophyllomyces dendrorhous using ultrasound-assisted and chemical cell disruption methods. Canadian journal of chemical engineering, v. 96, p. 1377-1381, 2018.
VALDUGA, E.; VALERIO, A.; TREICHEL, H.; DI LUCCIO, M.; FURIGO JÚNIOR, A. Study of the bio-production of carotenoids by Sporidiobolus salmonicolor (CBS 2636) using pre-treated agro-industrial substrates. Journal of Chemical Technology and Biotechnology, v. 83, p. 1267-1274, 2008.
VALDUGA, E.; RIBEIRO, A. H. R.; CENCE, K.; COLET, R.; TIGGEMANN, L.; ZENI, J.; TONIAZZO, G. Carotenoids production from a newly isolated Sporidiobolus pararoseus strain using agroindustrial substrates. Biocatalysis and Agricultural Biotechnology, v. 3, p. 207-213, 2014.
VENIL, C. K.; ZAKARIA, Z. A.; AHMAD, W. A. Review: Bacterial pigments and their applications. Process Biochemical, v. 48, p. 1065–1079, 2013.
Wu, J.; Cho, E.; Willett, W. C.; Sastry, S. M.; Schaumberg, D.A. Intakes of Lutein, Zeaxanthin, and Other Carotenoids and Age-Related Macular Degeneration During 2 Decades of Prospective Follow-up. JAMA Ophthalmology, v. 33, n. 12, p.1415-1424, 2015.









