EFEITO DO pH NA IMOBILIZAÇÃO DE LIPASE EM CARVÃO ATIVADO DE CAROÇO DE TAMARINDO UTILIZANDO ADSORÇÃO E LIGAÇÃO COVALENTE
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Gonçalves, G.R.F. (UESB) ; Gandolfi, O.R.R. (UESB) ; Brito, M.J.P. (UESB) ; Bonomo, R.C.F. (UESB) ; Fontan, R.C.I. (UESB) ; Veloso, C.M. (UESB)
Resumo
Objetivou-se nesse trabalho imobilizar lipase em carvões ativados pelo método de adsorção e de ligação covalente. Foi observado que a modificação química com glutaraldeído causou elevação no ponto de carga zero e redução no teor de grupos funcionais oxigenados e na área superficial do carvão ativado. Posteriormente, foi verificado o efeito do pH (4,0 a 8,0) da solução na capacidade adsortiva e atividade da lipase imobilizada. Os carvões apresentaram maior capacidade de imobilização no pH, embora isso não tenha resultado em maior atividade, visto que, a maior atividade foi obtida em pH 5,0. Os resultados encontrados sugerem que a funcionalização do carvão apresenta-se como uma boa alternativa pelo fato de proporcionar uma ligação mais forte da enzima com o suporte.
Palavras chaves
carvões ativados; lipase; glutaraldeído
Introdução
Os carvões ativados são materiais carbonáceos que apresentam boa estabilidade química, elevada área superficial interna, porosidade altamente desenvolvida, além de apresentar diversos grupos funcionais em sua superfície (BRITO et al., 2017, AHMED et al., 2017). Tais características fazem com que tais adsorventes sejam utilizados em diversas aplicações, como no tratamento de efluentes (KONG et al., 2013), adsorção de biomoléculas (PEREIRA et al., 2014), processos de purificação e separação de biomoléculas (HU; LU; MEISNER, 2008), entre outros. Outra aplicação promissora para os carvões ativados é sua utilização como suporte para a imobilização de enzimas (GIRALDO; MORENO-PIRAJÁN, 2012; BRITO et al., 2017). A utilização de enzimas imobilizadas apresenta diversas vantagens quando comparadas com as enzimas livres. O aumento da estabilidade operacional, a possibilidade de reutilização do biocatalisador, a retenção da atividade catalítica por um maior período de tempo, a possibilidade de conduzir processos em modo contínuo, a facilidade de separação do catalisador e do produto da reação e a interrupção da reação quando se atinge um determinado grau de conversão são algumas das vantagens (BRADY; JORDAAN, 2009; GONÇALVES et al., 2019), garantindo assim uma maior aplicação das enzimas em diversos processos industriais (GANAIE et al., 2014). Entre os métodos de imobilização de enzimas mais utilizados estão a imobilização por adsorção e por ligação covalente (NONGONIERMA; O’KEEFFE; FITZGERALD, 2016). A imobilização por adsorção é um método simples e eficiente para a imobilização de enzimas. Nesse método, a enzima é imobilizada em um suporte sólido por ligações de baixa energia, tais como ligações de hidrogênio, forças de van der Waals, interações eletrostásticas ou interações hidrofóbicas (GONÇALVES et al., 2019). O método apresenta como vantagem o fato de ser simples e barato, além do fato da enzima não necessitar ser pré-tratada ou quimicamente modificada. Além disso, as condições de imobilização são pouco prejudiciais para as enzimas, preservando ao máximo sua atividade catalítica. No entanto, as interações entre a enzima e o suporte são fracas e reversíveis, resultando na fraca estabilidade das enzimas imobilizadas, acarretando em perdas por lixiviação com consequente contaminação do substrato (LIU et al., 2018). Para superar estes inconvenientes, têm-se a técnica de imobilização por formação de ligações covalentes. Nessa técnica, a enzima é ligada ao suporte inerte mediante ligações químicas covalentes, que são, normalmente, estabelecidas entre os grupos amino, grupos amino residuais, grupos sulfidrila e grupo hidroxila do anel fenólico da enzima com os grupos reativos do suporte. Por ser uma ligação mais forte, este tipo de imobilização apresenta certas vantagens quando comparado com o método da adsorção, uma vez que, neste método as perdas das enzimas por lixiviação da matriz são minimizadas, assim como durante os processos de imobilização as condições do meio reacional irão ter pouca influência na eficiência de imobilização (KHOOBI et al., 2014). Para que ocorra a imobilização de moléculas via ligação covalente em carvões ativados é necessário que tais materiais sejam submetidos a processos de funcionalização, visando a inserção de monômeros específicos em sua superfície. Trabalhos recentes vêm demonstrando que a inserção do glutaraldeído tem sido amplamente empregado visando à imobilização de enzimas, podendo acarretar até mesmo em um aumento da atividade do biocatalisador (RAMANI et al., 2012; SANTOS et al., 2019). Dentre as enzimas com potencial de aplicação na forma imobilizada estão as lipases (ANGAJALA et al., 2016). Devido à sua versatilidade, tais enzimas estão entre as mais utilizadas industrialmente (JAVED et al., 2018). Elas são pertencentes à classe das hidrolases, que catalisam a hidrólise de triacilgliceróis insolúveis para gerar ácidos graxos livres, diacilgliceróis, monoacilgliceróis e glicerol (GEOFFRY et al., 2018). As lipases destacam-se pela sua estabilidade às diversas condições operacionais do meio, além de reconhecer uma ampla variedade de substratos (RIOS et al., 2018). Tais características permitem a sua utilização na indústria de alimentos, oleoquímica, farmacêutica, na formulação de detergentes, na síntese de biosurfactantes, no tratamento de efluentes, entre outras (JAVED et al., 2018). Diante do exposto, esse trabalho teve como objetivo avaliar o efeito do pH da solução na imobilização de lipase em carvão ativado de caroço de tamarindo por adsorção e ligação covalente.
Material e métodos
Materiais O caroço de tamarindo obtido a partir de uma agroindústria localizada na região sul da Bahia foi utilizado como precursor de carbono. Lipase comercial de pâncreas de porco (Lipase from porcine pâncreas type II da Sigma) foi utilizada na etapa de imobilização. Todos os reagentes utilizados nas demais etapas possuíam, no mínimo, grau analítico PA-ACS. Preparo e caracterização do material precursor Primeiramente, o caroço de tamarindo foi seco em estufa a 105 °C por 24 h. Após esse período foi triturado em moinho de facas e peneirado até a granulometria de 20 mesh. Em seguida, o farelo foi caracterizado em relação ao teor de cinzas (AOAC, 1995) e lignina, celulose e hemicelulose (VAN SOEST et al., 1991). Síntese do carvão ativado Para síntese do carvão ativado, o farelo do caroço de tamarindo foi impregnado com ácido fosfórico (VETEC 85% P.A.) na razão de impregnação de 3:1 (massa de ativante/massa do precursor) e seco em estufa a 105 °C por 24 h. Após este período o mesmo foi carbonizado na temperatura de 680 °C a uma taxa de aquecimento de 5°C/min, sob fluxo de nitrogênio (50 mL/min), por 2 h. Após a carbonização, os carvões foram lavados com água quente, até a neutralização da água de lavagem. Após a lavagem, o carvão (CAT) foi seco em estufa a 105 °C por 24 h. Funcionalização do carvão ativado O carvão produzido foi funcionalizado utilizando a metodologia descrita por Santos et al. (2019). Ao final dessa etapa, o carvão apresenta uma superfície aldeído ativada, capaz de formar ligações covalentes com moléculas que contenham grupamentos amina em sua estrutura. Essa amostra recebeu o código CFT. Caracterização dos carvões Os carvões CAT e CFT foram caracterizados em relação ao ponto de carga zero (REGALBUTO; ROBLES, 2004), teor de grupos oxigenados totais (BOEHM, 1966) e porosidade e área superficial específica (SANTOS et al., 2019). Efeito do pH na imobilização da lipase A lipase foi imobilizada nos carvões ativados CAT e CFT. A concentração inicial de solução de lipase foi de 15000 mg/L. Os valores de pH inicial das soluções de lipase foram 4,0, 5,0, 6,0, 7,0 e 8,0, onde, para tal, foram utilizados soluções tampão de acetato 0,1 mol/L (acetato de sódio 0,1 mol/L + ácido acético 0,1 mol/L). Os tubos foram mantidos sob agitação constante de 20 rpm, em um agitador orbital, na temperatura de 30 °C, com auxílio de uma BOD, por 2 h. Após esse tempo, os tubos foram centrifugados e o sobrenadante foi filtrado. Para obtenção da capacidade adsortiva, foi feita a quantificação da concentração de proteína no sobrenadante antes e após a imobilização, utilizando o método de Bradford (1976). As atividades da lipase livre e do biocatalisador imobilizado foram determinadas utilizando o método da hidrólise de emulsão do azeite de oliva, conforme descrito por Brito et al. (2017).
Resultado e discussão
Caracterização do material precursor
O farelo do caroço de tamarindo apresentou teores de celulose de
33,31%, hemicelulose de 10,45%, lignina de 33,07% e cinzas de 1,82%. A
relação entre os teores de celulose e lignina é de aproximadamente 1,0. A
composição química dos resíduos tem influência direta no rendimento do
processo e nas características físico-químicas do carvão. Carvões produzidos
a partir de materiais com elevado teor de lignina tendem a apresentar
maiores rendimentos, pois a mesma apresenta maior estabilidade térmica do
que a celulose e hemicelulose (REED; WILLIAMS, 2004). De acordo com Li e
Wang (2008), um baixo teor de cinzas dos precursores pode levar à produção
de carvões ativados com maior área superficial.
Caracterização dos carvões
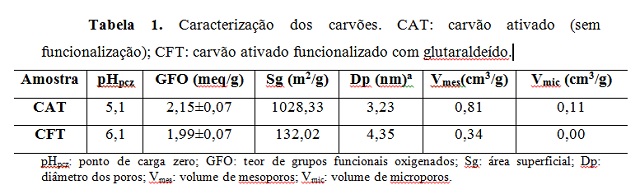
Observam-se na Tabela 1 os resultados da caracterização das amostras
dos carvões produzidos.
Observa-se que após a funcionalização com glutaraldeído ocorreu um aumento
no ponto de carga zero e uma redução no teor de grupos oxigenados. O ponto
de carga zero é definido como o pH em que a superfície do carvão apresenta
uma carga neutra, ou seja, a densidade de cargas elétricas numa superfície é
zero, e foi determinado para os carvões com o objetivo de verificar as
faixas de valores de pH onde as cargas da superfície do carvão variam de
positiva para negativa. Portanto, quando o material entra em contato com uma
solução com pH inferior ao do ponto de carga zero a superfície do carvão é
carregada positivamente, gerando uma maior eficiência adsortiva para remoção
de materiais aniônicos. Quando a solução apresenta valor superior ao do pH
do ponto de carga zero, a superfície é carregada negativamente, adsorvendo
preferencialmente compostos catiônicos (BRITO et al., 2017). O aumento do pH
do ponto de carga zero no CFT provavelmente está relacionado ao fato de o
glutaraldeído possuir caráter alcalino, e ao se ligar com o carvão aumenta a
quantidade de grupos básicos. Tal resultado é corroborado pelo teor de
grupos funcionais oxigenados (GFO), que apresentou redução no seu valor após
a inserção do glutaraldeído.
Ao se analisar os resultados das propriedades texturais dos carvões,
verifica-se que após a funcionalização com glutaraldeído o CFT apresentou
uma redução de cerca de 87% em sua área superficial. Além disso, o CFT
apresentou uma redução no volume de mesoporos quando comparado com o CAT e
ausência do volume de microporos. Após a funcionalização, os microporos e
mesoporos foram obstruídos pelos braços espaçadores da molécula de
glutaraldeído, resultando consequentemente em uma redução na área
superficial. Tais resultados estão em acordo aos encontrados por Santos et
al. 2019 e Ramani et al. (2012), que também observaram redução na área
superficial após a funcionalização com glutaraldeído.
Efeito do pH na imobilização da lipase nos carvões produzidos
O estudo do pH de imobilização de uma proteína em um suporte é
importante, pois tal parâmetro afeta diretamente nas cargas da mesma. A
lipase ácida apresenta ponto isoelétrico (pI) entre pH 4,0 e 5,0 (FERRER et
al., 2000; MAYORDOMO et al., 2000). Se essa enzima é adicionada em solução
com pH acima do pI a sua carga líquida é negativa. De modo oposto, se for
adicionada em solução com pH abaixo desse valor a carga líquida é positiva.
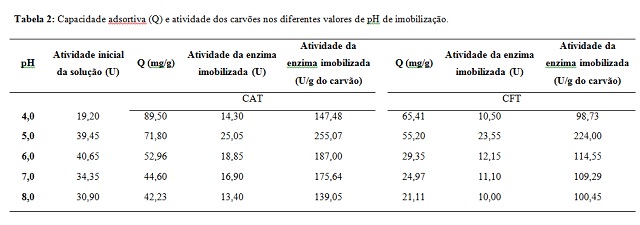
Na Tabela 2 são apresentados os resultados da capacidade adsortiva e
atividade nos diferentes valores de pH, para os dois carvões utilizados.
Para ambos os carvões foi observada uma maior capacidade adsortiva
no pH 4,0, próximo ao pI da proteína e abaixo do ponto de carga zero dos
carvões. À medida que se aumentou o pH da solução de imobilização observou-
se uma redução na capacidade adsortiva. Provavelmente, ao se aumentar o pH a
enzima e o suporte estarão acima do pI e ponto de carga zero,
respectivamente, aumentando a quantidade cargas líquidas superficiais
negativas, ocorrendo assim uma repulsão eletrostática entre os mesmos,
reduzindo a adsorção. Tal comportamento também foi observado por Brito el
al. 2017, ao estudarem a imobilização da lipase obtida a partir da mesma
fonte em carvões ativados. Observa-se que o CAT apresentou maiores valores
para capacidade adsortiva em todas as condições experimentais testadas.
Provavelmente, a maior área superficial do mesmo contribuiu para a maior
quantidade de enzima adsorvida.
A enzima livre apresentou maior valor de atividade no pH 6,0. Já
para os carvões ativados CAT e CFT, apesar da capacidade adsortiva ser
superior em pH 4,0, a atividade foi maior em pH 5,0. Verifica-se, portanto,
que uma maior adsorção não necessariamente resulta em uma maior atividade do
biocatalisador. Além disso, observa-se uma mudança no pH ótimo da enzima
imobilizada, quando comparada com a enzima livre. Esses resultados indicam
a ocorrência de possíveis mudanças conformacionais na estrutura da enzima,
ou alterações de concentração entre espécies carregadas, substrato, produto,
íons hidrogênio e íons hidroxila, tanto no microambiente da enzima
imobilizada, quanto no meio reacional. Alteração no pH ótimo após a
imobilização de lipases também foram obtidas por outros pesquisadores
(ARIELA et al., 2008; BRITO et al., 2017). O carvão modificado com
glutaraldeído apresentou atividade inferior um pouco inferior à do carvão
não funcionalizado em todos valores de pH estudados. Apesar disso, ele
apresenta-se com uma boa alternativa para imobilização de lipases pelo fato
de ter apresentado atividade e de as interações entre a enzima e o suporte
ocorrerem preferencialmente por ligações covalentes, que são mais fortes,
evitando assim a perda de enzima por lixiviação durante o processo de
catálise, e permitindo, possivelmente, uma maior reutilização do
biocatalisador por vários ciclos.
Conclusões
Foi produzido carvão ativado a partir do farelo do caroço de tamarindo. Esse carvão foi posteriormente modificado pela inserção do glutaraldeído. Os carvões produzidos foram caracterizados em relação ao ponto de carga zero, teor de grupos funcionais oxigenados e propriedades texturais. Foi observado que a funcionalização do carvão com glutaraldeído aumentou o ponto de carga zero do mesmo, pelo fato desse monômero apresentar caráter alcalino. Tal fato foi corroborado pela medida do teor de grupos funcionais oxigenados, que apresentou uma redução no seu valor após a funcionalização. A partir das análises das propriedades texturais, foi verificado que a inserção do monômero causou uma redução no volume de microporos e mesoporos do carvão, com consequente redução da área superficial. Posteriormente, foi verificado o efeito do pH na imobilização e atividade da lipase nos carvões com e sem glutaraldeído. Foi verificado que o carvão sem glutaraldeído apresentou maior capacidade adsortiva e atividade em todas as condições experimentais testadas. Foi observado também, que para ambos os carvões o aumento do pH acarretou em uma redução na capacidade adsortiva da enzima. Porém, a maior adsorção não levou, necessariamente, a uma maior atividade da enzima imobilizada. Além disso, a imobilização da enzima promoveu uma alteração do pH ótimo da atividade. O carvão modificado quimicamente com glutaraldeído apresentou menor atividade que o não modificado em todos os valores de pH testados. Apesar disso, a funcionalização apresenta-se com uma alternativa pelo fato de apresentar uma ligação mais forte entre a enzima e o suporte, permitindo sua utilização no processo de catálise de reações por vários ciclos.
Agradecimentos
À FAPESB pelo auxílio financeiro.
Referências
AHMED, M. J. Adsorption of quinolone, tetracycline, and penicillin antibiotics from aqueous solution using activated carbons: Review. Environmental Toxicology and Pharmacology, v. 50, p. 1-10, 2017.
ANGAJALA, G,; PAVAN, P.; SUBASHINI, R. Lipases: An overview of its current challenges and prospectives in the revolution of biocatalysis. Biocatalysis and Agricultural Biotechnology, v. 7, 257-270, 2016.
ARIELA, V.P.; MOREIRA, A.B.R..; BRAGA, L.P.; CASTRO, H.F.; BRUNO, LAURA M. Comparative performance of Candida rugosa lipase immobilized on polysiloxane polyvinyl alcohol hybrid support using different methodologies. Química Nova, v.31, 2008.
BOEHM, H. P. Chemical identification of surface groups, in: ELEY, D. D.; PINES, H.; WEISZ, P. B. (Eds.), Advances in Catalysis, Academic Press,NewYork, v. 16, p. 179, 1966.
BRADFORD, M. M. A. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, v. 72, p. 248-254, 1976.
BRADY, D.; JORDAAN, J. Advances in enzyme immobilisation. Biotechnology Letters, v. 31, p. 1639-1650, 2009.
BRITO, M. J. P.; VELOSO, C. M.; BONOMO, R. C. F.; FONTAN, R. C. I.; SANTOS, L. S.; MONTEIRO, K. A. Activated carbons preparation from yellow mombin fruit stones for lipase immobilization. Fuel Processing Technology, v. 156, p. 421-428, 2017.
FERRER, M.; PLOU, F. J.; NUERO, O. M.; REYES, F.; BALLESTEROS, A.; Purification and properties of a lipase from Penicillium chrysogenumisolated from industrial wastes. J. Chem. Technol. Biotechnol.v.75, 569-576, 2000.
GANAIE, M. A.; RAWATB, H. K.; WANIA, O. A.; GUPTA, U. S.; KANGO, N. Immobilization of fructosyltransferase by chitosan and alginate for efficient production of fructooligosaccharides. Process Biochemistry, v. 49, p. 840-844, 2014.
GEOFFRY, K.; ACHUR, R. N. Screening and production of lipase from fungal organisms. Biocatalysis and Agricultural Biotechnology, 2018. https://doi.org/10.1016/j.bcab.2018.03.009.
GIRALDO, L.; MORENO-PIRAJÁN, J.C. Lipase supported on mesoporous materials as a catalyst in the synthesis of biodiesel from Persea americana mill oil. Journal of Molecular Catalysis B: Enzymatic, v.77, p.32– 38, 2012.
HU, Q.; LU, Y.; MEISNER, G.P. Preparation of nanoporous carbon particles and their cryogenic hydrogen storage capacities. The Journal of Physical Chemistry C, v. 12, p. 1516-1523, 2008.
JAVED, S.; AZEEM, F.; HUSSAIN, S.; RASUL; I.; SIDDIQUE, M. H.; RIAZ, M.; AFZAL, M.; KOUSER, A.; NADEEM, H. Bacterial lipases: A review on purification and characterization. Progress in Biophysics and Molecular Biology, v. 132, p. 23-34, 2018.
KHOOBI, M.; MOTEVALIZADEH, S.F.; ASADGOL, Z.; FOROOTANFAR, H.; SHAFIEE, H.; FARAMARZI, M.A. Synthesis of functionalized polyethylenimine-grafted mesoporous silica spheres and the effect of side arms on lipase immobilization and application. Biochemical Engineering Journal, v.88, p.131–141, 2014.
KONG, J.; YUE, Q.; WANG, B.; HUANG, L.; GAO, B.; WANG, Y.; LI, Q. Preparation and characterization of activated carbon from leather waste microwave-induced pyrophosphoric acid activation. Journal of Analytical and Applied Pyrolysis. v. 104, p. 710-713, 2013.
LI, T.; WANG, T. Preparation of silica aerogel from rice hull ash by drying at atmospheric pressure. Materials Chemistry and Physics, v.112, p. 398-401, 2008.
LIU, D. M.; CHEN, J.; SHI, Y. P. Advances on methods and easy separated support materials for enzymes immobilization. Trends in Analytical Chemistry, v. 102, p. 332-342, 2018.
MAYORDOMO, I.; RANDEZ, G. F.; PRIETO, J. A. Isolation, purification, and characterization of a cold-active lipase from Aspergillus nidulans. J. Agric. Food Chem., v.48, 105-109, 2000.
NONGONIERMA, A.B., O’KEEFFE, M.B., FITZGERALD, R.J. Milk protein hydrolysates and bioactive peptides. In: Sweeney MC, O’Mahony JA, editors. Advanced dairy chemistry 1b: proteins. 4th ed. New York (NY): Springer. p. 417–482, 2016.
PEREIRA, R. G., VELOSO, C. M., DA SILVA, N. M., DE SOUSA, L. F., BONOMO, R. C. F., DE SOUZA, A. O., DA GUARDA, M. O; FONTAN, R. D. C. I. Preparation of activated carbons from cocoa shells and siriguela seeds using H3PO4 and ZnCL as activating agents for BSA and α-lactalbumin adsorption. Fuel Processing Technology, v. 126, p. 476-486. 2014.
RAMANI, K.; KARTHIKEYAN, S.; BOOPATHY, R.; KENNEDY, L.; MANDAL, A.B.; SEKARAN, G. Mesoporous activated carbon surface functionalized for the immobilization of lipase and its application acidic hydrolysis waste oil prepared: Isotherm and kinetic studies. Process Biochemistry, v.47, p.435-445, 2012.
REED, A. R.; WILLIAMS, P. T. Thermal processing of biomass natural fibre wastes by pyrolysis. International Journal of Energy Research, v. 28, p. 131-145, 2004.
REGALBUTO, J. R.; ROBLES, J. The engineering of Pt/Carbon Catalyst Preparation, University of Illinois: Chicago, 2004.
RIOS, S. N.; PINHEIRO, B. B.; PINHEIRO, M. P.; BEZERRA, R. M.; SANTOS, J. C. S.; GONÇALVES, L. R. B. Biotechnological potential of lipases from Pseudomonas: Sources, properties and applications. Process Biochemistry, v. 75, p. 99-120, 2018.
SANTOS, MATEUS P. F.; BRITO, MYLENA J. P. ; JUNIOR, EVALDO C. S. ; BONOMO, RENATA C. F. ; VELOSO, CRISTIANE M. . Pepsin immobilization on biochar by adsorption and covalent binding and its application for hydrolysis of bovine casein. Journal Of Chemical Technology and Biotechnology, v. 94, p. 1982-1990, 2019.









