Estabilidade de emulsões à base de alginato de sódio e óleo de pequi.
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Castelo, R.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; da Silva, L.C. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Alexandre, J.B. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; de Menezes, F.L. (UNIVERSIDADE FEDERAL DO CEARÁ) ; de Souza, A.C.R. (EMBRAPA AGROINDÚSTRIA TROPICAL) ; Furtado, R.F. (EMBRAPA AGROINDÚSTRIA TROPICAL)
Resumo
Wittm. (Pequi), espécie típica no nordeste brasileiro, possui importância socioeconômica e aceitabilidade de seus frutos na culinária regional e na farmacopéia brasileira. Emulsão de óleo de pequi é a base para o desenvolvimento de várias tecnologias derivadas de método de encapsulamento, formulação de filmes e revestimento, por exemplo. O presente trabalho visa à análise da estabilidade de emulsões à base de alginato de sódio e óleo de Pequi usando os tensoativos Span/Tween 80 e Span/Tween 20 em diferentes composições de HLB. Os resultados indicam que emulsões com tensoativos apresentaram um tempo maior de estabilidade quando comparadas a emulsão controle sem a presença destes. As variações de balanço hidrofílico- lipofílico sugerem que a emulsão com HLB 10,2 é a mais estável.
Palavras chaves
Alginato; Caryocar coriaceum ; HLB
Introdução
O pequizeiro é uma planta típica do cerrado brasileiro, pertencente à família Caryocaraceae. Esta se distribui por muitos estados do Brasil, apresentando- se em 12 espécies, sendo a de maior distribuição pelo país a Camb. Especificamente no nordeste Brasileiro é encontrada a espécie Wittm. a qual desempenha um importante papel socioeconômico nos Estados do Ceará, Pernambuco e Piauí (OLIVEIRA et al., 2008). O óleo extraído da polpa do Pequi é utilizado para os mais diversos tratamentos na cultura popular: asma, tosse, inchaço no joelho, gripe, reumatismo, expectorante, inflamação da garganta, sopro, febre, queimaduras, indigestão e dor no corpo (RIBEIRO et al, 2014), sendo utilizado tanto por ingestão oral ou aplicação em locais afetados. Por este motivo, o óleo de pequi tem ganhado destaque em pesquisas para investigação do seu potencial e possíveis aplicabilidades em formulações farmacêuticas, sendo o encapsulamento uma medida eficaz para a proteção do óleo. O material encapsulante mais empregado é o alginato de sódio (poliânion), que em contato com o cálcio (cátion bivalente), forma uma membrana pouco solúvel em água, porém permeável. É um biopolímero encontrado na parede celular de algas pardas, presentes em muitas regiões costeiras (MAFRA JR.; CUNHA, 2010). Esse polissacarídeo é utilizado na produção de sorvetes, produtos lácteos, misturas para bolos, sucos de frutas, entre outros (MÜLLER; DOS SANTOS; BRIGIDO, 2011), e na indústria farmacêutica podem ser encontrados em cosméticos, nutracêuticos e medicamentos (SELLIMI et al., 2015). A microencapsulação é definida como um método de empacotamento de um ingrediente ativo (sólido, líquido ou gasoso) dentro de um material de revestimento, a fim de ser protegido contra diversos fatores tais como luz, elevada concentração de oxigênio, calor e umidade, evitando a evaporação de compostos voláteis, mascarando sabores e odores desagradáveis, garantindo uma liberação controlada, além de permitir o desenvolvimento de produtos de alto valor agregado (COMUNIAN; FAVARO-TRINDADE, 2016). A formação de uma emulsão estável entre o material de parede e o material a ser encapsulado, garante uma maior eficiência do processo. Emulsões são fluidos coloidais que consistem de líquidos imiscíveis dispersos um no outro na forma de pequenas gotículas formadas por um processo de homogeneização, sendo que as gotas formadas no processo podem assumir diâmetros que variam entre 100 nm a 100 µm. Além do tamanho, as emulsões podem ser convenientemente classificadas de acordo com a distribuição espacial relativa das fases de óleo e água. Emulsões são classificadas como sistemas termodinamicamente instáveis, pois tendem a retornar para o estado estável com o tempo, resultando em duas ou mais fases líquidas separadas (BUTT; GRAF; KAPPL, 2003). A velocidade com que o mecanismo de separação da emulsão ocorre, depende da sua composição, do método de preparação, e de suas condições de armazenamento (por exemplo, variações de temperatura e agitação mecânica). A desestabilização de uma emulsão promove mudanças consideráveis em sua aparência, consistência, redispersibilidade e no seu desempenho como produto. Pode apresentar-se sob vários mecanismos, tais como: cremeação, sedimentação, floculação ou coalescência, sendo que os dois primeiros são decorrentes da migração das gotas e os últimos ocorrem devido à variação do tamanho das gotas dispersas no sistema. Os processos de desestabilização de emulsões podem ser minimizados com o uso de emulsionantes. O termo “emulsionante” refere-se a determinadas substâncias tensoativas capazes de se adsorver na interface óleo-água, impedindo que a gotas dispersas sofram processos indesejáveis de cremeacão, sedimentação, floculação e coalescência (MCCLEMENTS, 2016). O sistema HLB (Balanço Hidrofílico-Lipofílico) é um método semiempírico usado rotineiramente para a classificação de tensoativos.Esse sistema foi introduzido por Griffinem 1942, que propôs uma escala numérica adimensional de valores que variam de 1 até 20, para descrever a natureza do agente tensoativo, sendo que os valores de HLB aumentam a medida que a substância se torna mais hidrofílica (MCCLEMENTS, 2016). Esse balanço é uma propriedade importante no processo de emulsificação, pois o mesmo determina o tipo da emulsão que pode ser formada. Dessa forma, agentes emulsificantes com HLB<9 (lipofílico), tendem a formar emulsões do tipo água/óleo (W/O), ao passo que àqueles com valores de HLB>11 (hidrofílico), tendem a formar emulsões do tipo óleo/água (O/W) (AMERICAS, 1980). Em sistemas emulsionados, a utilização de misturas de tensoativos com proporções hidrofílicas e lipofílicas diferentes garantem uma maior estabilidade da dispersão (MCCLEMENTS, 2015). O objetivo deste trabalho foi avaliar a estabilidade de emulsões preparadas com alginato e óleo de Pequi (Caryocar coriaceum) e tensoativos não iônicos em diferentes composições a partir do balanço hidrofílico-lipofílico (HLB).
Material e métodos
Água destilada foi utilizada no preparo de todas as soluções. Pequi foi comprado em Barbalha-Ce, diretamente de produtores rurais. Alginato de sódio de média viscosidade com grau de pureza de 90%, foi adquirido pela Dinâmica®.Os agentes emulsificantes Span 80 e Tween 80 (SIGMA®), Span 20 e Tween 20(SIGMA ®) foram utilizados sem prévia purificação. Óleo de pequi foi extraído da polpa do fruto de Pequi pelo método de extração a frio. A polpa foi submetida a um leve aquecimento (≤ 45ºC) em fogão industrial. Para extração do óleo, a polpa foi submetida a agitação 4500rpm, em centrífuga Thermo Cientific, modelo Heraus Megafuge 40, durante 15min. Utilizou-se o método de inversão das fases na preparação das emulsões segundo a metodologia descrita por PERAZZO . (2015) com adaptações. Sendo o processo dividido em duas etapas: (1) preparo da fase aquosa (2) preparo da fase oleosa e homogeneização das emulsões, como segue: (1) A fase aquosa foi preparada, inicialmente, pela mistura de 1,2 g de alginato de sódio com 100 mL de água destilada em um bécker de 250 mL. A mistura foi levada à agitação em chapa magnética (RH Basic 1, IKA®) por 24 horas à temperatura ambiente (~25ºC), até a completa homogeneização, sendo que, ao final deste período, a dispersão obtida foi homogeneizada pela agitação no rotor-estator Ultra-Turrax® (T-25 digital, IKA®), operando a 12.000 rpm, por 2 minutos, juntamente com o tensoativo Tween 80 ou Tween 20 em diferentes composições e sonicação no ultrasom de sonda (UP400S, Hielscher), operando em ciclo 1 e 40% de amplitude, durante 1min30s.(2) A fase oleosa foi preparada pela mistura do óleo de pequi com os tensoativos Span 80 ou Span 20 em diferentes composições, então, a fase aquosa foi vertida lentamente sobre a oleosa. Ao final, a mistura foi levada ao homogeneizador rotor-estator Ultra-Turrax®, sendo agitada à 12.000 rpm por 5 minutos. As emulsões, então preparadas, foram transferidas para provetas de 25 mL, envasadas e acondicionadas à temperatura ambiente. Uma emulsão teste (óleo de pequi+alginato) foi preparada utilizando o mesmo procedimento descrito anteriormente, mas sem a adição de tensoativos. As análises de estabilidade das emulsões foram realizadas 24 horas e 7 dias após o seu preparo. A determinação da quantidade dos tensoativos Tween 80 e Span 80 na emulsão foi calculada pela seguinte equação (AMERICAS, 1980): %A= 100 (
Resultado e discussão
As emulsões foram preparadas considerando o HLB do óleo de Pequi, sendo o
HLB do óleo estabelecido entre 10,5 e 11,75 (ALVARES, 2016). A formação das
emulsões com diferentes valores de HLB foram observadas após 24 horas e 7
dias de preparo das emulsões. Pode ser observada a partir da Figura 1, a
formação de emulsões nas formulações A, C e D com valores intermediários de
HLB (Tabela 1), apresentando uma coloração amarelada, não sendo perceptível
uma desestabilização. Nas demais dispersões B, E e F, em 24h, ocorreu nítida
separação de fases em decorrência do processo de coalescência. Após 7 dias
todas as emulsões apresentaram desestabilização.
O potencial zeta pode ser positivo ou negativo em polaridade, dependendo das
particularidades químicas dos componentes da formulação, sendo o potencial
elétrico criado pela presença de uma carga na superfície de gotícula. Desta
forma, o potencial zeta é um indicador do grau de repulsão entre as
gotículas carregadas de forma semelhante, observando que forças repulsivas
tendem a impedir a agregação das gotículas durante o armazenamento. Assim, o
valor de potencial zeta é utilizado em módulo, como um importante indicativo
de provável estabilidade física de formulação (SHAH ., 2014). Segundo
a literatura, os sistemas são considerados estáveis quando possuem um valor
absoluto maior que 25 mV. Conforme tabela 2, as medidas de potencial zeta
das emulsões formuladas com óleo de pequi e alginato após 24h e 7 dias de
preparo das emulsões, apresentaram respectivamente média entre 45,93 ±0,47 a
71,53 ± e, 51,43 ± 045 a 75,77± 1,32, respectivamente, com exceção da
emulsão com HLB 11,2 após 7 dias. Os valores de turbidez calculados para os
períodos de 24 horas e 7 dias encontram-se na Tabela 2. A turbidez
apresentou um aumento crescente em seus valores na emulsão com HLB 10,2
(Tween e Span 80), tal resultado corrobora com os valores de tamanho de
partícula (Tabela 2) dessa emulsão que aumentou durante os 7 dias, sendo um
possível indício de agregação de partículas. A emulsão a partir da
concentração HLB 9,1, mante-se aproximadamente com o mesmo valor de turbidez
apresentando uma diminuição no tamanho de partícula, enquanto as demais
tiveram queda significativa nos valores de turbidez. A diminuição da
turbidez ao longo do tempo é indicativo do aumento do tamanho das partículas
na fase “emulsão” ou diminuição da concentração de gotículas de óleo na
emulsão, significando, assim, a desestabilização da emulsão com o decorrer
do tempo. Dessa forma, faz-se necessário confrontar as interpretações do
ensaio de turbidez com demais técnicas de caracterização, sendo a análise da
viscosidade e tamanho de partícula, fundamentais para corroborar os
resultados até então apresentados.
Todas as emulsões analisadas neste trabalho, decorrido os 7 dias, com
exceção da amostra Controle, após leve agitação, estabelecem visualmente
estabilidade homogênea semelhante ao estado de inicial 24h. Este
comportamento está condizente com os resultados da tabela 2, onde as
viscosidades das emulsões mantiveram-se sem alterações significativas entre
o período de 24h e 7 dias. As emulsões preparadas com tensoativos
apresentaram menores valores de viscosidade, tal fato pode ser explicado
pois os surfactantes diminuem a tensão superficial de uma solução deixando a
emulsão mais fluida.
A Tabela 3 apresenta a distribuição dos tamanhos médios das partículas das
emulsões. As amostras apresentaram um comportamento bimodal/ unimodal, assim
os diâmetros foram calculados de acordo com as médias dos picos. Dentre os
sistemas analisados o que apresentou menor tamanho de partícula após 24h,
foi HLB 10,2 (Pico 1 – 900,15 nm e Pico - 2 118,20 nm), apresentando
comportamento bimodal. Após sete dias, todos os sistemas emulsionados
apresentaram um aumento no tamanho de partícula, indício que possivelmente
as partículas estão se agregando

Tabela 1 - Valores de HLB para emulsões alginato de sódio e óleo de Pequi e Figura 1 - Emulsões (24h e 7 dias).
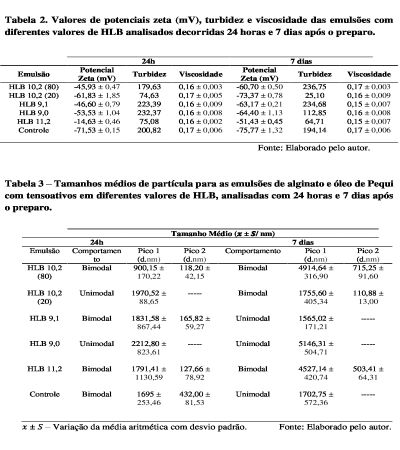
Tabela 2. Valores de potencial zeta, turbidez e viscosidade e Tabela 3. Tamanho médio de partículas das emulsões.
Conclusões
A avaliação da estabilidade das emulsões preparadas com alginato, óleo de Pequi (Caryocar coriaceum Wittm.), e os tensoativos não iônicos Tween 80/ Span 80 e Tween 20/ Span 20 em diferentes composições, definidas a partir do balanço hidrofílico-lipofílico (HLB) apresentou diferentes resultados quanto ao estudo de sistemas emulsionados. Análise da estabilidade das emulsões no período de 24h e 7 dias, sugere que a emulsão com HLB 10,2 (Tween e Span 80) é a mais estável. Emulsões mais estáveis favorecem vários processos em escala industrial, inclusive para substâncias que podem ser encapsuladas. O alginato funcionou como um meio favorável para o preparo de emulsões O/A, todas as concentrações de HLB formaram soluções estáveis inicialmente, sendo que, aquelas que em sua composição possuem o valor mais aproximado do valor do HLB do óleo de pequi, demonstrado um tempo maior de estabilidade.
Agradecimentos
Referências
ACHARYA, D. P.; HARTLEY, P. G. Progress in microemulsion characterization. Current Opinion in Colloid and Interface Science, v. 17, n. 5, p. 274–280, 2012.
ALVARES, G. L. M. Sistema Microemulsionado usando óleo de pequi (Caryocar coriaceum Wittm) para uso tópico anti-inflamatório. [s.l.] Universidade Estadual da Paraíba, 2016.
BUTT, H. J.; GRAF, K.; KAPPL, M. Physics and Chemistry of Interfaces; Wiley, p. 26, 2003.
AMERICAS, I. The HlB System. Society, v. 37, n. 10, p. 1390–3, 1980.
COMUNIAN, T. A.; FAVARO-TRINDADE, C. S. Microencapsulation using biopolymers as an alternative to produce food enhanced with phytosterols and omega-3 fatty acids: A review. Food Hydrocolloids, v. 61, p. 442–457, 2016.
FLORENCE, A. T.; ATTWOOD, D. Princípios físicos químicos em Farmácia. Ed. EDUSP, p. 329, 2003.
LIEBERMAN, H.A.; RIEGER, M.M.; BANKER, G.S. Pharmaceutical dosage forms: disperse systems, New York: Marcel Dekker, v.2, p. 47, 1989.
MCCLEMENTS, D, J. Food Emulsions: Principles, Practices, and Techniques, Ed. CRC PRESS, Third Edition, 2016.
MAFRA JR., L. L.; CUNHA, S. R. BANCOS DE Sargassum cymosum (PHAEOPHYCEAE) NA ENSEADA DE ARMAÇÃO DO ITAPOCOROY, PENHA, SC: BIOMASSA E RENDIMENTO EM ALGINATO. Brazilian Journal of Aquatic Science and Technology, v. 6, n. 1, p. 111, 2010.
MÜLLER, J. M.; DOS SANTOS, R. L.; BRIGIDO, R. V. Produção de alginato por microrganismos. Polimeros, v. 21, n. 4, p. 305–310, 2011.
OLIVEIRA, M. E. B. DE et al. Aspetos Agronômicos e de Qualidade do Pequi. Embrapa, v. 113, p. 33, 2008.
PERAZZO, A.; PREZIOSI, V.; GUIDO, S. Phase inversion emulsification: Current understanding and applications. Advances in Colloid and Interface Science, v. 222, p. 581–599, 2015.
RIBEIRO, D. A. et al. Promising medicinal plants for bioprospection in a Cerrado area of Chapada do Araripe, Northeastern Brazil. Journal of Ethnopharmacology, v. 155, n. 3, p. 1522–1533, 2014.
ROLAND, I. et al. Systematic characterization of oil-in-water emulsions for formulation design. International Journal of Pharmaceutics, v. 263, n. 1–2, p. 85–94, 2003.
SELLIMI, S. et al. Structural, physicochemical and antioxidant properties of sodium alginate isolated from a Tunisian brown seaweed. International Journal of Biological Macromolecules, v. 72, p. 1358–1367, 2015.
SHAH, R. et al. Optimisation and stability assessment of solid lipid nanoparticles using particle size and zeta potential. Journal of Physical Science, v. 25, n. 1, p. 59–75, 2014.









