Imobilização de Z. mobilis e complexo enzimático glicose-frutose oxidorredutase/glucono-δ-lactonase em espuma de poliuretano flexível
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
de Souza, R.C. (URI - ERECHIM) ; da Silva, L.M. (URI - ERECHIM) ; Menegotto, A.L.L. (URI - ERECHIM) ; de Oliveira, K. (URI - ERECHIM) ; Valduga, E. (URI - ERECHIM) ; Malvessi, E. (UCS - CAXIAS DO SUL) ; Zeni, J. (URI - ERECHIM)
Resumo
O complexo enzimático glicose-frutose oxidorredutase (GFOR) e glucono-δ- lactonase (GL) de Zymomonas mobilis apresenta destaque na bioprodução de importantes ácidos aldônicos. E para isto, a imobilização celular recebe notoriedade. O objetivo deste estudo foi imobilizar in situ a Z. mobilis contendo GFOR/GL em espuma de poliuretano flexível. A bactéria e seu complexo enzimático, após produzido foi imobilizado em concentrações crescentes de biomassa e tiveram suas atividades enzimáticas determinadas, sendo o imobilizado caracterizado por microscopia eletrônica de varredura (MEV). Foi comprovada a imobilização na espuma por MEV, embora com inferior atividade enzimática (rendimento de imobilização máximo de 24,58%) e com influência na resistência mecânica da espuma.
Palavras chaves
[i]Zymomonas mobilis[/i]; Espuma poliuretano; Imobilização
Introdução
A Zymomonas mobilis (Z. mobilis) é uma bactéria Gram- negativa,não patogênica para seres humanos e encontrada no meio ambiente, associada a plantas com alto teor de açúcares nas seivas (WANICK et al., 1970; LIMA; SCHUMACHER; ARAÚJO, 1972; SWINGS; DE LEY, 1977; MADIGAN; MARTINKO; PARKER, 2010). Este micro-organismo é quimiorganotrófico, utilizando como fontes de carbono glicose, frutose e sacarose, as quais são metabolizadas, dentre outras reações, pela via de Entner-Doudoroff (GIBBS; DE MOSS, 1954; SWINGS;DE LEY, 1977; VIIKARI, 1984a; DOELLE et al., 1993). No periplasma celular da Z. mobilis encontra-se o complexo enzimático glicose-frutose oxidorredutase (GFOR) e glucono-δ-lactonase (GL), no qual nenhum cofator ou enzima adicional é necessário para a manutenção do sistema e consequente produção dos produtos de interesse (ZACHARIOU, SCOPES, 1986; HARDMAN; SCOPES,1988), recebendo destaque frente as demais enzimas oxidades presentes em outros micro-organismos. É relatado também uma decrescente preferência da enzima GFOR pelos seguintes substratos glicose, maltose, galactose e lactose (MALVESSI et al.,2013). Este complexo enzimático catalisa a oxidação de aldoses, como glicose, maltose e lactose, na presença de frutose, para a formação de ácidos aldônicos e sorbitol. Os ácidos aldônicos, como glucônico, lactobiônico e maltobiônico apresentam propriedades interessantes para a aplicação em distintas áreas, como alimentos, farmacêutica, biomédica, química e têxtil (YUEN, 1974; MIYAKE, SATO; 1975; GERLING, 1998; KIM; KIM, 2002; KOKA et al., 2005; NIELSEN, 2009; BALDWIN et al., 2009; GREEN; BRIDEN, 2009; NIELSEN; HOEIER, 2009; NIELSEN, 2010; OE; KIMURA, 2011; WALTER; BEGLI, 2011; FAERGEMAND; GILLELADEN; QVIST, 2012; GUTIÉRREZ; HAMOUDI; BELKACEMI et al., 2012; ALONSO; RENDUELES; DÍAZ, 2013). As condições de processo, como temperatura, pH, agitação, modo de operação, preparo do biocatalisador e substratos utilizados devem ser avaliados objetivando a otimização do processo, a ampliação de escala e futuras aplicações de produção industrial. Nesta área de estudo, o preparo do biocatalisador (micro-organismo e enzimas) recebe destaque, devido as possibilidades de ampliação de aplicação, através da imobilização celular, visando maior estabilidade, facilidade de separação do meio e possibilidade de reutilização (LIMA et al., 2013). Alguns suportes são relatados na literatura, com destaque para a imobilização com alginato de cálcio (CHUN; ROGERS, 1988; BERTASSO et al., 1996; MALVESSI et al., 2010; FOLLE et al., 2018), carragena (REHR; WILHEM; SAHM et al., 1991; JANG et al., 1996), microporos de membrana de fibra oca (FERRAZ; BORGES; ALVES, 2000; MUKHOPADHYAY et al., 2005) e bucha vegetal (VIGNOLI et al., 2006). O estudo da imobilização de Z. mobilis para a produção de ácidos aldônicos é muito limitado, sendo encontrado na literatura especializada apenas um trabalho (KOEHNTOPP et al., 1996). A espuma de poliuretano tem sido utilizada na biotecnologia para imobilização de enzimas e micro-organismos para diversas aplicações, devido a algumas características como baixo custo, não toxicidades, versatilidade, facilidade de preparo, durabilidade, bioestabilidade, poder de sorção, porosidade e controle de poros durante a síntese (GUNCHEVA et al., 2011; GROVER et al., 2016). O objetivo deste estudo foi imobilizar Z. mobilis contendo o complexo enzimático periplasmático glicose-frutose oxidorredutase/glucono-lactona em espuma de poliuretano flexível pela técnica de imobilização in situ.
Material e métodos
Para a produção de biomassa de Z. mobilis e GFOR/GL três etapas serão necessárias: ativação, preparo de inóculo e cultivo para produção de biomassa e enzimas em biorreator, e foram realizados conforme descrito por Malvessi et al., 2006, com adaptações e a 30 °C, pH 6,4 e anaerobiose. Após, o meio fermentado foi recolhido e centrifugado (MPW® Med. Intruments, Polônia), por 10 min a 6000 rpm e foi realizado avaliação de peso seco, por gravimetria, para obter-se as concentrações de trabalhos (g L-1) da biomassa (CARRA, 2012). A imobilização da biomassa e complexo enzimático em espuma de poliuretano flexível foi realizado in situ. Os reagentes A e B para a formação da espuma (Dim Clay, Brasil), possuem na sua composição poliol e isocianato, respectivamente. A técnica foi realizada pela mistura do poliol, da biomassa, concentrada a 210 g L-1 em água destilada estéril, e do surfactante silicone em recipiente plástico. Após homogeneização, o isocianato foi adicionado e homogeneizado, dando início à reação de polimerização, sendo esta realizada na presença de banho de gelo. Após 24 h de cura, a espuma foi fracionada em cubos de 0,5 cm de lado. Para a imobilização in situ foram avaliadas 4 formulações contendo diferentes quantidades (g) de poliol, isocianato, silicone e biomassa: (I) 15; 6; 0,02; 6; (II) 14; 6; 0,02; 8; (III) 14; 6; 0,04; 9; (IV) 14; 6; 0,04; 10. Estas formulações foram obtidas a partir de testes preliminares e o aspecto comparado com a espuma padrão, conforme fabricante. Os cubos das espumas imobilizadas foram tratados com glutaraldeído 0,5% (m/v), com banho do suporte imobilizado, em agitação magnética por 15 min, seguida de duas lavagens em água destilada nas mesmas condições. Após, foram secas em capela (Quimis, Brasil), com fluxo de ar ligado e em contato com papel filtro (J Prolab, Brasil), durante 24 h (FOLLE et al., 2018). Os imobilizados e micro-organismo livre tiveram a atividade enzimática frente ao substrato preferencial (glicose) avaliada, conforme Malvessi et al. (2006), com modificações, sendo realizada com solução equimolar de glicose (0,7 M) e frutose (0,7 M), 200 mL de volume de trabalho, 39 °C, sob agitação magnética, por 1 h. O pH de 6,4 foi mantido com solução NaOH 1 M (livre) e 0,1 M (imobilizada). O rendimento de imobilização determinado, pela razão entre a atividade enzimática de GFOR/GL da Z. mobilis imobilizada pela atividade enzimática de GFOR/GL da bactéria livre e o resultado expresso em percentual (%). Uma unidade de GFOR/GL (U) será definida como a quantidade de enzima capaz de formar 1 mmol de ácido glucônico por hora, sendo a atividade expressa em unidade por grama de células seca (U g-1). A resistência mecânica em meio líquido também foi estudada, através da diferença de massa antes e após o tratamento com glutaraldeído 0,5%. E o imobilizado foi caracterizado por microscopia eletrônica de varredura (MEV)(ZEISS, Alemanha).
Resultado e discussão
Os resultados da atividade enzimática, rendimento de imobilização e perda de
massa dos cubos de espumas de poliuretano imobilizados in situ com
Z. mobilis e GFOR/GL estão apresentados na Figura 1. É possível
observar um aumento na atividade enzimática diretamente proporcional a
quantidade de biomassa imobilizada, e consequentemente de complexo
enzimático, variando de 2,68 a 8,01 U g-1. Porém esses valores
foram inferiores ao observado pelo complexo enzimático GFOR/GL da Z.
mobilis livre, a qual foi de 32,58 U g-1, resultando em
rendimentos de imobilização de 8,23 a 24,58%. O valor de atividade
enzimática livre foi semelhante aos encontrados na literatura especializada
(MALVESSI et al., 2010; MALVESSI et al., 2013; FOLLE et al., 2018). Este
comportamento de redução da atividade enzimática no imobilizado foi
observado também por outros autores (FERRAZ, BORGES, ALVES, 2000; MALVESSI
et al., 2010; CARRA, 2012; FLORES, 2019), podendo ser causados por efeitos
difusionais, com aumento da resistência a transferência de massa imposta
pelo suporte, efeitos conformacionais ou de microambiente (LIMA et al.,
2013). Adicionalmente, sabe-se que a reação química de uma molécula contendo
o grupo isocianato com um poliol é uma reação exotérmica com rápido aumento
da viscosidade do meio reacional (MANO; MENDES, 1999; VILAR, 1999), desta
forma, mesmo utilizando banho de gelo, pode ter ocorrido aumento da
temperatura no meio e inativado, parcialmente, as enzimas. Outro ponto de
vista, é que quando se utiliza o imobilizado uma reduzida quantidade de
célula seca é possível de ser utilizada no meio reacional, resultado da
baixa densidade da espuma e a necessidade de manter o sistema em agitação.
Assim, quando se avalia o micro-organismo livre é utilizado 4 gcélula
seca L-1 de meio reacional e quando se avalia o imobilizado
uma variação de 0,83 a 1,27 gcélula seca L-1 é usado
no sistema. É possível, desta forma, que nesta faixa de concentração o
substrato encontra-se em excesso em relação à concentração do
biocatalisador, reduzindo a atividade enzimática, conforme também sugerido
por Carra (2012). Foi observado também uma baixa resistência mecânica dos
cubos em meio líquido com um aumento da perda de massa durante o tratamento
diretamente proporcional a quantidade de biomassa adicionada, variando de
20,55 a 30,16%. Estes valores são bastante expressivos, comparado a espuma
padrão (sem micro-organismo), a qual apresentou perda de massa de 1,71%.
Esses resultados sugerem que a adição de biomassa altera a estrutura de
reticulação do polímero, tornando-o débil. Este comportando favorece o uso
do imobilizado em menores dimensões, como particulado ou em pó, o que
poderia inclusive favorecer a atividade enzimática, devido ao aumento da
transferência de massa, pela redução da área superficial. Durante a
imobilização foi necessário variar a quantidade de poliol e isocianato
indicado pelo fabricante para obter espumas com polimerização estável e
aspecto uniforme. Isto pode ser explicado principalmente pela presença de
água na biomassa, a qual possui em sua estrutura molecular hidroxilas,
ocasionando um excesso da mesma na reação, visto que são as hidroxilas do
poliol que reagem com o isocianato (MANO; MENDES, 1999; VILAR, 1999).
Complementarmente, é possível que a presença de outros constituintes
celulares e nutrientes residuais do cultivo tenham influenciado na
imobilização e formação da espuma. Na microscopia eletrônica é possível
observar internamente os poros da espuma de poliuretano flexível padrão
(Figura 2a) e da espuma de poliuretano imobilizada in situ com Z.
mobilis e GFOR/GL (Figura 2b). É observado, com clareza, a presença de
células na forma de bastão, típicas de Z. mobilis, aderidas a espuma,
as quais estão inexistentes na espuma padrão. Esta microscopia confirma que
é possível imobilizar in situ a Z. mobilis e o seu complexo
enzimático em espuma de poliuretano flexível.
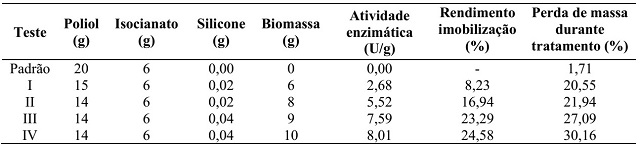
Figura 1 - Atividade enzimática, rendimento de imobilização e perda de massa de cubos de espumas de poliuretano imobilizados in situ com Z. mobilis.

Figura 2 - Microscopia eletrônica de varredura de (a) espuma de poliuretano flexível e (b) espuma de poliuretano imobilizada in situ com Z. mobilis.
Conclusões
Os resultados mostram que foi possível imobilizar Z. mobilis contendo o complexo enzimático periplasmático glicose-frutose oxidorredutase/glucono-δ- lactona em espuma de poliuretano flexível pela técnica de imobilização in situ. A imobilização de 6, 8, 9 e 10 g de biomassa na concentração de 210 g de célula seca por L em 21,02; 20,02; 20,04 e 20,04 g de reagentes (poliol, isocianato e silicone), respectivamente resultou em crescentes rendimentos de imobilização de 8,23; 16,94; 23,29 e 24,58%, embora com atividade enzimática inferior ao encontrado no micro-organismo livre. Foi observado também que a imobilização tornou a espuma de poliuretano flexível com baixa resistência mecânica em meio líquido, o que pode ser uma portunidade para novos usos. Os resultados contribuem com as pesquisas para a produção de ácidos aldônicos, as quais tem importantes aplicações industriais. Sugere-se que a temperatura de reação, a relação quantidade de célula seca no meio reacional pela quantidade de substrato utilizado e a dimensão do imobilizado sejam estudadas com mais detalhamento para que seja possível um maior rendimento de imobilização e futuras bioconversões.
Agradecimentos
À URI pelas instalações físicas e ao CNPq, CAPES e FAPERGS pelo apoio financeiro disponibilizados para a realização deste trabalho.
Referências
ALONSO, S.; RENDUELES, M.; DÍAZ, M. Bio-production of lactobionic acid: Current status, applications and future prospects. Biotechnology Advances, v. 31, p. 1275–1291, 2013.
BALDWIN, C.; AKASHE, A.; DINWOODIE, R.; KOKA, R.; WEST, L.G.; KORTUM, O. Use of siderophores and organic acid to retard lipid oxidation. US Patent 7.595.073 B2, 2009.
BERTASSO, M.; SILVEIRA, M. M.; MANCILHA, I. M. Preservação da atividade da enzima glicose-frutose oxidorredutase em células imobilizadas de Zymomonas mobilis. In: XI Simpósio Nacional de Fermentações. Anais... São Carlos, p.476, 1996.
CARRA, S. Estudo cinético da produção de ácido lactobiônico e sorbitol por enzimas periplasmáticas de Zymomonas mobilis. Dissertação (Mestrado em Biotecnologia) - Universidade de Caxias do Sul, Caxias do Sul, 2012.
CHUN, U. H.; ROGERS, P. L. The Simultaneous Production of Sorbitol from Fructose and Gluconic Acid from Glucose Using an Oxidoreductase of Zymomonas mobilis. Applied Microbiology and Biotechnology, v. 29, pp. 19-24, 1988.
DOELLE, H. W.; CRITTENDEN, R.; TOH, H.; DOELLE, M. B. Zymomonas mobilis: science and industrial apllication. Critical Reviews in Biotechnology, v. 13, n. 57-58, 1993.
FAERGEMAND, M.; GILLELADEN, C.; QVIST, K. B. Method for producing an acidifed milk product. US Patent Application Publication 20120045546 A1, 2012.
FERRAZ, H. C.; BORGES, C. P.; ALVES, T. L. M. Sorbitol and gluconic acid production using permeabilized Zymomonas mobilis cells confined by hollow-fiber membranes. Applied Biochemistry and Biotechnology, v. 89, p. 43-53, 2000.
FLORES, M. L. Síntese biocatalítica, recuperação e caracterização físico-química do ácido maltobiônico. Dissertação (Mestrado em Biotecnologia) - Universidade de Caxias do Sul, Caxias do Sul, 2019.
FOLLE, A. B.; BASCHERA, V. M.; CARRA, L. T. V. S.; POLIDORO, T. A.;MALVESSI, E.; SILVEIRA, M. M. Assessment of different systems for the production of aldonic acids and sorbitol by calcium alginate-immobilized Zymomonas mobilis cells. Bioprocess Biosystems Engineering, v. 41, p. 185–194, 2018.
GERLING, K. G. Large scale production of lactobionic acid use and new applications. Internation Dairy Federation, p. 251-261, 1998.
GHAANI, M.; COZZOLINO, C. A.; CASTELLI, G.; FARRIS, S. An overview of the intelligent packaging technologies in the food sector. Trends in Food Science & Technology, n. 51, p. 1-11, 2016.
GIBBS, M.; DE MOSS, R.D. Anaerobic dissimilation of C14 – labeled glucose on fructose by Pseudomonas lindneri. The Journal Biological Chemistry, 207: 689-694, 1954.
GREEN, B. A.; BRIDEN, M. E. Procedures in Cosmetic Dermatology: cosmeceuticals. Elsevier, v. 2, p. 209-215, 2009.
GROEN, B. W.; DE WRIES, S.; DUINE, J. A. Characterization of the hexose oxidase from the red seaweed Chrondus crispus, 1997 apud NORDKVIST, M., GUTIÉRREZ, L. P.; HAMOUDI, S.; BELKACEMI, K. Lactobionic acid: A high value-added lactose derivative for food and pharmaceutical applications. International Dairy Journal, v. n. 26, p.103-111, 2012.
GROVER N., PLAKS J. G., SUMMERS S. R., CHADO G. R., SCHURR M. J. e KAAR J. L. Acylase‐containing polyurethane coatings with anti‐biofilm activity. Biotechnology and Bioengineering, 2016.
GUNCHEVA M., TASHEV E., ZHIRYAKOVA D., TOSHEVA T. e TZOKOVA N.Immobilization of lipase from Candida rugosa on novel phosphorous-containing polyurethanes: Application in wax éster synthesis. Process Biochemistry, v. 46, n. 4, p. 923, 2011.
HARDMAN, M. J.; SCOPES, R. K. The kinetics of glucose-fructose oxidoreductase from Zymomonas mobilis. European Journal of Biochemistry, v. 173, p. 203-209, 1988.
JANG, I. H.; JUNG, S. G. CHANG, H. S.; CHUN. U. H. Improvement of the Process for Sorbitol Production with Zymomonas mobilis Immobilised in k-Carrageenan. Process Biochemisrty, v. 31, n. 5, p. 485-492, 1996.
KIM, I. S.; KIM, S. H. Development polymeric nanoparticulate drug delivery system: in vitro characterization of nanoparticles based on super-containing conjugates. International Journal of Pharmaceutics, v. 245, p. 67-73, 2002.
KOEHNTOPP, P. I.; PINHEIRO, H. M. V.; SILVEIRA, M. M.; JONAS, R. Estudo da imobilização de Zymomonas mobilis em poliuretano visando a produção de sorbitol e ácido glucônico. In: XI Simpósio Nacional de Fermentações. Resumos… São Carlos, p.470, 1996.
KOKA, R.; MEHNERT, D.W.; FRITSCH, R. J.; STEFFAN, W.; HABERMEIER, P.; BRADBURY, A.G.W.; ROHRMOOS, A.; WOLFSCHOON-POMBO, A.; ROSE, M. Process for manufacturing cheeses and other dairy products and products thereof. US Patent 6916496B2, 2005.
LIMA, U. A.; AQUARONE, E.; BORZANI, W.; SCHMIDELL, W. Biotecnologia Industrial. São Paulo: Edgard Blücher, 593 p., 2013.
LIMA, O.G.; SCHUMACHER, I.E.; ARAÚJO, J.M. New conservations about the antagonist effects of Zymomonas mobilis var recifensis, ecological aspects of some problems in microbiology. Revista do Instituto Antibiótico, v. 12, n. 57-68, 1972.
MADIGAN, M. T.; MARTINKO, J. M; PARKER, J. Microbiologia de Brock. 10. ed. São Paulo: Pearson Education, p. 350-351, 2010.
MALVESSI, E.; CONCATTO, K.; CARRA, S.; SILVEIRA, M. M. Formulation of medium for growth and production of ethanol and intracellular enzymes by Zymomonas mobilis. Brazilian Archives of Biology and Technology, v. 49, p. 39-144, 2006.
MALVESSI, E.; CARRA, S.; SILVEIRA, M. M.; AYUB, M. A. Z. Effect of substrate concentration, pH, and temperature on the activity of the complex glucose–fructose oxidoreductase/glucono-δ-lactonase present in calcium alginate-immobilized Zymomonas mobilis cells. Biochemical Engineering Journal, v. 51, p. 1-6, 2010.
MALVESSI, E.; CARRA, S.; PASQUALI, F. C.; KERN, D. B.; SILVEIRA, M. M.; AYUB, M. A. Z. Production of organic acids by periplasmic enzymes present in free and immobilized cells of Zymomonas mobilis. Journal of Industrial Microbiology and Biotechnology, v. 40, p. 1–10, 2013.
MANO, E. B.; MENDES, L. C. Introdução a polímeros. 2. ed. São Paulo: Editora Edgard Blücher Ltda, 1999.
MIYAKE, T.; SATO, Y. Process for the production of foods and drinks with the employment of maltobionc acid. US Patent 3.899.604, 1975.
MUKHOPADHYAY, R.; CHATTERJEE, S.; CHATTERJEE, B.P.; BANERJEEB, P.C.; GUHA, A.K. Production of gluconic acid from whey by free and immobilized Aspergillus niger. International Dairy Journal, v. 15, p. 299–303, 2005.
NIELSEN, P. M.; HOEIER, E. Food products containing aldobionic acid. WO Patent Application Publication 007398 A1, 2009.
NIELSEN, P.M. Meat based food product comprising lactobionic acid. US Patent Application Publication 0214752 A1, 2009.
NIELSEN, P. M. Maltobionate as antioxidant in food products. US Patent Application Publication 2010/0173044 A, 2010.
OE, K.; KIMURA, T. Aging inhibitor for bread. JP Patent Application Publication 2011177121, 2011.
REHR, B.; WILHEM, C.; SAHM, N. Production of sorbitol and gluconic acid by permeabilized cells of Zymomonas mobilis. Applied Microbiology and Biotechnology, v. 35, p. 144-148, 1991.
SWINGS, J.; DE LEY, J. The Biology of Zymomonas. Bacteriological Reviews, v. 41, n. 1, pp. 1-46, 1977.
VIGNOLI, J. A.; CELLIGOI, M. A. P. C., SILVA, R. S. F.; BARROS, M. The production of sorbitol by permeabilized and immobilized cells of Zymomonas mobilis in sucrose. Brazilian Archives Biology Technology, v. 49, p. 683-687, 2006.
VIIKARI, L. Formation of Levan e Sorbitol form Sucrose by Zymomonas mobilis. Applied Microbiology and Biotechnology, v. 19, pp. 252-255, 1984a.
VILAR, W. D. Química e Tecnologia dos Poliuretanos, 2. ed., Rio de Janeiro: Vilar Consultoria, 1999.
WALTER, T.; BEGLI, H. A. Flavour enhancer. US Patent Application Publication 0244080 A, 2011.
WANICK, M. C.; ARAÚJO, J. M.; SILVA, E. C.; SCHUMACHER, I. E. Cura de vaginites de etiologia variada pelo emprego de cultura de Zymomonas mobilis. Revista do Instituto Antibiótico, v. 10; p. 47-49, 1970.
YUEN, S. Mixture of maltobionic acid and monosodium glutamate as a food seasoning. US Patent 3.829.583, 1974.
ZACHARIOU, M. & SCOPES, R. K. Glucose-fructose oxidoreductase, a new enzyme isolated from Zymomonas mobilis that is responsible for sorbitol production. Journal of Bacteriology, v. 3, p.863-869, 1986.









