Imobilização de micro-organismos em esponja multiuso comercial para produção de pectinases
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Nery de Melo, R. (URI ERECHIM) ; de Marco, M. (URI ERECHIM) ; Meirelles da Silva, L. (URI ERECHIM) ; Comin, T. (URI ERECHIM) ; de Bastos, G. (URI ERECHIM) ; Zeni, J. (URI ERECHIM) ; Cansian, R.L. (URI ERECHIM)
Resumo
Este trabalho buscou avaliar a imobilização por contato do P. brasilianum em esponja multiuso comercial como suporte alternativo na produção de exo-poligalacturonase (exo-PG). O P. brasilianumimobilizado por contato em esponja multiuso comercial alcançou uma produção de 0,92 vezes maior que o micro-organismo livre, demostrando a viabilidade de utilização deste suporte como forma de reaproveitamento de materiais para a produção de enzimas.
Palavras chaves
biotecnologia; imobilização celular; poligalacturonase
Introdução
O desenvolvimento de tecnologias dentro da indústria alimentícia vem apresentando crescimento ao longo dos anos, sendo destaque os processos biotecnológicos. Dentro da biotecnologia, os processos utilizando enzimas, surgem com alternativa de substituição de processos químicos convencionais, principalmente pela alta especificidade e potencial catalítico dessas enzimas, bem como sua estabilidade frente a solventes orgânicos. Além disso, trazem consigo benefícios ao meio ambiente e redução de custos pelas indústrias, melhorando também a qualidade de seus (CASTRO et al., 2004; MODI et al., 2007; CARVALHO, 2007; WU et al., 2015; SUN et al., 2018). Neste contexto, as pectinases encontram inúmeras aplicações comerciais, sendo utilizadas para a redução na viscosidade da polpa de frutas, melhorando a extração, filtração e clarificação dos sucos, no aceleramento ou inibição da formação de espuma nas fermentações de chá e café por exemplo (GUMMADI e PANDA, 2003; OLIVEIRA, 2005). Bactérias, leveduras e fungos filamentosos têm sido explorados para a produção em larga escala de pectinases, sendo que fungos com o gênero Penicillium sp. têm demonstrado que alguns isolados são produtores promissores dessa enzima (KANT et al., 2013; ZENI, 2011). Para Trabelsi et al. (2014), a tecnologia de imobilização aumenta a densidade celular, melhora a resistência à contaminação e é capaz de manter a estabilidade química e física das células. Diante do exposto, o presente trabalho teve por objetivo avaliar a imobilização por contato do P. brasilianum em esponja multiuso comercial como suporte alternativo na produção de exo-PG.
Material e métodos
Microrganismo e preparação do inóculo: O cultivo do fungo Penicillium brasilianum foi realizado em Ágar Potato Dextrose (PDA) durante 5 dias em estufa à 25°C. Após, os esporos foram coletados adicionando-se ao frasco 20 mL de solução aquosa de Tween 80 (0,1 % v/v) e cacos de porcelana estéreis. Para contagem dos esporos foi retirado, assepticamente, 1 mL da suspensão, sendo diluída de 10 a 10-3vezes em solução aquosa estéril de Tween 80 (0,1 % v/v). A suspensão resultante foi transferida para uma câmara de Neubauer para contagem dos esporos (FREIRE, 1996), sendo fixada uma concentração de esporos de 5x106(ZENI, 2009). Produção de exo-PG com P. Brasilianum livre: A bioprodução de exopoligaracturonase foi realizada empregando meio maximizado em frascos agitados (ZENI, 2009), contendo 32 g/L de pectina cítrica (Vetec/Química Fina, Brasil) 10 g/L de extrato de levedura (Vetec/Química Fina, Brasil) e 0,5 g/L sulfato de magnésio (CAQ/Casa da Química, Brasil), sendo adicionado neste meio de cultura o inóculo de Penicillium brasilianum. As condições de cultivo foram 30 °C, 180 rpm, pH inicial de 5,5 e 96h. Imobilização de P. Brasilianum em esponja multiuso comercial para produção de exo-PG: A esponja multiuso dupla face comercial, composta por poliuretano e outra face por fibra sintética com abrasivo, foi utilizada como suporte alternativo para imobilização do P. brasilianum. Cabe salientar, que a esponja utilizada para o experimento era uma esponja já usada e seria destinada ao descarte. Inicialmente, retirou-se a face abrasiva da esponja, na sequência a mesma foi lavada com 100 mL de água destilada até que todo o resíduo visível fosse eliminado. Após, a espuma foi cortada em cubos de 1 cm3 e estes esterilizados em autoclave a 121°C por 20 minutos. Em seguida, foram encharcados em caldo PD por 1 minuto e depois adicionados em meio PDA com esporos do P. brasilianum, deixados durante 5 dias em estufa na temperatura de 30°C. Os cubos de espuma contendo as células de P. brasilianum imobilizadas foram utilizados para a bioprodução de exo-PG em meio de cultura contendo 32 g/L de pectina cítrica, 10 g/L de extrato de levedura e 0,5 g/L sulfato de magnésio, a 30 ºC, 180 rpm por 96 h (ZENI,2011), na proporção de 3 cubos para 63 mL de meio. Amostras foram coletadas a 24 horas para quantificação da exo-PG e biomassa. Determinação da concentração celular: A determinação da concentração celular foi realizada por medida de peso seco, em estufa a 105°C por aproximadamente 24 horas. Atividade da exo-PG: A determinação da atividade pectinolítica da exo-PG foi realizada através de acordo com metodologia proposta inicialmente por MILLER(1959). Tratamento estatístico: Os resultados foram tratados estatisticamente mediante análise de variância(ANOVA) e comparação das médias pelo teste de Tukey a nível de 95% de confiança com software Statistica versão 8.0.
Resultado e discussão
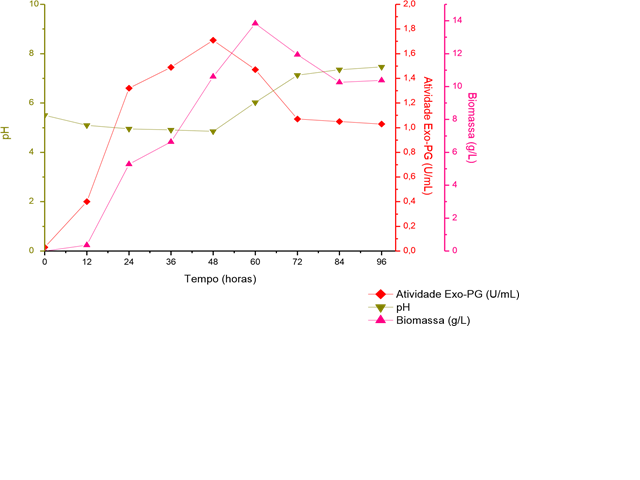
Na Figura 1 encontram-se os resultados cinéticos da produção de
exopoligalacturonase ao longo de 96 horas de cultivo, a partir do P.
brasilianum livre. Observa-se que a máxima de atividade de exo-PG
(1,71U/mL) foi obtida em 48 horas de produção. A biomassa atingiu seu valor
máximo de 13,84 g/L após 60 horas de cultivo. A curva apresentou
comportamento de perfil clássico, com uma fase de adaptação nas primeiras 12
horas, multiplicação exponencial em 12 a 60 horas e fase estacionária após
as 84 horas.
O pH apresentou-se em declínio até as 48h, comportamento este que pode ser
atribuído à liberação de ácido galacturônico no meio pela ação das enzimas
pectinolíticas (UENOJO e PASTORE, 2007) produzidas pelo fungo. Após este
período, o pH volta aumentar principalmente pelo consumo da fonte de
nitrogênio disponível no meio. Nas primeiras 48 horas, 42,37% do carbono
disponível foi consumido, enquanto que para o nitrogênio, um total de 64,73%
foi utilizado, linearizando seu consumo no decorrer das 96 horas de
fermentação.
Comparando aos resultados encontrados na literatura para produção de exo-PG
por diferentes tipos de microrganismos, pode-se observar que as atividades
pectinolíticas foram semelhantes. Silva et al.(2016) obtiveram 1,77
U/mL de PG por Aspergillus aculeatus URM 4953 em fermentação submersa
utilizando o substrato farinha da casca do maracujá.
Borszcz (2015) relata que na faixa de pH de 4 a 6,5, ocorre a máxima de
produção de poligalacturonase. Para Tari et al. (2008), a maior
produção encontra-se entre os valores de pH entre 3,5 e 5,5, dependendo da
fonte microbiana.
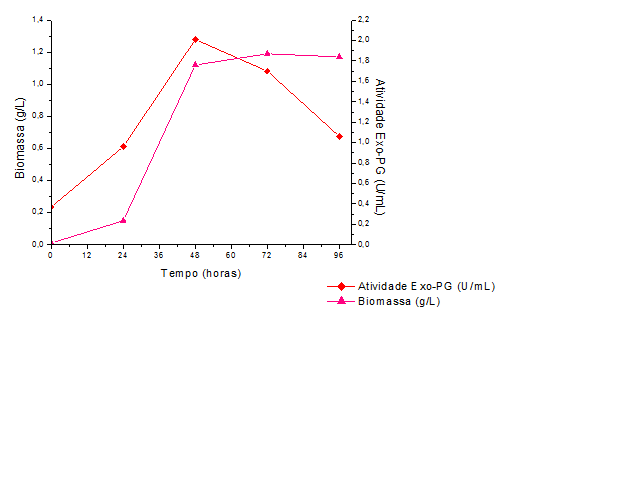
Na Figura 2 estão apresentados os resultados da atividade de exo-PG e
difusão de biomassa a partir do fungo imobilizado em suporte alternativo ao
longo de 96 horas, sob condições de cultivo de 30ºC e 180 rpm.
Em 48 horas de produção, ocorreu a maior atividade de exo-PG (1,85 U/mL),
valor superior ao encontrado pela produção do microrganismo livre. Esse
resultado sugere que a esponja comercial pode ser considerada com um suporte
alternativo para imobilização celular, permitindo o reaproveitamento de
materiais e possibilitando uma matriz de baixo custo.
Alguns autores relatam a utilização de suportes alternativos e de baixo
custo para a imobilização de microrganismos. Ejaz, Ahmed e Sohaial (2018)
imobilizaram Geotrichum candidum AA15 em sabugo de milho para a
produção de pectinases, obtendo quantidades de pectinases muito maiores do
que obtido das células livres. Kurade et al. (2019) utilizaram
esponja de aço inoxidável, entre outras matrizes, para imobilizar a bactéria
Geotrichum candidum e a levedura Galactomyces geotrichum a fim
de investigar a descoloração de um corante modelo em efluente da indústria
têxtil. Seus resultados demonstraram o suporte como uma ferramenta eficaz
para aplicação potencial na remoção de corantes têxteis com 90% de
eficiência de descoloração.
Ao comparar a capacidade do P. brasilianum imobilizado por contato em
esponja multiuso comercial em produzir exo-PG, nota-se que seus resultados
foram superiores ao microrganismo livre nas 48 horas de produção, tidas como
tempo onde o fungo atinge sua capacidade máxima produtiva, diferindo
significativamente ao nível de 5%.
Conclusões
Este estudo demonstra que a esponja multiuso comercial pode ser considerada com um suporte alternativo para imobilização celular, permitindo o reaproveitamento de materiais e possibilitando uma matriz de baixo custo para o processo de imobilização celular para fins de produção de biocompostos.
Agradecimentos
À Universidade Regional Integrada do Alto Uruguai e das Missões(URI), CAPES, CNPQ e FAPERGS.
Referências
BORSZCZ, V. Produção de pectinases por Aspergillus niger ATCC 9642 em cultivo estado sólido e aplicação na remoção de biofilmes microbianos. Tese (Doutorado em Engenharia Alimentos) Universidade Regional Integrada do Alto Uruguai e das Missões – Campus de Erechim, URI, 2015.
CARVALHO, E. A. Caracterização de pectinases obtidas a partir dos resíduos industriais da polpa do abacaxi (Ananas comosus L. Merr) cv. Pérola. Dissertação de Mestrado (Mestrado em Ciência e Tecnologia de Alimentos) Universidade Federal da Paraíba, João Pessoa, 2007.
CASTRO, H.F.; MENDES, A.A; dos SANTOS, J.C.; de AGUIAR, C.L. Modificação de óleos e gorduras por biotransformação. Química Nova, v. 27, p. 146-156, 2004.
EJAZ, U.; AHMED, A.; SOHAIL, M. Statistical optimization of immobilization of yeast cells on corncob for pectinase production. Biocatalysis and Agricultural Biotechnology, v. 14, p. 450-456, 2018.
FREIRE, D.M.G. Seleção de microrganismos lipolíticos e estudo da produção de lipase por Penicillium restrictum. Tese de Doutorado, Universidade Federal do Rio de Janeiro, RJ. 1996.
GUMMADI, S. N.; PANDA, T. Purification and biochemical properties of microbial pectinases-A review. Process Biochemistry, v. 38, p. 987-996, 2003.
KANT, S.; VOHRA, A.; GUPTA, R. Purification and physicochemical properties of polygalacturonase from Aspergillus niger MTCC 3323. Protein Expression and Purification, v. 87, p. 11-16, 2013.
KURADE, M. B.; WAGHMODE T. R.; XIONGA, J-Q.; GOVINDWARA, S. P.; JEON, B-H. Decolorization of textile industry effluent using immobilized consortium cells in upflow fixed bed reactor, Journal of Cleaner Production, v. 213, p. 884-891, 2019.
MILLER, G.L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical biochemistry, v.31, p.426-428, 1959.
MODI, M. K.; REDDY, J. R. C.; RAO, B. V. S. K.; PRASAD, R. B. N. Lipase-mediated conversion of vegetable oils into biodiesel using ethyl acetate as acyl acceptor . Bioresource Technology, n. 98, p. 1260–1264, 2007.
OLIVEIRA, F. E. R.; ASMAR, S. A.; ABREU, C. M. P.; CORRÊA, A. D. Firmeza de pêssegos ‘Diamante’ tratados com 1-MCP. Revista Brasileira de Fruticultura, v. 27, p. 366-368, 2005.
SILVA, J. C.; MELO, A. H. F.; PORTO, T. S. Produção de poligalacturonase por Aspergillus aculeatus URM 4953 em fermentação submersa utilizando planejamento fatorial. In: ENBEQ, XXI Congresso Brasileiro de Engenharia Química. Fortaleza/CE. 2016.
SILVA, J. C.; FRANÇA, P. R. L.; MELO, A. H. F.; NEVES-PETERSON, T.; CONVERTI, A.; SOUZA, T. P. Optimized production of Aspergillus aculeatus URM 4953 polygalacturonases for pectin hydrolysis in hog plum (Spondias mombin L.) juice. Process Biochemistry. 2018.
SUN, S.; WANG, G.; WANG, P. A cleaner approach for biodegradable lubricants production by enzymatic glycerolysis of castor oil and kinetic analysis. Journal of Cleaner Production, n. 188, p. 530–535, 2018.
UENOJO, M.; PASTORE, Pectinolytic enzymes. Industrial applications and future perspectives; Química Nova. v.30, n.2 São Paulo, 2007.
TARI, C.; DOGAN, N.; GOGUS, N. Biochemical and thermal characterization of crude exo-polygalacturonase produced by Aspergillus sojae. Food Chemistry, v. 111, n. 4, p. 824-829, 2008.
TRABELSI, Imen et al. Effects of Lactobacillus plantarum immobilization in alginate coated with chitosan and gelatin on antibacterial activity. International Journal of Biological Macromolecules, v. 64, p. 84–89, 2014.
WU, J. C. Y.; HUTCHINGS,C. H.; LINDSAY, M. J.; WERNER, C. J.; BUNDY, B. C. Enhanced Enzyme Stability Through Site-Directed Covalent Immobilization. Journal of Biotechnology, n. 193, p. 83–90, 2015.
ZENI, J. Screening de microrganismos produtores de carotenóides e poligalacturonases. Dissertação de Mestrado. Universidade Regional Integrada do Alto do Uruguai e das Missões. URI - Campus Erechim. Departamento de Ciências Agrárias. Programa de Pós-Graduação em Engenharia de Alimentos. 2009.
ZENI, J. Produção e caracterização parcial de pectinases obtidas por uma nova cepa de Penicillium brasilianum em fermentação submersa. Tese de Doutorado. Universidade Regional Integrada do Alto do Uruguai e das Missões. URI - Campus Erechim. Departamento de Ciências Agrárias. Programa de Pós-Graduação em Engenharia de Alimentos. 2011.









