Determinação dos parâmetros cinéticos da urease presente no extrato bruto de soja
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Silva Junior, R.A. (UFPE) ; Palha, M.L.A.P.F. (UFPE)
Resumo
No Brasil, a maioria das enzimas purificadas é importada, que implica num elevado custo. Assim, o uso de extratos vegetais brutos é uma alternativa mais barata e de fácil obtenção. Neste trabalho, as constantes cinéticas da urease presente num extrato bruto de soja e de uma solução comercial de urease foram determinadas para fins de comparação. A atividade da enzima foi monitorada pelo método de Berthelot e os parâmetros determinados pelo gráfico de Lineweaver-Burk. Os resultados mostraram que a constante de Michaelis-Menten foi a mesma para as duas enzimas, porém, a velocidade máxima da enzima do extrato foi menor, de tal forma que para substituir a enzima comercial pelo extrato vegetal mantendo a mesma atividade, basta adicionar ao sistema um volume cerca de 7,9 vezes maior de extrato.
Palavras chaves
Urease; Soja; Cinética
Introdução
As enzimas desempenham uma função importantíssima para manutenção da vida, catalisando as reações metabólicas nos organismos. Porém, o potencial destas biomoléculas vai muito além, podendo ser usadas nas mais diversas áreas, como nos processos industriais, na composição de produtos de limpeza e cosméticos, em biossensores, na química analítica, na agricultura e na medicina. Grande parte dos processos industriais utilizam reações químicas para manufatura do produto final e fazem uso de catalisadores químicos, muitas vezes de difícil obtenção e descartabilidade. As aplicações de enzimas em tais processos trazem algumas vantagens, entre elas a elevada seletividade ao substrato e a viabilidade ecológica, pois consistem em moléculas biodegradáveis. As enzimas já são amplamente utilizadas em segmentos industriais como o de alimentos, de papel, de medicamentos e têxtil (MONTEIRO; SILVA, 2009). No campo da química analítica, métodos enzimáticos são empregados para determinar a concentração de algumas substâncias em amostras biológicas, como o sangue, por exemplo. Muitas enzimas de interesse para os processos industriais e para a química analítica podem ser encontradas em bactérias, fungos e principalmente em plantas. Desta forma, é possível usar extratos vegetais como fonte de enzimas, para posterior purificação ou para uso direto. Como o Brasil apresenta uma alta biodiversidade, se torna fonte inesgotável de enzimas (ROCHA, 2003), porém, o país continua sendo um grande importador de enzimas purificadas. É necessário que novas tecnologias sejam desenvolvidas nesta área para melhor aproveitamento deste potencial, otimizando sua produção em larga escala e melhorando o desempenho da catálise (MONTEIRO; SILVA, 2009). Na maioria das aplicações são empregadas enzimas na forma purificada, pois apresentam melhor seletividade em métodos analíticos. Por outro lado, o uso de extratos brutos faz com que os custos diminuam muito, descartando a necessidade de importação, além de ter maior estabilidade e de possuir naturalmente os cofatores disponíveis (AMARAL et al, 2008; ROCHA, 2003). Para assegurar a equivalência das atividades catalíticas de enzimas purificadas e extratos vegetais, faz-se necessário que os parâmetros cinéticos sejam avaliados nos dois casos, para que os resultados gerados por procedimentos analíticos ou a qualidade e pureza de produtos industriais não sejam comprometidos com a substituição do catalisador purificado. A urease é uma enzima que apresenta alta especificidade com o substrato ureia, catalisando sua hidrólise e produzindo duas moléculas de amônia e dióxido de carbono para cada molécula de ureia decomposta. A amônia produzida reage com a água presente no meio para formar o íon amônio, conferindo caráter básico à solução (ALMEIDA et al, 2008). Assim, para avaliar a quantidade de ureia hidrolisada é possível medir a concentração de íon amônio na solução, usando, por exemplo, o método de Berthelot, que possui a vantagem de apresentar alta sensibilidade e exatidão e baixos limites de detecção (GIAROLA, 2009). O princípio do método consiste em tornar o meio alcalino, favorecendo a formação de amônia a partir do íon amônio produzido pela hidrólise da ureia, que em seguida reage com o fenol. Na presença do catalisador nitroprussiato de sódio, o produto da reação anterior reage com hipoclorito, formando o indofenol, composto azul cuja intensidade da cor é proporcional à concentração de amônia na solução (GUEDES, 2007). Assim, é possível determinar a concentração de amônio na amostra por espectrofotometria e comparação com curva padrão. Para determinação experiental da constante de Michaelis-Menten (Km) e da velocidade máxima (Vmax), recorre-se à equação de Lineweaver-Burk, que consiste numa linearização da equação de Michaelis-Menten, relacionando o inverso da velocidade inicial com o inverso da concentração do substrato (NELSON; COX, 2014). Desta forma, o coeficiente linear da reta obtida pela regressão dos dados experimentais equivale ao inverso de Vmax, enquanto que o coeficiente angular representa a razão Km/Vmax. Neste trabalho, foi analisada a hidrólise enzimática da ureia fazendo uso de uma urease comercial purificada e de um extrato bruto de soja contendo a enzima, determinando os parâmetros cinéticos. Além disso, foi avaliada a equivalência entre as ureases das duas fontes, ou seja, o volume de extrato responsável pela mesma atividade de 1 mL da enzima purificada.
Material e métodos
O extrato enzimático de soja foi preparado segundo o procedimento de Eulálio (2016), usando 150 g de grãos de soja adquiridos em supermercado. A solução comercial usada, da marca Labtest, tem uma atividade especificada de 268 U mL-1. Para cada uma das enzimas, foi preparada uma solução padrão diluindo 1 mL da solução enzimática original em 20 mL de um tampão fosfato 20 mM e pH 6,9 que também contém salicilato de sódio 62,4 mM e nitroprussiato de sódio 3,36 mM, reagentes necessários para a reação de Berthelot (LABTEST, 2014). Todo o procedimento a seguir foi baseado em Guedes (2007) e repetido para a enzima purificada e para o extrato de soja. Para determinação da velocidade da reação catalisada pela urease, foram utilizadas soluções de ureia nas concentrações de 0,1 M, 0,2 M, 0,4 M, 1,0 M, 2,0 M e 4,0 M. Em 1,4 mL de solução de cada concentração citada, foi adicionado 0,1 mL de solução padrão de urease. A mistura foi imediatamente incubada em banho maria a 37°C, temperatura ideal para esta reação segundo Adewoyin e Egwin (2011). Depois de 30 segundos de incubação, foi adicionado a cada tubo com amostra 1 mL de uma solução oxidante contendo 140 mM de hidróxido de sódio e 6,05 mM de hipoclorito de sódio (LABTEST, 2014). Em seguida, a amostra permaneceu incubada por mais 5 minutos. Durante este período, a urease promoveu a hidrólise de parte da ureia presente nas amostras, enquanto a amônia liberada pela hidrólise reagiu segundo a reação de Berthelot, produzindo uma solução colorida. Por fim, as absorbâncias das amostras foram obtidas através da leitura em espectrofotômetro no comprimento de onda de 600 nm. A partir de uma curva analítica previamente preparada com padrões de sulfato de amônio, foi possível determinar a concentração de amônio em cada amostra, que de acordo com a estequiometria da reação equivale ao dobro da concentração de ureia consumida. A velocidade inicial de cada reação por volume de enzima foi calculada dividindo a concentração de ureia consumida pelo tempo de reação de 5,5 min e pelo volume utilizado de solução enzimática, 0,1 mL. Então, foi aplicada a regressão linear aos pontos experimentais que representam o inverso da velocidade inicial em função do inverso da concentração de substrato. Após a obtenção da equação da reta, os coeficientes foram comparados com os da equação de Lineweaver-Burk, para enfim calcular os parâmetros cinéticos Km e Vmax. Por fim, a atividade por unidade de volume da enzima presente no extrato vegetal foi calculada através da comparação das velocidades máximas de reação obtidas para as ureases das duas fontes, com a finalidade de avaliar a substituição da enzima comercial pelo extrato bruto.
Resultado e discussão
A curva padrão utilizada para determinar a concentração de amônio em cada
amostra de ureia hidrolisada pela urease comercial apresentou coeficientes
angular e linear iguais a 2,3873 e 0,0398, respectivamente, com coeficiente
de determinação R2 igual a 0,9962. Já para a curva padrão
correspondente ao extrato de soja, os coeficientes angular e linear
encontrados foram respectivamente 2,3542 e 0,0425, tendo R2 igual
a 0,9961. Comparando os coeficientes das duas curvas, os valores ficaram bem
próximos. Isto pode indicar, entre outros motivos, que a substituição da
urease pouco interferiu na tomada dos resultados das amostras. De acordo com
Uberti (2010), a urease absorve radiação na região ultravioleta no
comprimento de onda de 280 nm, bem distante dos 600 nm utilizados para
medição das absorbâncias dos padrões de íon amônio. Portanto, o fato de a
urease não absorver radiação a 600 nm pode justificar a proximidade entre os
coeficientes das curvas construídas para as ureases das duas fontes, já que
a solução enzimática era a única diferença entre os padrões utilizados para
construir cada curva. Após os cálculos das concentrações de amônio e das
velocidades iniciais de reação para cada amostra, obtêm-se os dados
necessários para determinação dos parâmetros cinéticos da urease. A Figura 1
mostra o gráfico concentração de substrato na amostra versus velocidade
inicial de reação, para as amostras hidrolisadas pelas enzimas das duas
fontes estudadas. Estes gráficos seguem o comportamento característico
descrito por Nelson e Cox (2014), próximo de uma hipérbole retangular, no
qual a velocidade inicial cresce rapidamente quando a concentração de
substrato aumenta e para concentrações mais altas, tende a se estabilizar na
velocidade máxima. Nestes gráficos, é possível observar que a velocidade
máxima ainda não foi atingida, pois a curva ainda apresenta uma pequena
inclinação no último ponto analisado, indicando que a velocidade máxima é
atingida numa concentração de ureia maior que 4,0 mM. A principal diferença
entre os dois gráficos, evidenciada pela escala utilizada no eixo das
ordenadas, está nas velocidades iniciais correspondentes a cada
concentração, que foram bem menores quando se usou o extrato vegetal. Isto
indica que a atividade da enzima presente no extrato de soja é bem menor que
a da enzima purificada, ou que a enzima esteja muito diluída nos outros
componentes da matriz ou ainda que exista na matriz vegetal um inibidor que
atue sobre a reação enzimática. Para determinar a constante de Michaelis-
Menten e a velocidade máxima, foram construídos os gráficos de Lineweaver-
Burk, mostrados na Figura 2, a partir dos inversos das coordenadas dos
pontos apresentados nos gráficos da Figura 1. A curva de regressão linear
para estes gráficos ficaram muito próximas dos pontos experimentais, cujos
valores de R2 correspondentes são de 0,9991 e 0,9990,
respectivamente, para os gráficos correspondentes à urease comercial e ao
extrato de soja. No primeiro gráfico, relativo à enzima comercial, foi
encontrado um coeficiente angular de 7,855x10-4 e um coeficiente
linear de 3,166x10-4. Efetuando os devidos cálculos, encontra-se
Km = 2,481 mM e Vmax = 3158,36 micromol min-1 mL-1. Já
para o segundo gráfico, que representa a enzima presente no extrato vegetal,
foram obtidos coeficientes angular e linear iguais a 6,271x10-3 e
2,498x10-3, respectivamente. Após os cálculos convenientes,
determinou-se as constantes cinéticas Km = 2,511 mM e Vmax = 400,39 micromol
min-1 mL-1. Comparando os valores encontrados,
verifica-se que as constantes de Michaelis-Menten ficaram muito parecidas,
indicando que as enzimas das duas fontes apresentam a afinidades próximas
pelo substrato, enquanto que a velocidade máxima diminuiu muito, devido aos
fatores já citados. No trabalho de Soares (2011) foram comparados os valores
de Km e Vmax para um extrato bruto de feijão de porco (jack bean) e uma
enzima purificada, também observando a manutenção do valor de Km e redução
da Vmax quando a urease purificada é substituída pelo extrato. Enquanto
neste trabalho a velocidade máxima notada para o extrato de soja foi apenas
12,7% quando comparado com a urease comercial, no de Soares (2011) este
percentual foi aproximadamente 82,4%. As diferenças entre as matrizes
vegetais e o maior volume de água usado na extração, bem como o tempo e a
velocidade de centrifugação menores podem ter provocado esta grande redução
na atividade enzimática. Em relação à constante de Michaelis-Menten, os
valores obtidos para a urease comercial e o extrato vegetal foram, em média,
2,6 mM e 3,3 mM, respectivamente. Assim como no presente trabalho, os
resultados ficaram próximos, ficando a enzima do extrato com um valor um
pouco maior. Devido às diferentes velocidades de reação, é necessário
determinar a relação entre o volume de extrato de soja e de urease comercial
que apresenta a mesma atividade, para que haja substituição da enzima sem
comprometer o resultado de um método analítico ou de um processo industrial,
por exemplo. Considerando que a atividade está relacionada com a
concentração de enzima na solução e que para uma mesma atividade a
velocidade máxima seja inversamente proporcional ao volume de solução,
concluiu-se que um volume de extrato de soja igual a 7,9 mL equivale à mesma
atividade de 1 mL da urease comercial estudada.
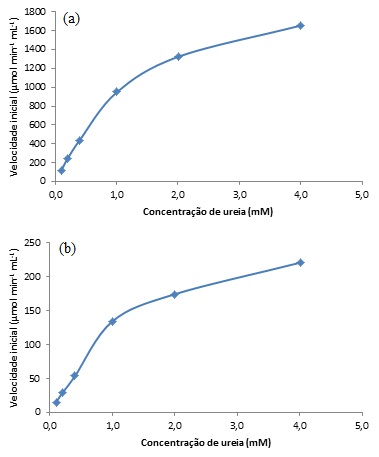
Influência da concentração de substrato sobre a velocidade inicial da reação enzimática, utilizando urease comercial (a) e extrato bruto de soja (b).
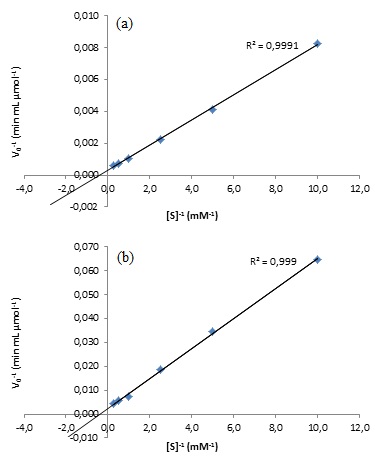
Gráficos de Lineweaver-Burk para os experimentos utilizando urease comercial (a) e extrato bruto de soja (b).
Conclusões
A partir da metodologia proposta, foi possível determinar os parâmetros cinéticos da urease obtida de duas fontes estudadas: a enzima comercial purificada em solução tamponada e o extrato bruto da soja, empregando o método de Berthelot para quantificação da amônia produzida pela hidrólise da ureia. A constante de Michaelis-Menten determinada experimentalmente para as enzimas das duas fontes tiveram valores próximos a 2,5 mM, indicando que ambas possuem afinidades semelhantes pelo substrato, ou seja, o uso da urease de qualquer uma das fontes não deve provocar diferenças na seletividade do método onde é aplicada. Por outro lado, a velocidade máxima da enzima extraída da soja foi consideravelmente menor que a enzima comercial devido à diferença de atividade, diluição da matriz ou presença de inibidor desconhecido no extrato de soja. Por fim, é possível substituir a enzima purificada por um extrato vegetal sem comprometer a reação de hidrólise. Para isso, basta utilizar 7,9 mL de extrato bruto para cada 1 mL de urease comercial que deveria ser utilizada. Assim, os métodos analíticos ou processos industriais que utilizam urease precisariam ser adaptados para contemplar este novo volume de solução enzimática.
Agradecimentos
Ao Departamento de Bioquímca e ao Departamento de Engenharia Química, da Universidade Federal de Pernambuco.
Referências
ADEWOYIN, O. M.; EGWIN, E. C. Kinetic Characteristics of Urease Isolated from Selected Beans Species as Affected by Germination. Science Journal of Biochemistry, v. 2011, n. 1, p. 1-7, 2011.
ALMEIDA, V. V.; BONAFÉ, E. G.; STEVANATO, F. B.; SOUZA, N. E. de; VISENTAINER, J. E. L.; MATSUSHITA, M.; VISENTAINER, J. V. Catalisando a Hidrólise da Ureia em Urina. Química Nova na Escola, n. 28, p. 42–46, mai. 2008.
AMARAL, K. C. O. G.; COSTA, A. P. S.; LIRA D. C.; BEZERRA, C. A.; SANTOS, A. S.; SILVA, P. M. S.; MELO, J. V. Estudo da atividade da urease em extratos vegetais. In: Congresso Brasileiro de Química, 48, 2008, Rio de Janeiro-RJ.
EULÁLIO, H. Y. C.; CARDOSO, M. J. B.; MARINHO, T. M. A.; LIMA, R. J. S.; FOOK, M. V. L.; SWARNAKAR, R. Avaliação da imobilização da enzima urease extraída da semente de Canavalia ensiformis em membranas de quitosana, para uso em biossensores para detecção de ureia. Revista Eletrônica de Materiais e Processos, v. 11, n. 1, p. 34–39, 2016.
GIAROLA, D. A. Estudo sobre amostragem de NH3 atmosférica utilizando o compósito SiO2/ZrO2/fosfato. Dissertação de Mestrado. Londrina-PR: Universidade Estadual de Londrina, 2009. 88 p.
GUEDES, L. S. Manual de Aulas Práticas. 2007, 34 p. Universidade Federal de Pernambuco, Departamento de Bioquímica, Recife-PE.
LABTEST. Ureia CE: Instruções de uso do kit colorimétrico enzimático para determinação de ureia, Ref. 27, Lagoa Santa-MG, 2014.
MONTEIRO, V. N.; SILVA, R. do N. Aplicações Industriais da Biotecnologia Enzimática. Revista Processos Químicos, v. 3, n. 5, p. 9-23, jan.-jun. 2009.
NELSON, D. L.; COX, M. M. Princípios de Bioquímica de Lehninger, 6 ed.; Artmed: Porto Alegre, RS, 2014.
ROCHA, V. A ciência vai à feira. Revista Univerciência, v. 2, n. 6, p. 10-15, dez. 2003.
SOARES, J. C. Biossensores eletroquímicos fabricados a partir da imobilização da urease em filmes de polipirrol. Tese de Doutorado. São Carlos, SC: Universidade de São Paulo, 2011. 127 p.
UBERTI, A. F. Urease de Helicobacter pylori: ativação de plaquetas e neutrófilos. Dissertação de Mestrado. Porto Alegre, RS: Universidade Federal do Rio Grande do Sul, 2010. 97 p.









