Síntese de Nanobastões de Titanato Modificados com Zinco e Quercetina e sua Aplicação Biológica
ISBN 978-85-85905-25-5
Área
Química Inorgânica
Autores
Diz, F.M. (PUCRS) ; Monteiro, W.F. (UFRGS) ; Zotti, E.R. (PUCRS) ; Jesus, J.L.F. (PUCRS) ; Lima, J.E.A. (PUCRS) ; Morrone, F.B. (PUCRS) ; Ligabue, R.A. (PUCRS)
Resumo
As nanoestruturas híbridas são possíveis alternativas para melhorar a eficácia dos tratamentos convencionais em diversas malignidades, devido a características como biocompatibilidade e capacidade de funcionalização com diferentes compostos. A atividade antitumoral e potencial quimiopreventivo da quercetina tem sido relatada em diferentes tipos de cânceres. Este trabalho tem como objetivo desenvolver nanoestrutras de titanatos híbridas utilizando uma morfologia em bastões como suporte para o flavonoide quercetina, avaliando sua resposta biológica frente a células Vero e T24. Os resultados sugerem que as nanoestruturas sintetizadas neste estudo são biocompatíveis e capazes de interferir na viabilidade tumoral e, portanto, podem ser uma ferramenta poderosa no tratamento do câncer de bexiga.
Palavras chaves
Nanobastões de titanatos; Quercetina; Câncer de bexiga
Introdução
Devido a eficiência e redução dos efeitos tóxicos, a nanomedicina tem atraído atenção nos últimos anos (SONG et al., 2015). A nanotecnologia tem buscado avanços no diagnóstico e tratamento de tumores malignos, devido as propriedades físico-químicas e biológicas de diferentes nanopartículas metálicas (LI et al., 2019; TAGHIZADEH et al., 2019). A utilização de metais como ouro (PAN et al., 2018) prata (KUMAR et al., 2018) e ferro (FARSHCHI et al., 2018) para o tratamento e diagnóstico de câncer tem sido relatados. Outro metal que tem recebido atenção para a nanomedicina é o zinco, que mostrou ter seletividade para diferentes células cancerígenas como bexiga, língua e carcinoma de células escamosas (WIESMANN et al., 2019), sendo atualmente considerado “o cálcio do século XXI” (SU et al., 2019). Além das nanopartículas, materiais nanoestruturados tem sido o foco de estudos com aplicações biológicas, como por exemplo as zeólitas (TAVOLARO et al., 2016; TAVOLARO; CATALANO; TAVOLARO, 2019), materiais de carbono (GORYACHEVA et al., 2019), nanopartículas Janus (DAR; ZUBAIR IQBAL; AIGUOWU, 2019), entre outros. O desenvolvimento de diferentes morfologias como nanofilamentos (tanto de carbono como materiais inorgânicos) tem se desenvolvido nos últimos anos (MAGREZ et al., 2009) e, entre os materiais que apresentam uma variedade de possibilidades de modificação morfológica, encontram-se as nanopartículas de dióxido de titânio. Estas nanopartículas podem ser modificadas gerando nanoestruturas de titanato, como os nanotubos de titanato (titanate nanotubes - TNT) que foram descrito na literatura com potencial aplicação biológica (MIRJOLET et al., 2013). Por outro lado, estudos do nosso grupo de pesquisa mostraram que os TNT apresentaram grande capacidade de funcionalização com diferentes moléculas como silanos (MONTEIRO et al., 2016, 2018) e líquidos iônicos (MONTEIRO et al., 2017). Dentro deste contexto, a modificação destas nanoestruturas com flavonoides, como a quercetina, , é um interessante estudo, uma vez que este flavonoide apresentou resultados no tratamento de células cancerígenas gerando efeitos apoptóticos (LEI et al., 2018). O câncer é uma doença multifatorial, com incidência crescente ao longo do tempo, caracterizada pelo crescimento desordenado de células, capazes de invadir tecidos e órgãos, sendo responsável por um elevado número de morte em todo o mundo (Estimativa INCA, 2018). A quimioterapia e a radioterapia são as terapias convencionais contra o câncer, que apresentam diversos efeitos colaterais resultantes da falta de seletividade que frequentemente dificultam a erradicação completa da doença (CABRAL; BAPTISTA, 2014; SHI et al., 2017). Além disso, as células tumorais podem desencadear mecanismos de resistência aos tratamentos, reduzindo a eficácia da terapêutica (HO; PFEFFER; SINGH, 2017). Para superar esses problemas e melhorar a eficácia, moléculas com atividade antitumoral (e.g. quercetina) ancorada em nanoestruturas (e.g. nanobastões de titanato, titanate nanorods- TNR) podem ser uma interessante alternativa para terapêutica do câncer. Neste contexto, este trabalho tem como objetivo preparar nanoestruturas de titanato (nanobastões) como suporte para o flavonoide quercetina e avaliar sua resposta biológica frente a células Vero (células normais) e T24 (célula de câncer de bexiga).
Material e métodos
Materiais Dióxido de titânio (TiO2, fase anatase, JB Química, 98%), hidróxido de sódio (NaOH, Vetec, 99%) nitrato de zinco (Zn(NO3) 2, marca Dinâmica, 96 – 103%), quercetina (Sigma-Aldrich, 95%). Para o cultivo celular foram utilizados: meios RPMI e DMEM, soro fetal bovino (SFB), penicilina-estreptomicina (10.000 U/mL), anfotericina B (Fungizona), todos obtidos da Gibco. MTT [3(4,5-dimetiltiazol-2-il)-2,5- difeniltetrazólio brometo] (5 mg/mL) e meio livre de cálcio-magnésio (CMF). Síntese dos nanobastões de titanato (TNR) Para a obtenção das nanoestruturas modificadas com quercetina, a primeira etapa é a obtenção dos TNT, que segue método hidrotérmico conforme descrito na literatura (MONTEIRO et al., 2016). Os nanobastões de titanatos (TNR) foram sintetizados utilizando-se 1 g dos TNT, sendo estes calcinados em forno a 700 °C, por 4 h. A modificação dos TNR com zinco foi realizada utilizando o método de impregnação por via úmida, conforme descrito na literatura (MONTEIRO et al., 2019). Para esta síntese, 1 g de TNR foi adicionada a uma solução aquosa 0,5 mol.L-1 de Zn(NO3) 2, sob agitação magnética por 1 h à temperatura ambiente. O sólido formado foi filtrado e lavado com água destilada (até pH ≈ 7), após o sólido foi seco a 80 °C por 12 h. A preparação das nanoestruturas híbridas (i.e. TNRQc e ZnTNRQc) foi adaptada de método descrito na literatura (POPOVA et al., 2016). Em uma síntese típica, 0,5 g de nanoestrutura (TNR ou ZnTNR) e 0,5 g de quercetina (Qc) foram adicionados em 50 mL de etanol e, o sistema foi mantido sob agitação magnética à 60 °C por 1 h. A suspensão foi centrifugada e o solido lavado com água destilada (3 vezes). Após o sólido foi seco a 40 °C por 12 h e mantido em dessecador. Viabilidade celular (MTT) A viabilidade celular foi avaliada pelo ensaio de MTT. As células de câncer de bexiga humano (T24) e células normais de rim de macaco verde (Vero) foram plaqueadas a uma concentração de 5x103 células/poço e incubadas a 37 °C por 24 h. Após este período, as células foram expostas a concentrações crescentes de quercetina (Qc), TNR, TNRQc, ZnTNR e ZnTNRQc (25, 50, 100 e 200 µg/mL) por 48 h. Os ensaios foram realizados em 3 experimentos independentes em triplicata para cada amostra. Um grupo sem as nanoestruturas foi utilizado como controle do experimento. Análise estatística Os resultados obtidos nos experimentos foram expressos como média ± erro padrão e as análises estatísticas foram realizadas através de análise de variância (ANOVA) de uma via, seguida pelo pos-hoc de Tukey. Valores de p menores do que 0,05 serão considerados como indicativos de significância. Caracterizações As nanoestruturas foram caracterizadas por Microscopia Eletrônica de Transmissão (MET, FEI Tecnai G2 T20), análise termogravimétrica (TGA, TA Instruments Q600), e isotermas de adsorção-dessorção de N2 (Micromeritics Instruments Corporation, TriStar II 302).
Resultado e discussão
As imagens obtidas por MET para as nanoestruturas (TNR, ZnTNR, TNRQc e
ZnTNRQc) são apresentadas na Figura 1a. A nanoestrutura TNR apresenta uma
morfologia cristalina e homogênea, enquanto a modificação com zinco (ZnTNR)
gera uma heterogeneidade em relação aos tamanhos, além de ser possível
observar uma superfície irregular. A modificação da nanoestrutura TNR com
quercetina (TNRQc) apresenta uma morfologia similar a nanoestrutura ZnTNR,
com heterogeneidade em relação aos tamanhos e é possível ver em alguns
pontos a presença da fase orgânica. A nanoestrutura ZnTNRQc apresenta um
resultado diferente em relação aos observados, pois sua morfologia apresenta
alguns bastões com espessura inferior ao ZnTNR.
As nanoestruturas TNR e ZnTNR exibem uma etapa de degradação que podem ser
atribuídas à eliminação de água absorvida e presente na intercamada (40 –
200 °C), sendo estáveis termicamente após esta etapa (Figura 1b). Em
temperaturas mais altas, esses materiais são termicamente estáveis. Como
observado a amostra ZnTNR apresenta uma maior concentração de grupos OH,
correspondendo a uma perda de massa igual a 13%, enquanto a nanoestrutura
TNR possui um valor correspondente a 3%. A análise de TGA possibilitou
estimar a quantidade de quercetina ancorada nas nanoestruturas, sendo de 20%
para a amostra TNRQc e 30% para ZnTNR.
As isotermas de adsorção-dessorção de N2 (Figura 1c) mostram que
as nanoestruturas apresentam um comportamento de isoterma do tipo IV. Os
valores para área superficial específica foram de 19, 16, 7 e 65
m².g-1 para TNR, ZnTNR, TNRQc e ZnTNRQc, respectivamente. Este
aumento da área superficial específica da nanoestrutura ZnTNRQc quando
comparada as demais estruturas pode estar relacionado a uma modificação em
sua morfologia após suportar a quercetina, como observado nos resultados de
MET (Figura 1a).
A atividade citotóxica do TNR, TNRQc, ZnTNR e ZnTNRQc foi determinada via
MTT (Fig. 2). Os resultados permitiram observar que o TNR e ZnTNR não
promoveram nenhum efeito na viabilidade das células normais (Vero), enquanto
os nanobastões TNRQc e ZnTNRQc promoveram aumento da viabilidade. Todos
nanobastões mostraram-se biocompatíveis em modelo in vitro com
células Vero via MTT (Figura 2a). Também foi avaliado o potencial
antitumoral dessas nanoestruturas em células de câncer de bexiga humano
(Figura 2b). Foi possível observar que o TNR e ZnTNR promoveu aumento da
viabilidade tumoral, por outro lado com a adição da quercetina, os
nanobastões TNRQc e ZnTNRQc foram capazes de inibir a proliferação das
células T24 na concentração de 200 µg/mL.
O câncer de bexiga (CB) é uma das neoplasias mais comuns do trato urinário
(ESTIMATIVA INCA, 2018). As células de câncer de bexiga humano T24 são
derivadas de tumor de bexiga músculo-invasivo com elevado potencial
metastático (STELLA et al., 2010). Neste estudo, nós investigamos uma
potencial aplicação de nanobastões de titanato modificados com zinco e
quercetina no tratamento do câncer de bexiga humano. Para estabelecer uma
relação de biocompatibilidade e atividade antitumoral, a fim de determinar
uma concentração efetiva na viabilidade das células T24, realizamos o ensaio
de MTT em concentrações crescentes de nanobastões em células T24 e Vero. E
após 48 horas foi observado que os nanobastões TNR e ZnTNT foram
biocompatíveis e não promoveram redução das células tumorais, enquanto que
com os nanobastões modificados com quercetina TNRQc e ZnTNRQc foi
estabelecido uma relação de biocompatibilidade e de atividade antitumoral na
concentração de 200 µg/mL.
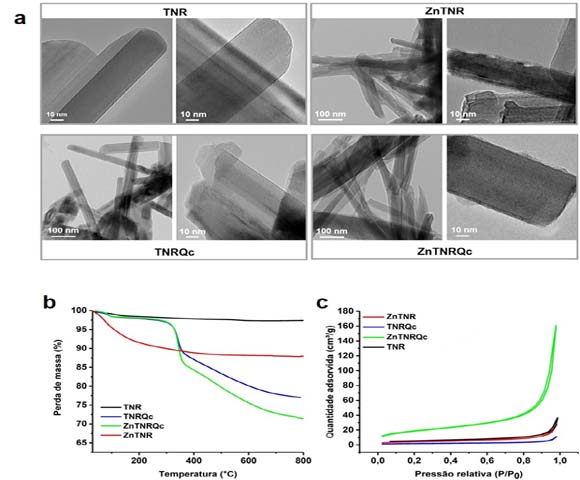
Resultados obtidos por (a) MET, (b) TGA e (c) DTG das nanoestruturas desenvolvidas.
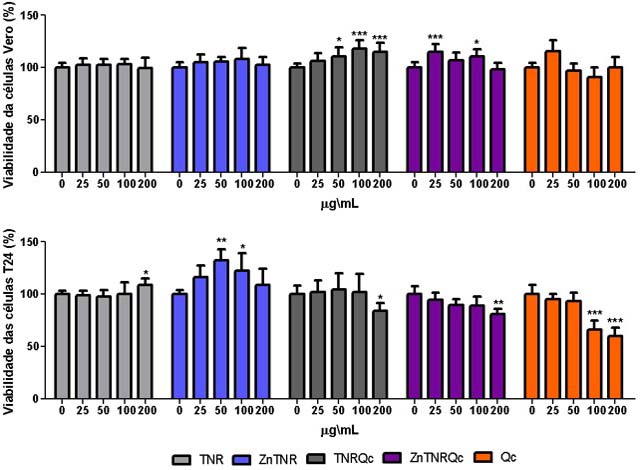
Efeito da quercetina (Qc) e dos nanobastões na viabilidade celular da linhagem Vero e T24 por meio do ensaio de MTT após 48 h.
Conclusões
Nanobastões de titanatos modificados com zinco e quercetina (ZnTNRQc) foram preparados e o seu efeito antitumoral foi avaliado. Os nanobastões modificados apresentaram maior heterogeneidade na superfície dos mesmos e diferenças de tamanhos. A área superficial específica nos nanobastões modificados aumentou quando comparado com os nanobastões puros. Os nanobastões modificados exibiram um perfil de biocompatibilidade nas concentrações avaliadas, além disso os resultados iniciais sugerem que o TNR e ZnTNR modificados com quercetina foram capazes de manter as propriedades de interesse da quercetina, atuando como agentes promotores da viabilidade celular em células normais e agente redutor da viabilidade de células do câncer de bexiga humano.
Agradecimentos
Os autores agradecem à CNPq e CAPES pelas bolsas de estudo e apoio financeiro (CNPq – Universal 2018- processo: 409272/2018-3), bem como a PUCRS pelo apoio técnico.
Referências
CABRAL, Rita M.; BAPTISTA, Pedro V. Anti-cancer precision theranostics: a focus on multifunctional gold nanoparticles. Expert Review of Molecular Diagnostics, [s. l.], v. 14, n. 8, p. 1041–1052, 2014.
DAR, Gohar Ijaz; ZUBAIR IQBAL, M.; AIGUOWU. Multifunctional biocompatible Janus nanostructures for biomedical applications. Current Opinion in Biomedical Engineering, [s. l.], v. 10, n. January, p. 79–88, 2019.
ESTIMATIVA, INCA. Incidência de câncer no Brasil. Instituto Nacional de Câncer José Alencar Gomes da Silva. [s. l.], p. 130, 2018.
FARSHCHI, Helale Kaboli et al. Green synthesis of iron nanoparticles by Rosemary extract and cytotoxicity effect evaluation on cancer cell lines. Biocatalysis and Agricultural Biotechnology, [s. l.], v. 16, n. January, p. 54–62, 2018.
GORYACHEVA, O. A. et al. Luminescent carbon nanostructures for microRNA detection. TrAC Trends in Analytical Chemistry, [s. l.], v. 119, p. 115613, 2019.
HO, BN; PFEFFER, CM; SINGH, ATK. Update on Nanotechnology-based Drug Delivery Systems in Cancer Treatment. Anticancer Research, [s. l.], v. 37, n. 11, 2017.
KUMAR, Ponnuchamy et al. Cytotoxicity of phloroglucinol engineered silver (Ag) nanoparticles against MCF-7 breast cancer cell lines. Materials Chemistry and Physics, [s. l.], v. 220, n. September 2017, p. 402–408, 2018.
LEI, Cing Syuan et al. Effects of quercetin combined with anticancer drugs on metastasis-associated factors of gastric cancer cells: in vitro and in vivo studies. Journal of Nutritional Biochemistry, [s. l.], v. 51, p. 105–113, 2018.
LI, Kunmeng et al. Advances in the application of upconversion nanoparticles for detecting and treating cancers. Photodiagnosis and Photodynamic Therapy, [s. l.], v. 25, n. December 2018, p. 177–192, 2019.
MAGREZ, Arnaud et al. Cellular toxicity of TiO2-based nanofilaments. ACS Nano, [s. l.], v. 3, n. 8, p. 2274–2280, 2009.
MIRJOLET, C. et al. The radiosensitization effect of titanate nanotubes as a new tool in radiation therapy for glioblastoma: A proof-of-concept. Radiotherapy and Oncology, [s. l.], v. 108, n. 1, p. 136–142, 2013. Disponível em: <http://dx.doi.org/10.1016/j.radonc.2013.04.004>
MONTEIRO, W. F. et al. Preparation of Modified Titanate Nanotubes and Its Application in Polyurethane Nanocomposites. Macromolecular Symposia, [s. l.], v. 368, n. 1, p. 93–97, 2016.
MONTEIRO, W. F. et al. CO2 conversion to propylene carbonate catalyzed by ionic liquid containing organosilane groups supported on titanate nanotubes/nanowires. Applied Catalysis A: General, [s. l.], v. 544, p. 46–54, 2017.
MONTEIRO, Wesley F. et al. Modified Titanate Nanotubes for the Production of Novel Aliphatic Polyurethane Nanocomposites. Polymer Composites, [s. l.], p. 1–9, 2018.
MONTEIRO, Wesley F. et al. Modified titanate nanotubes for the production of novel aliphatic polyurethane nanocomposites. Polymer Composites, [s. l.], v. 40, n. 6, p. 2292–2300, 2019.
PAN, Yue et al. Metal-Based Hybrid Nanoparticles as Radiosensitizers in Cancer Therapy. Colloids and Interface Science Communications, [s. l.], v. 23, n. January, p. 45–51, 2018.
POPOVA, Margarita et al. Experimental and theoretical study of quercetin complexes formed on pure silica and Zn-modified mesoporous MCM-41 and SBA-16 materials. Microporous and Mesoporous Materials, [s. l.], v. 228, p. 256–265, 2016.
SHI, Jinjun et al. Cancer nanomedicine: progress, challenges and opportunities. Nature Reviews Cancer, [s. l.], v. 17, n. 1, p. 20–37, 2017.
SONG, Guosheng et al. Core-Shell MnSe@Bi2Se3 Fabricated via a Cation Exchange Method as Novel Nanotheranostics for Multimodal Imaging and Synergistic Thermoradiotherapy. Advanced Materials, [s. l.], v. 27, n. 40, p. 6110–6117, 2015.
STELLA, Joséli et al. Differential ectonucleotidase expression in human bladder cancer cell lines. Urologic Oncology: Seminars and Original Investigations, [s. l.], v. 28, n. 3, p. 260–267, 2010. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S1078143909000362>
SU, Yingchao et al. Zinc-Based Biomaterials for Regeneration and Therapy. Trends in Biotechnology, [s. l.], v. 37, n. 4, p. 428–441, 2019.
TAGHIZADEH, Saeed et al. Gold nanoparticles application in liver cancer. Photodiagnosis and Photodynamic Therapy, [s. l.], v. 25, n. January, p. 389–400, 2019.
TAVOLARO, Palmira et al. Zeolite scaffolds for cultures of human breast cancer cells. Part II: Effect of pure and hybrid zeolite membranes on neoplastic and metastatic activity control. Materials Science and Engineering C, [s. l.], v. 68, p. 474–481, 2016.
TAVOLARO, Palmira; CATALANO, Silvia; TAVOLARO, Adalgisa. Anticancer activity modulation of an innovative solid formulation of extra virgin olive oil by cultured zeolite scaffolds. Food and Chemical Toxicology, [s. l.], v. 124, n. November 2018, p. 139–150, 2019.
WIESMANN, Nadine et al. Zinc overload mediated by zinc oxide nanoparticles as innovative anti-tumor agent. Journal of Trace Elements in Medicine and Biology, [s. l.], v. 51, n. December 2017, p. 226–234, 2019.









