Novos complexos de platina (II) conjugados e análogos a O-glicosídeos: Síntese, caracterização estrutural e atividade antitumoral
ISBN 978-85-85905-25-5
Área
Química Inorgânica
Autores
Lima, L.M.A. (UFRPE) ; Santos, M. (UFPE) ; Albuquerque, L. (UFRPE) ; Aguiar, J. (UFPE) ; Silva, W.E. (UFRPE) ; Belian, M.F. (UFRPE)
Resumo
Fármacos a base de platina (II) são utilizadas como estratégia terapêutica no tratamento de diversos tipos de câncer, entretanto, os efeitos adversos e fenômenos de resistência são limitantes para o seu uso continuado, e por isso, torna-se necessário a síntese de novas estratégias terapêuticas,com destaque para complexos de platina com carboidratos. Nesse trabalho foi sintetizado dois complexos de Pt(II) conjugados e análogos a um O-glicosídeo 2,3-insaturado que foram caracterizados utilizando-se técnicas espectroscópicas. Além disso, esses compostos foram testados em ensaios biológicos, através do implante do carcinoma de erlich em camundongos,com o objetivo de avaliar a eficácia terapêutica de inibição frente à esse tumor durante o tratamento e comparar os resultados com a cisplatina.
Palavras chaves
Complexos de platina (II); glicosídeos; atividade antitumoral
Introdução
Desde o advento do uso de compostos inorgânicos a base de metal que possuem atividade biológica de extrema importância para a terapia de várias doenças, área conhecida como bioinorgânica, a comunidade científica tem sido cada vez mais incentivada a sintetizar novos fármacos a base de metais, com destaque para os complexos de platina (II). Os estudos de complexos metálicos para o uso na quimioterapia do câncer tiveram um grande crescimento depois da descoberta acidental da cis-diaminodicloroplatina (II), mais conhecida como cisplatina (FLOREA e BÜSSELBERG, 2011). Hoje, 35 anos após esta descoberta, mais de 50% dos quimioterápicos são à base de platina, a exemplo da carboplatina, nedaplatina e oxaliplatina. Entretanto, apesar da ação benéfica destes compostos em inibir parcial ou total o crescimento das células cancerígenas, sua eficácia é limitada por uma série de efeitos colaterais, tais como nefrotoxicidade, neurotoxicidade, ototoxicidade, toxicidade gastrointestinal, ineficácia ação contra alguns tipos de câncer, e principalmente resistência celular. Na busca de diminuir os efeitos adversos atrelados à esses fármacos de platina, novos derivados foram surgindo visando diminuição da toxicidade e aumento da ação antineoplásica com destaque para complexos de platina com carboidratos (MIKATA et al., 2011). A incorporação destes ligantes visa evitar os efeitos secundários desvantajosos pelo fato de serem moléculas menos tóxicas e, por conseguinte, obter moléculas com melhores chances para aplicações farmacológicas. Devido à estas propriedades, a química de carboidratos tem crescido como uma das linhas de pesquisa mais promissoras na farmacologia especialmente os O- glicosídeos-2,3-insaturados. Os O-glicosídeos-2,3 insaturados podem ser preparados através de um rearranjo alílico do glical na presença de um álcool e um ácido de Lewis como catalisador (FREITAS FILHO et al., 2011). Esse rearranjo alílico é atualmente conhecido como rearranjo de Ferrier (FERRIER e PRASAD, 1969). Nesta perspectiva, a síntese de complexos de platina com O-glicosídeos merece considerável atenção, já que os poucos relatos demonstram baixa toxicidade e a possibilidade de administração por via oral, devido a sua alta solubilidade. Diante disso, o presente trabalho tem como objetivo a síntese de novos complexos de platina análogos e coordenados a glicosídeos 2,3-insaturados para avaliação do efeito antitumoral em modelos experimentais animais.
Material e métodos
Primeiramente, o 3,4,6-tri-O-acetil-D-glical foi obtido a partir de uma reação “one-pot” após 4 etapas sequenciais, via ultrassom, seguido pelo método de Regueira et al., 2015. Em seguida, foi sintetizado o 3,6-dito-1- octanol-4,6-di-O-acetil- α-D-eritropiranosídeo (glico) utilizando o álcool 3,6-ditio-1,8-octanodiol como aglicona, seguindo o método de Toshima, no qual utiliza montmorillonita K-10 como catalisador, em diclorometano seco. A reação foi mantida em sistema de refluxo, por 3 horas a 50°C. A mistura enantiomérica (α:β) foi purificada por coluna cromatográfica de sílica-gel usando o sistema Hex:AcOEt (8:2). De posse dos ligantes, foi feita a síntese dos complexos de platina (II) codificados como cis-[Pt(Cl)2(Ditia)](A) e cis-[Pt(glico)2(OH)2] (B). Em um béquer de 50 mL adicionou-se 0,1 g (0,24 mmol) de K2[PtCl4], 5 mL de água destilada e 0,044g (0,24 mmol) de 3,6- Ditia-1,8-octanodiol para obtenção do complexo (A) e adicionou-se 0,1 g (0,24 mmol) de K2[PtCl4], 5 mL de água destilada e g (0,48 mmol) de glico para obtenção do complexo (B). Ambos os complexos foram deixados sob agitação por 6 horas, posteriormente a água foi liofilizada e reservado para as caracterizações. Os complexos foram caracterizados através das técnicas de espectroscopia de absorção eletrônica, espectroscopia de infravermelho, espectrometria de massas por ionização elétron-spray, RMN 1H e 13C e voltametria cíclica. Todos os ensaios biológicos foram aprovados pelo Comitê de ética nº. Para esse ensaio foram utilizados camundongos Swiss machos (peso 30 ± 2g) provenientes do Biotério do Departamento de Antibióticos da UFPE. As doses terapêuticas para os compostos Glico (ligante livre) (3,5 mg kg-1), cis-[Pt(glico)2(OH)2] (5,3 mg kg-1) e cis-[Pt(Cl)2(ditia)] e (3 mg kg-1) foram estabelecidas segundo os critérios de quantidade molar da platina em todos os compostos fosse a mesma. A dosagem da cisplatina (1mg kg-1), utilizada no procedimento para o grupo padrão (fármaco já implementado no mercado), foi determinada para uma faixa onde ocorresse a menor manifestação dos efeitos colaterais. O grupo controle negativo recebeu solução salina 0,9%. Os animais utilizados para o teste antitumoral foram separados em grupos de oito em seguida foram pesados e inoculados, na região axilar, com o carcinoma de Ehrlich. Após 24 horas os animais iniciaram o tratamento recebendo doses diárias (7 dias) via intraperitoneal. No último dia, os tumores foram pesados e em seguida foi calculado a inibição do crescimento tumoral dos grupos tratados em relação ao controle. O percentual de inibição do crescimento tumoral (IT) foi calculado pela fórmula: IT (%) = [(A-B)/A] x 100. Onde: A = média dos pesos dos tumores no grupo controle; B = média dos pesos dos tumores nos grupos tratado. Para verificação da ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados através de análise de variância ANOVA, seguida pelo teste de Bonferroni, com IC=95%.
Resultado e discussão
O 3,4,6-tri-O-acetil-D-glical foi sintetizado com rendimento de 85%.Rf =
0.59 Hex:AcOEt (8:2) ; ponto de fusão 53–54 °C (Lit.24 52–53 °C); FTIR (cm-
1) :1650, 1743, 2900
RMN 1H (400 MHz, CDCl3): δ (ppm) = 6,65 (dd,1H, H1); 5,2 (d, 1H2); 4,3
(m,1H, H3); 4,85 (dd, 1H H4); 5,05 (t, 1H H5); 4,1 (dd, 2H, H6 e H6’); 2,0
(s,3H, OCH3).
RMN 13C (75 MHz, APT, CDCl3): δ = 169, 145, 98, 73.3; 60,6; 60.6; 20.
O 3,6-dito-1-octanol-4,6-di-O-acetil- α-D-eritropiranosídeo foi sinteizado
com rendimento de 79,8%; [α]D25 +43,9 (c 1.00, CH2Cl2); Rf = 0,45
CH2Cl2:AcOEt (9:1); FTIR (cm-1) : 3468; 2622; 2252; 1742; 1231;1037.
RMN 1H (400 MHz ,CDCl3) δ (ppm)= 6,05 – 5,78 (m, 2 H); 5,37 – 5,26 (m, 1 H);
5,10 – 4,98 (m, 1 H); 4,28 – 4,15 (m, 2 H); 4,11 (ddd, J = 2.3, 5.2, 9.7 Hz,
1 H); 3,92 (td, J = 6.7, 10.5 Hz, 1 H); 3,71 (td, J = 6.7, 10.2 Hz, 1 H);
2,84 – 2,68 (m, 4 H); 2,15 – 1,97 (m, 6 H).
RMN 13C (75 MHz, APT, CDCl3): δ (ppm)= 171.6; 171.3; 130.2; 128.3; 95.1;
69.3; 67.9; 66; 63.8; 33.5; 32.8; 21.8; 21.7.
Os complexos de platina (II) cis-[Pt(Cl)2(ditia)] e cis-[Pt(glico)2(OH)2]
foram sintetizados de acordo com os esquemas 1 e 2, respectivamente, com
bons rendimentos (69-82%) sendo possível obter compostos sólidos de
coloração amarela, solúveis em água e com geometria “cis”, cujas estruturas
foram elucidadas através das técnicas de análise elementar, absorção
eletrônica na região do visível, FTIR, RMN 1H e 195Pt, ESI/MS de alta
resolução e análise térmica. A partir dos dados de espectroscopia de
absorção eletrônica, observa-se que o composto cis-[Pt(Cl)2(ditia)]
apresenta uma banda de alta intensidade proveniente de transferência de
carga ligante-metal (LMCT) em 310 nm, e uma banda da transição do campo
cristalino, caracterizadas pelo desdobramento dos orbitais d do íon metálico
frente às interações eletrostáticas dos ligantes( d-d ) em 377 nm,
característica de complexos coloridos, visto que a cor complementar do
amarelo é o violeta (370-450 nm). O composto cis-[Pt(glico)2(OH)2] apresenta
uma banda de alta intensidade com ƛ=365 nm característico da transição d-d
do respectivo complexo. Uma vez que é notório as mudanças do perfil das
bandas dos complexos de platina em relação ao precursor (K2PtCl4) esse fato
indica que houve modificação eletrônica e portanto, os complexos foram
formados, conforme ilustrado na Figura 1. Além disso, no espectro de FTIR do
complexo cis-[Pt(glico)2(OH)2] (em preto, Figura 1) observam-se bandas
características que indicam a formação desses compostos, por exemplo,
estiramento ν(C=O) em 1734cm-1, ν(C=C) em 1370cm-1, ν(O-H) em 3458 cm-1,
ν(C-S) em 1231 cm-1, além do aparecimento de dois picos de baixa intensidade
em 496 cm-1 e 600 cm-1 característico de ligação Pt-S na posição “cis”. No
espectro FTIR do composto cis-[Pt(Cl)2(ditia)] (em azul, Figura 1),
observam-se estiramentos ν(CH) em 2929 e 2870 cm-1, ν(O-H) em 3423cm-1
referente ao grupamento OH livre, com destaque para as bandas em 496 e
565cm-1 característico de ligação Pt-S em posição “cis”. Além disso, foi
utilizado a técnica FAR e constatou a presença de um estiramento em 320cm-1
característico de ligação Pt-Cl na posição cis. Os dados de RMN 1H e 13C
sugerem a formação dos compostos a partir da concordância entre os sinais em
relação ao ligante livre, entretanto, observa-se alguns deslocamentos de
picos em relação ao ligante livre pela perturbação eletrônica causada pelo
metal (Pt+2).
As propriedades eletroquímicas dos complexos de platina sintetizados foram
investigadas por voltametria cíclica utilizando eletrodo de carbono vítreo.
Dadas as semelhanças estruturais, efetuou-se um estudo eletroquímico
comparativo entre a CDDP, cis-[Pt(glyco)2(OH)2], cis-[Pt(Cl)2(Ditia)]. O
eletrólito suporte foi uma solução KCl 0,1 mol.L-1 e a concentração dos
compostos platínicos foi de 1mg/mL. Eletrodos de carbono vítreo (ɸ = 2 mm),
Ag/AgCl (KCl 3,0 mol L-1) e bastão de carbono foram utilizados como
eletrodos de trabalho, referência e auxiliar, respectivamente. Antes das
varreduras as soluções foram deaeradas por 10 minutos utilizando nitrogênio
(N2) 99,999%. As varreduras foram iniciadas partindo de 0,0 V em direção a
potenciais catódicos até -1,2 ou -1,0 V e, posteriormente, até potenciais
anódicos até 1,2 V, retornando a 0,0 V. A velocidade de varredura foi de 50
mV s-1. Pode-se observar um sinal catódico no branco provavelmente devido a
presença de oxigênio na solução mesmo após o contato com N2.
Através dos voltamogramas cíclicos verifica-se que a redução do cis-
[Pt(glyco)2(OH)2] inicia-se no potencial catódico -1,02 V, enquanto que os
complexo CDDP e cis-[Pt(Cl)2(Dithia)] possuem potencial de redução de
-0,9701V e -1,002V, respectivamente, ou seja, o complexo cis-
[Pt(glyco)2(OH)2] requer um potencial catódico bem mais negativo para se
reduzir. Tal fato pode ser atribuído à natureza do ligante orgânico, que
confere maior estabilidade à platina dificultando assim sua redução.
(MEBSOUT et al, 1988). Assim uma maior estabilização desta classe de
complexos pode estar associada à redução dos efeitos colaterais uma vez que
sua menor capacidade em reduzir-se contribui para uma redução dos danos
oxidativos e, conseqüentemente, diminuição dos efeitos nefrotóxicos que
podem surgir pela administração dos fármacos a base de platina.
A avaliação da massa tumoral extraída dos camundongos inoculados com o
carcinoma de Ehrlich demonstraram percentual de inibição semelhantes entre o
controle positivo (cisplatina) e os complexos de platina sintetizados. A
cisplatina apresentou 58,9% de inibição, enquanto os complexos cis-
[Pt(Cl)2(ditia)] e cis-[Pt(glico)2(OH)2] apresentaram percentual de 57,3% e
58,8%, respectivamente, conforme Figura 2. A análise estatística destes
dados indica não haver diferença significativa entre os complexos e o
controle positivo. Embora os compostos glicosídicos apresentem atividade
tumoral já relatada na literatura, a presença da platina se mostrou
determinante para ação antitumoral de acordo com os compostos testados, uma
vez que o ligante livre "glico" apresentou inibição tumoral de apenas
37,69%, com diferença estatística significativa em relação a cisplatina. A
inibição do crescimento dos tumores pôde ser analisada macroscopicamente e
observou-se que além de reduzidos seus tamanhos, os aspectos pálido e não
vascularizados dos tumores indicam comprometimento tumoral.
Esses dados, sugerem que os compostos de platina (II) sintetizados nesse
trabalho possuem atividade antitumoral in vivo.
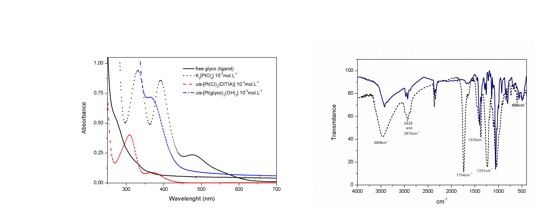
Espectros de aborção eletrônica do precursor e dos complexos em solução aquosa 10-3mol.L-1, e espectros de FTIR dos complexos, respectivamente
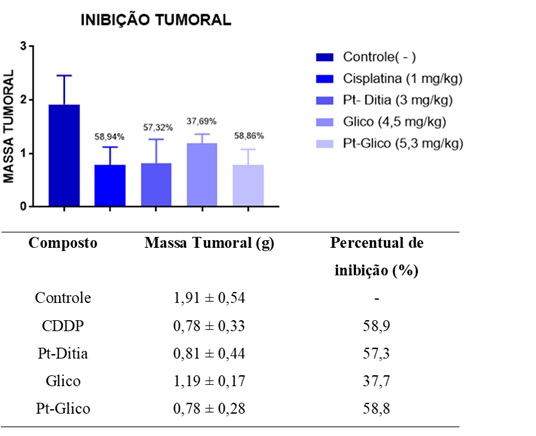
Os dados estão expressos como média ± desvio padrão de 5 animais. (* representa p<0,05) comparado com o grupo controle negativo através de ANOVA.
Conclusões
As técnicas espectroscópicas utilizadas sugerem a formação dos complexos de platina (II) sintetizados nesse trabalho, e os resultados obtidos a partir dos ensaios biológicos sugerem que ambos os complexos apresentaram atividade antitumoral frente ao carcinoma de Erlich, além disso, o complexo obtido a partir do O-glicosídeo 2,3-insaturado cis-[Pt(glyco)2(OH)2], apresentou inibição antitumoral superior ao seu análogo cis-[Pt(Cl)2(Ditia].
Agradecimentos
À CAPES e CNPq pelo auxílio concedido. À Prof. Jaciana Aguiar pelo suporte essencial nos testes biológicos. À Thiago Selva pelas contribuições na Voltametria Cíclica.
Referências
FERRIER, R. J.; PRASAD, N. Unsaturated Carbohydrates. Part IX. Synthesis of 2,3-Dideoxy-_-D-erythro-hex-2-enopyranosides from Tri-O-acetyl-D-glucal.Journal Chemical Society. no 4, pp. 570–575, 1969.
FILHO, J. R. FREITAS, SRIVASTAVA, M. R.; SORO, Y.; COTTIER L. e DESCOTES, G. Synthesis of new 2,3-unsaturated o-glycosides through ferrier rearrangement. Journal of Carbohydrate Chemistry, no 20, pp. 561-568, 2011.
FLOREA A.M and BÜSSELBERG D. “Cisplatin as an Anti-Tumor Drug: Cellular Mechanisms of Activity, Drug Resistance and Induced Side Effects”. Cancers, no. 3, pp.1351-1371, 2011.
GERAN, et. al. Protocols for screening chemical agents and natural products against animal and other biological systems, 3ª edition. Cancer chemotherapy Reports, no 3 pp.1-103, 1972.
MIKATA, Y., SHINOHARA, Y., YONEDA K., NAKAMURA, Y., BRUDZINSKA, I., TANASE, T., KITAYAMA, T., TAKAGI, R., OKAMOTO,T., KINOSHITA, I., DOE, M., ORVIGF, C. AND YANOC,S. Unprecedented Sugar-Dependent In Vivo Antitumor Activity of Carbohydrate-Pendant cis-Diamminedichloroplatinum(II) Complexes. Bioorganic & Medicinal Chemistry Letters, vol.11, pp. 3045–3047, 2001.
Mebsout, F.; Kauffmann, J.M.; Patriarche, G.J.; Redox behaviour of cis-platin at solid electrodes : carbon paste, platinum. J. Pharm. Biom. Anal. 6, 441-448, 1988.
REGUEIRA, J. L. L. F; DANTAS, C. R.; FREITAS, J.R. F.; SILVA, A. J. F. S.;FILHO, J. R. F.; MENEZES, P. H. Synthesis, no 48, pp. A–J, 2016.









