Síntese, caracterização e estudo da atividade antitumoral de um novo complexo de rutênio (III)
ISBN 978-85-85905-25-5
Área
Química Inorgânica
Autores
Andrade, M.H.P.S. (UFRPE) ; Belian, M.F. (UFRPE) ; Silva, W.E. (UFRPE)
Resumo
Este trabalho objetiva o desenvolvimento de um candidato a fármaco baseado em rutênio (III), com alta atividade antitumoral e baixos efeitos colaterais. O complexo sintetizado foi caracterizado e submetido a testes de atividade antitumoral (in vivo), utilizando modelo animal de camundongos Swiss. No espectro de infravermelho do complexo é possível observar picos característicos dos sítios de coordenação (O-H, C=O, C-O) sendo deslocados para menores números de onda, indicando coordenação com o metal. No espectro de absorção eletrônica observou-se uma perturbação eletrônica em relação ao ligante livre e coordenado. O complexo mostrou-se menos tóxico que a cisplatina, e obteve 76,60% de inibição tumoral.
Palavras chaves
Câncer; complexos de rutênio; fármacos antitumorais
Introdução
Segundo a Organização Mundial de Saúde (OMS) (ONUBR, 2017) mais de 14 milhões de pessoas desenvolvem câncer todos os anos, e esses números devem subir para 21 milhões de pessoas em 2030, se configurando como uma epidemia mundial. O câncer é caracterizado pelo crescimento celular desordenado que gera acúmulo em tecidos e órgãos. Pode ser causado por fatores externos como má alimentação, exposição a radiações nocivas ao corpo, tabagismo, entre outras; e por fatores genéticos. O tratamento do câncer pode ser realizado através de cirurgia, radioterapia e/ou quimioterapia (INCA, 2018). Os fármacos quimioterápicos comercializados atualmente trazem muitos efeitos colaterais ao paciente, com isso, surge a necessidade de pesquisar novos fármacos para o controle da doença, com maior atividade antitumoral e menos efeitos colaterais para melhoria da qualidade de vida dos pacientes. Neste sentido, têm-se dado atenção aos complexos de rutênio (III) devido à sua menor toxicidade em relação a outros fármacos a base de metal. Os baixos efeitos colaterais dos complexos de rutênio se devem a semelhanças bioquímicas e estruturais dos mesmos com os complexos de ferro, componente natural do meio biológico, tendo o organismo uma forma natural de redução de níveis de ferro a partir da produção de proteínas captadoras de ferro (transferrina e albumina), o que pode ser também atribuído como mecanismo similar para redução de altos níveis de rutênio no sangue, pois essas proteínas captam o rutênio e fazem com que esse adentre no interior celular (HOTZE; KARIUKI; HANNON, 2006). Assim, este trabalho tem como objetivo o desenvolvimento de um novo candidato a fármaco que apresente maior atividade antitumoral e redução dos efeitos colaterais quando comparado as drogas comercializadas atualmente.
Material e métodos
Foi realizada a síntese do complexo de rutênio (III), utilizando como precursor RuCl3.xH2O e o ligante previamente sintetizado. O produto obtido foi purificado e seco a vácuo até obtenção de um produto sólido. A caracterização foi feita por espectroscopia de absorção eletrônica a fim de verificar o ambiente químico do íon Ru3+ coordenado ao ligante de interesse. O equipamento utilizado foi o espectrofotômetro UV-Vis, modelo 8453 da Agilent, responsável por varredura de 200-800 nm. As análises pertencentes ao estudo na região do infravermelho, foram feitas através da utilização de pastilha de KBr em equipamento de modelo FT – IR Spectrometer que compreendeu a região de 4000 a 400 cm-1. As curvas de TG foram obtidas no equipamento de modelo TGA 50/50 da Shimadzu, utilizando-se cadinho de platina, gás de arraste de Nitrogênio e razão de aquecimento de 10°C/min, desde a temperatura ambiente até 800°C. Após a caracterização foram realizados testes in vivo utilizando o modelo animal de camundongos Swiss (Mus musculus) para avaliar o poder antitumoral e a toxicidade desses compostos. Para o teste de toxidade aguda, os ensaios foram realizados segundo o protocolo da ANVISA(2013), e para categorização da toxidade do composto foi utilizado o protocolo da OECD 423. Já para o teste antitumoral células tumorais de carcinoma de Ehrlich foram implantadas nos camundongos que foram divididos em três grupos: controle negativo, no qual foi administrado soro fisiológico nos animais; controle positivo, onde foi administrado cisplatina e um grupo no qual foi administrado o complexo sintetizado e caracterizado. No sétimo dia de experimento foi feito a extirpação do tumor, a coleta de sangue para hemograma e a coleta de órgãos para pesagem, comparação e verificação das condições dos mesmos.
Resultado e discussão
A partir das análises de absorção eletrônica do ligante livre e do complexo percebe-se uma nova banda para o complexo em 300 nm que implica na mudança da nuvem eletrônica em relação ao ligante livre e coordenado, sugerindo que o ligante foi efetivamente coordenado ao rutênio.
Através da espectroscopia de infravermelho foi possível verificar a presença de grupamentos funcionais (OH, C=O, C-O) e sugerir possíveis coordenações do ligante ao centro de rutênio, baseado nos deslocamentos e mudanças de intensidade de bandas.
Através da curva de TG do ligante livre e do composto sintetizado observou-se uma mudança significativa entre a duas curvas, o que pode corroborar para a confirmação de formação do complexo.
No teste de toxidade aguda o composto testado pôde ser classificado como categoria 4 e o composto metálico que atualmente é comercializado no mercado farmacológico, cisplatina, é classificado como categoria 1. Portanto, a categoria em relação à toxidade aguda do composto sintetizado neste trabalho é superior quando comparado a um composto padrão que já é utilizado, indicando assim, que o mesmo é menos tóxico que a cisplatina e consequentemente a aplicação do mesmo trará menos efeitos colaterais aos pacientes.
No teste de atividade antitumoral obteve-se um percentual de inibição tumoral de 76,6%, ultrapassando assim, o percentual de inibição do quimioterápico a base de metal comercializado atualmente. Além disso, é possível observar uma diminuição dos tumores dos animais tratados com o complexo em relação ao controle negativo (soro fisiológico) e percebe-se uma diferença de coloração, onde no controle os tumores são mais avermelhados, indicando alta vascularização, já no grupo tratado, os tumores estão mais pálidos, indicando baixo fornecimento de sangue ao tumor.
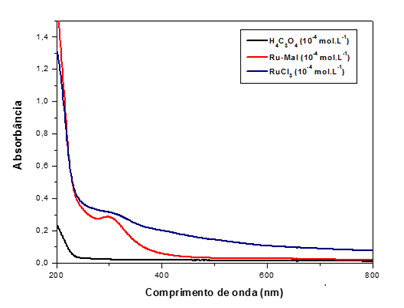
Na Figura são apresentados os espectros de absorção eletrônica do ácido malônico, do cloreto de rutênio (III) e do complexo "Ru-Mal" sobrepostos.
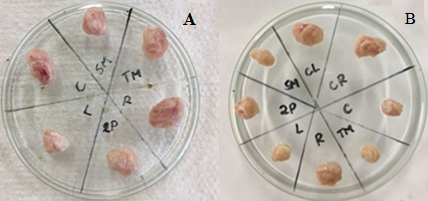
Tumores retirados após a eutanásia do grupo controle (A), tratados com soro fisiológico, e dos animais tratados com o composto Ru-Mal (B).
Conclusões
As metodologias apresentadas se mostraram bastantes eficazes na síntese de um novo candidato a fármaco a base de rutênio. Os dados de toxicidade aguda dos composto sintetizado nos permitiram classificar as drogas como de baixa toxicidade. O estudo da atividade antitumoral in vivo demonstrou que o complexo tem atividade frente ao carcinoma de Erlich e apresenta um percentual de inibição tumoral de 76,6%.
Agradecimentos
A FACEPE e ao CNPq pelo fomento recebido, e a CAPES pela bolsa concedida.
Referências
HOTZE, A. C. G.; KARIUKI, B. M.; HANNON, M. J. Dinuclear Double-Stranded Metallosupramolecular Ruthenium Complexes: Potential Anticancer Drugs. angew. chem., v. 118, p. 4957–4960, 2006.
INCA - Instituto Nacionalde de Câncer José Alencar Gomes da Silva.O que é o câncer? Disponível em: <http://www.inca.gov.br/conteudo_view.asp?id=322.> Acesso em: 05 ago. 2019
ONUBR - Nações Unidas do Brasil. OMS: câncer mata 8,8 milhões de pessoas anualmente no mundo. 2017. Disponível em: <https://nacoesunidas.org/oms-cancer-mata-88-milhoes-de-pessoas-anualmente-no-mundo/> Acesso em: 25 jul. 2019









