Decomposição do peróxido de hidrogênio (H2O2) por um complexo de cobalto(II) com um ligante do tipo base de Schiff
ISBN 978-85-85905-25-5
Área
Química Inorgânica
Autores
Silva, F.P. (UFRJ) ; Dionízio, T.P. (UFRJ) ; Casellato, A. (UFRJ)
Resumo
O peróxido de hidrogênio (H2O2) é um reagente extremamente versátil. Decorrente de seu extensivo uso, a preocupação ambiental leva ao estudo de catalisadores que o decomponham, uma vez que sua degradação na natureza ocorre a uma velocidade baixa. Dentre as opções disponíveis, destaca-se a atuação da metaloenzima catalase, bem como de complexos ou compostos de coordenação que imitem sua função. Neste estudo, são mostradas a síntese, caracterização e investigação da atividade de um complexo de cobalto(II), na degradação do poluente. A partir dos testes qualitativos do complexo na reação de degradação de H2O2 foi possível sugerir que este seja um catalisador promissor, possuindo atividade como mimético à catalase.
Palavras chaves
catalase; compostos de coordenação; peróxido de hidrogênio
Introdução
O peróxido de hidrogênio (H2O2) é metabólito natural em muitos organismos vivos, formado na água através da luz solar em presença de material orgânico, assim como produto da atividade enzimática e que, quando decomposto, gera oxigênio molecular e água (MATTOS et al., 2003; RODWELL, 2017). Extremamente versátil, como oxidante (E0= 1,77 V) é superior ao permanganato de potássio (E0= 1,70 V) e ao cloro (E0= 1,40 V), podendo atuar como agente redutor (E0= -0,15 V), a depender do pH (MATTOS et al., 2003). Dentre as inúmeras aplicações que o H2O2 pode ter, destacam-se a síntese de medicamentos, higiene, bem como seu emprego na etapa de branqueamento nas indústrias de papel e têxtil (MATTOS et al., 2003; RODWELL, 2017; CHEN, 2012), tornando necessária a sua remediação, devido ao extensivo uso. A degradação do H2O2 pode ocorrer à temperatura ambiente com uma velocidade de reação baixa, requerendo o uso de catalisadores. Como opção, as catalases são atraentes (MATOS, 2011), bem como complexos ou compostos de coordenação modelos para esta enzima, conforme tem sido abordado em vários trabalhos (MATOS, 2011; IBRAHIM et al., 2014; KUPCEWICZ et al., 2012; NORITAKE et al., 2013; PIRES et al., 2015). Assim, o presente trabalho traz os resultados para a síntese, caracterização e ensaios qualitativos de verificação da decomposição de H2O2 por um complexo de cobalto(II).
Material e métodos
O complexo (CoNO2L) foi obtido utilizando um ligante (NO2L) preparado adicionando- se 5-nitrosalicilaldeído, solubilizado em metanol, a uma solução de etanolamina (1:1) e que, ao serem misturados, ficaram sob agitação magnética por 2 horas. Fez-se, então, a adição de uma solução metanólica de perclorato de cobalto(II) hexahidratado à anterior (1:2) que permaneceu sob agitação magnética por mais 2 horas. A solução foi filtrada e mantida em repouso. A caracterização foi feita por espectroscopia no infravermelho (IV), ultravioleta-visível (UV-Vis) e voltametria cíclica (VC). As análises por VC foram realizadas em atmosfera de N2 em uma solução metanólica de TBAPF6 0,05 mol L-1, utilizando uma cela voltamétrica de 3 eletrodos: de referência (calomelano), de trabalho (carbono vítreo) e um contra eletrodo de platina. Para verificar a atividade do CoNO2L na decomposição do H2O2, bem como qual era a influência do pH nesta degradação, foram realizados ensaios onde eram adicionados a uma cubeta volumes de 1,50 mL de solução tampão biológico nos pHs 3,5, 7,0 ou 9,5 (0,10 mol L-1), 1,20 mL de água, 0,20 mL de solução do CoNO2L (10-3 mol L-1) e 0,10 mL de uma solução de H2O2 (10,07 mol L-1). Em outra rodada de experimentos, foram realizados novos ensaios na faixa de pH onde mostrou-se mais ativo variando o pH de 0,5 em 0,5.
Resultado e discussão
Caracterização do complexo: O espectro no IV (Figura 1)
mostrou bandas características dos grupos funcionais presentes no
NO2L, com algum deslocamento. Uma banda em 1662
cm-1 no espectro do NO2L foi atribuída à νC=N, já para
o CoNO2L esta deslocou-se para 1653 cm-1. A νC-
Ofenol em 1222 cm-1 no NO2L deslocou-se
para 1291 cm-1 no CoNO2L. A δO-Hfenol no
NO2L em 684 cm-1 não foi encontrada no
CoNO2L, sugerindo coordenação do oxigênio do fenol ao metal na
forma desprotonada. Os espectros eletrônicos (Figura 2) do
CoNO2L em solução apresentaram bandas entre 267 e 360 que foram
atribuídas às transições intraligantes (TIL) π–π* e transferência de carga
do ligante para o metal (TCLM). Entretanto, só foi possível observar as
bandas d-d no espectro em estado sólido, em 561 e 731 nm, além das bandas de
TIL e TCLM em 251 e 341 nm, respectivamente. Através da VC verificou-se dois
picos de redução nos voltamogramas do NO2L e do
CoNO2L, em torno de -0,80 V e -1,30 V, provenientes do próprio
ligante. Além disso, a ocorrência de um pico de oxidação em 0,25 V no
complexo pode ser atribuída ao processo Co(II)-Co(III). Atividade na
decomposição do H2O2: Da primeira etapa de testes,
verificou-se qualitativamente, através da formação de bolhas, que o
CoNO2L atuava na degradação do H2O2 em
ambos os pHs, porém mais ativo em pH 9,5 e, por esse motivo, outro ensaio
com pHs entre 7,5 e 10,0 foi realizado, onde percebeu-se degradação do
H2O2 mais ativamente em pHs acima de 9,0, sendo
mimético à catalase.
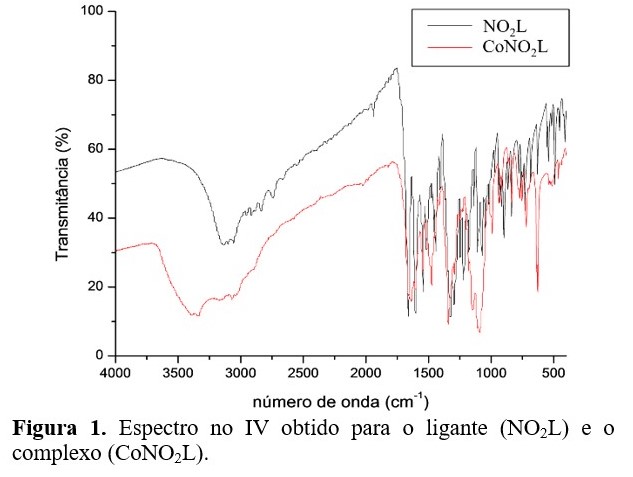
Espectro no IV obtido para o ligante (NO2L) e o complexo (CoNO2L).
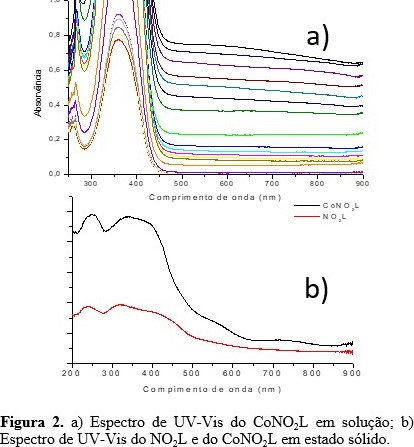
a) Espectro de UV-Vis do CoNO2L em solução; b) Espectro de UV-Vis do NO2L e do CoNO2L em estado sólido.
Conclusões
Foi possível sintetizar um complexo de cobalto(II) e caracterizá-lo por IV, UV-Vis e VC. A partir do teste qualitativo do complexo na reação de degradação de peróxido de hidrogênio é possível sugerir que este seja um catalisador promissor, possuindo maior atividade em pHs acima de 9,0.
Agradecimentos
Ao Instituto de Química da UFRJ, ao CNPq e à CAPES.
Referências
CHEN, S. et al. Electrochemical sensing of hydrogen peroxide using metal nanoparticles: a review. Microchim Acta , v. 180, p. 15–32 , 2012.
IBRAHIM , M. et al. Spectroscopic, Electrochemical, Catechol oxidase and catalase-like Activities of New Copper(II) Tweezers of Benzimidazole Incorporating Amino Acid Moieties, International Journal Electrochemical Science, v. 9 , p. 5298 – 5314, 2014.
KUPCEWICZ, B. et al. Copper(II) complexes with derivatives of pyrazole as potential antioxidant enzyme mimics. Medicinal Chemistry Research, n. 22, p. 2395–2402, 2013.
MATOS, I. O. ; ALVES, W. Atividade eletrocatalítica de sistemas biomiméticos da enzima catalase. Química Nova, v. 34, n. 9, p. 1588-1594, 2011.
MATTOS, I. et al. Peróxido de hidrogênio: importância e determinação: revisão, Química Nova, v. 26, n. 3, p. 373-380, 2003.
NORITAKE, Y., UMEZAWA, N., KATO, N., HIGUCHI, T. Manganese salen complexes with acid-base catalytic auxiliary: Functional mimetics of catalase. Inorg. Chem., v. 52, p. 3653-3662, 2013.
PIRES, B. et al. Synthesis and Characterization of Cobalt(III),Nickel(II) and Copper(II) Mononuclear Complexes with the ligand 1,3-bis[(2-aminoethyl)amino]-2-propanol and their catalase-like activity. Plos One, p.1- 21, 2015.
RODWELL, V. et al. Bioquímica Ilustrada de HARPER, 30ª ed., Porto Alegre: AMGH Editora Ltda., 2017.









