Separação de proteínas de sementes de feijão-caupi utilizando a técnica de eletroforese em gel unidimensional (SDS-PAGE)
ISBN 978-85-85905-25-5
Área
Química Analítica
Autores
Vince, A. (UFPI) ; Sousa, H. (UFPI) ; Cunha Coelho, R. (UFPI)
Resumo
O feijão-caupi (Vigna Unguiculata (L.) Walp.) tem sido objeto de estudo da Embrapa-Meio Norte, que por meio do cruzamento com outras linhagens da origem a novos feijões. Entre esses feijões destacam-se o Guariba, Tumucumaque, Xique-xique e o Aracê (FROTA, 2008). Pretende-se estudar a totalidade de proteínas e a observação do comportamento das mesmas por meio da eletroforese em gel de poliacrilamida(SDS PAGE). A análise feita com o feijão Aracê, a partir da variação de massas, permitiu otimizar a técnica. Assim, aplicando-se a mesma metodologia usada para o Aracê nas outras variedades do feijão-caupi obteve-se bandas mais nítidas e bem distribuídas ao longo do gel.
Palavras chaves
eletroforese; feijão-caupi; proteínas
Introdução
O feijão-caupi (Vigna Unguiculata (L.) Walp.) é uma leguminosa cultivada, principalmente, nas regiões Norte e Nordeste do Brasil, tendo maior destaque na zona rural. Tal feijão tem sido objeto de estudo da Embrapa-Meio Norte, que por meio do cruzamento com outras linhagens da origem a novos feijões, que em sua grande maioria apresentam maior resistência a determinadas pragas, a solos pobres em nutrientes, a escassez de água, dentre outros problemas enfrentados em plantações, aumentando seu valor agregado. Entre esses feijões destacam-se o Guariba, Tumucumaque, Xique-xique e o Aracê (FROTA, 2008). O feijão caupi tem grande destaque devido seu alto teor nutritivo e baixo custo em sua produção, uma vez que é uma leguminosa rica em proteínas (23 a 25% em média), carboidratos (cerca de 65%), alto teor de fibras alimentares, vitaminas, minerais (BEYER, 2010; GUERROUÉ, 1996). Diante da grande importância do feijão-caupi, a Embrapa (Empresa Brasileira de Pesquisa Agropecuária) têm implantado cada vez mais produtos biofortificados, os quais são melhorados geneticamente, apresentando assim maior quantidade de micronutrientes (RIBEIRO, 2002). As proteínas são de suma importância para a constituição dos tecidos conjuntivo e nervoso, da musculatura, do esqueleto; além de funcionar como catalisadores biológicos, ajudando também no transporte de nutrientes e metabólitos. Desse modo, a análise da quantidade proteica em diversos alimentos é indubitável, uma vez que irá promover o conhecimento da qualidade nutricional e influenciar para que a sociedade tenha uma alimentação balanceada. O feijão está bastante presente no cardápio brasileiro, sendo assim o conhecimento acerca de suas proteínas é destacável (PINHEIRO, 2005).
Material e métodos
Para a extração das proteínas nas sementes do feijão-caupi (cedidas pela EMBRAPA MEIO NORTE) pesou-se 0,5 g de cada amostra, posteriormente, fez-se a homogeneização das amostras por meio da maceração manual com o auxílio do nitrogênio líquido (WHITE MARTINS), que promove o congelamento dos grãos e posteriormente pó. Em seguida, adicionou-se às amostras 5 mL de éter de petróleo (ISOFAR), para retirada de lipídeos, seguindo com agitador magnético (IKA) por quinze minutos, e em seguida foi retirado o sobrenadante, esse processo foi feito em triplicata. Depois, foi adicionado 5 mL do tampão de extração, sendo este Tris-HCl (LCR) a 0,085 mol [L][/-1] e pH 7,2, seguindo com maceração manual por 20 minutos em banho maria (QUIMIS) à 65°C. A solução proteica é transferida para tubos eppendorfs que são levados a centrifuga (HERMLE) por 10 min a 10000 rpm. Após a centrifugação os sobrenadantes são coletados e armazenadas em tubos Falcon®. Ao termino da extração das proteínas são retirados 50 µL de amostra colocados em um tubo eppendorf e adicionados 200 µL de acetato de amônio (VETEC) em metanol (DINAMICA), a fim de que seja promovida a precipitação das proteínas, as quais serão ressolubilizadas para a quantificação pelo método espectrofométrico (QUIMIS) de Bradford e para a análise eletroforética (BioRad - 5000 V, 500 mA, 400 W). A “corrida” da eletroforese ocorre em duas etapas sendo a primeira de 30 min com corrente de 50 mA e outra de 40 min com corrente de 100 mA). 5 µL do padrão é inserido em um poço do gel. Às amostras é adicionado um volume de tampão dissociante específico, levando em consideração a quantificação e a quantidade de amostra adicionada em cada pocinho. A cuba possui capacidade para 1 L podendo ser inseridos até 4 géis (10,1 x 7,3 cm).
Resultado e discussão
Os resultados obtidos para os teores de proteínas totais mostraram-se
semelhantes entre as amostras. A concentração mais elevada foi obtida com a
cultivar Tumucumaque (161,4±18,9), seguida pela (142,5±7,9), Xique-xique
(122,5±10,6) e Guariba (101,8±10,5). As cultivares melhoradas geneticamente
Tumucumaque, Xique-xique e Aracê mostraram resultados superiores ao
resultado obtido com a cultivar Guariba, o qual não é melhorada
geneticamente. O desvio padrão nos resultados pode ser justificado pela
ordem na qual é feito o processo de extração. Por esse motivo, a cada nova
quantificação, as extrações seguiam ordem inversa a anterior realizada. Na
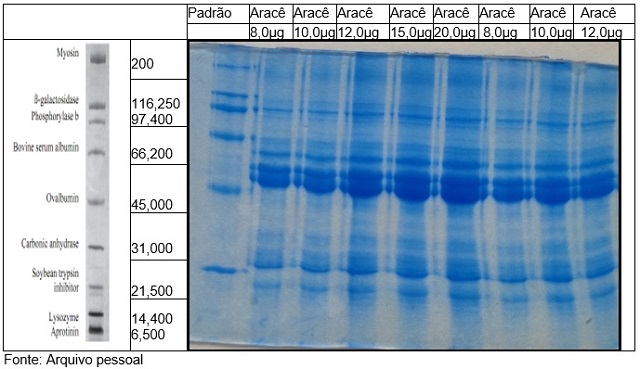
eletroforese inicialmente, aplicou-se no gel quantidades acima de 50
microgramas de proteínas. A partir da imagem 1 é possível observar que à
medida que a massa de proteínas
adicionada no pocinho aumenta, algumas bandas ficam mais largas e aparecem
manchas ao fundo do gel. Além disso, as bandas na região de albumina
aumentam, causando dificuldade na visualização. Diante dos resultados
obtidos, concluiu-se que a massa de 10µg de amostra, uma vez que no gel as
bandas apresentaram-se bem nítidas e sem manchas, já seu gráfico possui
picos bem distribuídos e não muito largos. Desse modo, fez-se um gel
aplicando 10µg das variedades BRS-Aracê, BRS-Tumucumaque, BRS-Xique-xique,
BRS-Guariba, como mostra na imagem 2. Apesar da proximidade entre as bandas
das diferentes variedades, observa-se que, por exemplo, o feijão Xique-xique
na região de β- galactosidase apresenta uma banda bem mais escura que as
demais amostras, o que significa uma maior concentração.

Conclusões
Os resultados de teor de proteínas totais entre as cultivares avaliadas mostrou que não houve diferenças significativas, mostrando que os perfis proteicos entre as amostras são semelhantes. Aplicando-se a usada para o Aracê nas outras variedades, obteve-se bandas mais nítidas e bem distribuídas ao longo do gel. Com isso, observou-se que todas as amostras de feijão-caupi utilizadas apresentaram perfis de separação de bandas semelhantes. Assim, pode se concluir que o processo de melhoramento genético nas cultivares não acarretou em modificações no nos perfis proteômico das amostras avaliadas.
Agradecimentos
A UFPI pelo espaço e apoio financeiro para a realização da pesquisa. A EMBRAPA por conceder as amostras para serem analisadas.
Referências
BRUM, Aelson Aloir Santana; ARRUDA, Lia Ferraz de; REGITANO-D”ARCE, Marisa Aparecida Bismara. Métodos de extração e qualidade da fração lipídica de matérias-primas de origem vegetal e animal. 2009. Disponível em:<http://www.producao.usp.br/bitstream/handle/BDPI/4606/art_BRUM_Metodos_de_extracao_e_qualidade_da_fracao_2009.pdf?sequence=1&isAllowed=y>. Acesso em: 05 jan. 2018.
Cambridge University Press, 2005.761p. Disponível em: <https ://s3.amazonaws.com/academia.edu.documents/37841811/principles_and_techniques_of_biochemistry_and_molecular_biology.pdf?AWSAccessKeyId=AKIAIWOWYYGZ2Y53UL3A&Expires=1519189711&Signature=eOSPSHkjPJtmAwkBCDaB/+lL+m4=&response-content-disposition=inline; filename=principles_and_techniques_of_biochemistr.pdf>. Acesso em: 02 fev. 2018.
CAÑAS, Benito et al. Trends in sample preparation for classical and second generation proteomics. Journal Of Chromatography A, [s.l.], v. 1153, n. 1-2, p.235-258, jun. 2007. Elsevier BV. http://dx.doi.org/10.1016/j.chroma.2007.01.045.
CARLSSON, Nils et al. Quantification of protein concentration by the Bradford method in the presence of pharmaceutical polymers. Elsevier. Gotemburgo, p. 117-121. 22 out. 2010. Disponível em: <10.1016/j.ab.2010.12.026.>. Acesso em: 05 jan. 2018
CUTLER, P. Protein Purification Protocols, 2ª ed., Humana Press, Totowa, New Jersey, p. 101-124, 2004.
EHLERS, J. D.; HALL, A.E. Cowpea (Vigna unguiculata L. Walp.). Filed Crops Research. v. 53, p. 187-204, 1997.
EMBRAPA. Feijão-caupi BRS Xiquexique. 2008. Disponível em: <https://www.embrapa.br/busca-de-solucoes-tecnologicas/-/produto-servico/432/feijao-caupi-brs-xiquexique>. Acesso em: 08 fev. 2018.
Freire Filho, F.R.; Rocha, M.M.; Ribeiro, V.Q.; Lopes, A.C.A. 2005. Adaptabilidade e estabilidade produtiva de feijão-caupi. Ciência Rural, 35: 24-30
FROTA, Karoline de MacÊdo GonÇalves et al. MOLECULAR PROFILE, PURITY AND PRESENCE OF TRYPSIN INHIBITORS IN COWPEA PROTEIN ISOLATES. Revista Caatinga, [s.l.], v. 31, n. 1, p.202-208, mar. 2018. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/1983-21252018v31n123rc.
FROTA, K. de M; SOARES, R. A. M; ARÊAS, J. A. G. Composição química do feijão- caupi (Vigna unguiculata L. Walp), cultivar BRS-Milênio. Ciência e tecnologia de alimentos, v. 28, n. 2, p. 470-476, 2008.
GONÇALVES, José Ricardo Pupo et al. BRS Guariba – Nova Cultivar de Feijão-Caupi para o Estado do Amazonas.Manaus: Issn, 2009. 6 p. Disponível em: <https://www.infoteca.cnptia.embrapa.br/bitstream/doc/685025/1/ComTec762009.pdf>. Acesso em: 8 fev. 2018.
GRANDIS, Adriana. Papel das enzimas de degradação da parede celular na formação do Aerênquima em raízes de cana de açúçar. 2015. 142 f. Tese (Doutorado) - Curso de Ciências, Botânica, Instituto de Biociências da Universidade de São Paulo, São Paulo, 2015.
KAŁIčKA, Kasicka V.. Electrophoresis: Proteins ☆. Reference Module In Chemistry, Molecular Sciences And Chemical Engineering, [s.l.], p.1-13, 2018. Elsevier. http://dx.doi.org/10.1016/b978-0-12-409547-2.14446-4.
LEE, Man Chung Gilbert et al. Sodium dodecyl sulfate polyacrylamide gel electrophoresis for direct quantitation of protein adsorption. Analytical Biochemistry, [s.l.], v. 465, p.102-104, nov. 2014. Elsevier BV. http://dx.doi.org/10.1016/j.ab.2014.07.031.
MORRIS, T.j.; SEMANCIK, J.s.. Nucleotide composition of RNA by polyacrylamide gel electrophoresis. Analytical Biochemistry, [s.l.], v. 61, n. 1, p.48-53, set. 1974. Elsevier BV. http://dx.doi.org/10.1016/0003-2697(74)90331-5.
PESSÔA, A. Jr., KILIKIAN, B.V. Purificação de Produtos Biotecnológicos, 1ª Ed. Manole, São Paulo, 2005.
PINHEIRO, Denise Maria et al. A química dos alimentos. Maceió: Edufal, 2005. 54 p. Disponível em: <http://www.usinaciencia.ufal.br/multimidia/livros-digitais-cadernos-tematicos/A_Quimica_dos_Alimentos.pdf>. Acesso em: 16 fev. 2018
RIBEIRO, V. Q. (Ed.). Cultivo do feijão-caupi (Vigna unguiculata (L.) Walp). Teresina: Embrapa Meio-Norte, 2002.
ROCHA, Thales Lima et al. Eletroforese bidimensional e análise de proteomas. 2005. Disponível em: <https://www.infoteca.cnptia.embrapa.br/bitstream/doc/187102/1/cot136.pdf>. Acesso em: 5 fev. 2018.
SILVA, Redinaldo dos Santos; SOUZA, Cláudia Regina Batista de. Extração e análise eletroforética em gel de poliacrilamida (SDS-PAGE) de proteínas totais de folhas e raízes de Piper tuberculatum. 2009.
SHEEN, Hyukho. Quantitation of yeast total proteins in sodium dodecyl sulfate–polyacrylamide gel electrophoresis sample buffer for uniform loading. Analytical Biochemistry, [s.l.], v. 498, p.95-97, abr. 2016. Elsevier BV. http://dx.doi.org/10.1016/j.ab.2016.01.002.
TOGNON, A.L. Quantificação e avaliação da Bioacessibilidade in vitro de micro e macroelementos em frutas, hortaliças e cereais. Dissertação (Mestrado em Ciências). Universidade de São Paulo, 2012.
WILSON, Keith; WALKER, John. Principles and Techniquies of Biochemistry and molecular Biology. 7. ed. Estados Unidos da America:
WANG, Jianlong; NGUYEN, Anh V.; FARROKHPAY, Saeed. Foamability of sodium dodecyl sulfate solutions: Anomalous effect of dodecanol unexplained by conventional theories. 2016. Disponível em: <https://doi.org/10.1016/j.colsurfa.2016.02.001>. Acesso em: 20 jan. 2018.
EMBRAPA MEIO NORTE. Feijão-caupi: cultivares ricas em ferro e zinco. Teresina: Embrapa Meio-Norte, 2010. Folder. Disponível em: Acesso em: 18 jan. 2018.
Zilli, J.E.; Valicheski, R.R.; Rumjanek, N.G.; Araújo, J.L.S.; Freire Filho, F.R.; Neves, M.C.P. 2006. Eficiência simbiótica de estirpes de Bradyrhizobium isoladas de solo do Cerrado em caupi. Pesquisa Agropecuária Brasileira, 41: 811-818.
LANGYINTUO, A. S.; LOWENBERG-DEBOER, J.; FAYE, M.; LAMBERT, D.; IBRO, G.; MOUSSA, B.; KERGNA, A.; KUSHWAHA, S.; MUSA, S.; NTOUKAM, G. Cowpea supply and demand in West and Central Africa. Field Crops Research, Amsterdam, v. 82, n. 2-3, p. 215-231, May 2003.
PESSATO, Tassia Batista. Hidrolisados de isolado proteico do soro de leite obtidos com alcalase livre e imobilizada: caracterização e detecção de proteínas alergenicas. 2014. 74 f. Tese (Doutorado) - Curso de Engenharia dos Alimentos, Unicamp, Campinas, 2014.









