DETERMINAÇÃO DO TEOR DE ÁCIDO FOSFÓRICO EM REFRIGERANTE SABOR COLA
ISBN 978-85-85905-25-5
Área
Química Analítica
Autores
Drummond, A.L. (IFB - CAMPUS GAMA) ; Farias, C.T.L. (IFB - CAMPUS GAMA) ; Sales, R.S. (IFB - CAMPUS GAMA)
Resumo
Em virtude do alto consumo de bebidas não alcoólicas e gaseificadas no Brasil1, em especial os refrigerantes sabor cola que contam mundialmente com 50,9% da preferência de jovens e adultos2. O objetivo deste trabalho é determinar o teor de ácido fosfórico (H3PO4) em refrigerantes a base utilizando a técnica de titulação potenciométrica, tal técnica apesar de requerer mais tempo é considerada vantajosa frente a utilização de indicadores ácido-base, por apresentar resultados mais precisos.3. Assim o trabalho foi desenvolvido em duplicata tendo como amostra o refrigerante da marca Coca-cola de 200 mL. Os resultados obtidos indicaram que o teor de ácido fosfórico é 0,059 g/ 100 mL de refrigerante e está dentro do limite recomendado pela legislação que é 0,07 g/100 mL de refrigerante4.
Palavras chaves
Refrigerante; Ácido Fosfórico; Titulação Potenciométrica
Introdução
O refrigerante é uma das bebidas não alcoólicas e gaseificadas mais consumidas no Brasil1, sendo que o refrigerante de sabor cola ocupa a terceira colocação no ranking mundial de vendas, com 50,9% da preferência entre jovens e adultos2. O ácido fosfórico (H3PO4) apesar de ser o único ácido inorgânico utilizado pela indústria alimentícia, que possui o menor pH5, deve obedecer aos parâmetros regulamentados pelas legislações vigentes, em virtude do seu excesso causar sérios prejuízos à saúde humana, tais como o desenvolvimento de osteoporose, doença que inibe a absorção de cálcio pelos ossos6. Diante do exposto o presente trabalho busca quantificar o teor de ácido fosfórico presente no refrigerante e verificar se está de acordo com os limites estabelecidos pela Resolução n° 389 de 03 de agosto de 1999 pela Agência Nacional de Vigilância Sanitária (ANVISA), para tal análise empregou-se a técnica de titulação potenciométrica que utiliza como equipamento principal o pHmetro que dispõe de um eletrodo de vidro combinado ao qual tem a sensibilidade para medir o potencial em função da adição de titulante, assim o ponto final é alcançado quando ocorre mudança repentina no valor de pH, que pode ser observada nos gráficos da curva de titulação, para tanto é necessário à plotagem dos gráficos da 1ª derivada cuja inclinação indica a região do ponto final e a 2ª derivada na qual é determinado o ponto final da titulação, está última constitui-se objeto deste estudo3. Optou-se por utilizar esse método analítico, devido a maior precisão nos resultados se comparada com a técnica convencional que faz uso do indicador e também pela economia de reagente, uma vez que o eletrodo de vidro combinado tem a mesma função de um indicador ácido-base.
Material e métodos
O procedimento experimental foi dividido em quatro etapas: Na primeira etapa, preparou-se 2 L de uma solução estoque de hidróxido de sódio (NaOH) 0,1 mol.L-1, em seguida esta solução foi padronizada com o padrão primário de biftalato de potássio (KC8H5O4) previamente seco a 110°C e armazenado no dessecador. Na segunda etapa, preparou-se 250 mL uma solução de ácido fosfórico (H3PO4) 0,1 mol.L-1, e transferiu uma alíquota de 5,0 mL dessa solução para um béquer de 250 mL e avolumou-se com 100 mL de água deionizada, em seguida com o auxílio de um pHmetro e um eletrodo de vidro combinado, titulou-se com NaOH padronizado, usando alíquotas de 0,5 mL consecutivamente até o pH 11,0. Na terceira etapa, para determinação do ácido fosfórico no refrigerante de 200 mL da marca Coca-Cola, utilizando um banho de ultrassom aqueceu-se, por cerca de 30 minutos, 200 mL de refrigerante da marca Coca-Cola em um béquer coberto com vidro de relógio, até a remoção de todo gás carbônico (CO2) e, na sequência, deixou-se esfriar. A quarta e última etapa foi realizada em duplicata, transferindo-se 100 mL da amostra do refrigerante descarbonatado para um béquer de 400 mL e avolumou-se com 100 mL de água deionizada, titulando com a solução de NaOH padronizada, adicionando alíquotas de 0,5 mL ao titulado e nas proximidades do ponto de equivalência 0,1 mL até um pH próximo de 10,5. Em todos os casos os valores de pH antes e após o início da titulação foram registrados para plotagem dos gráficos e análise dos resultados.
Resultado e discussão
A massa média obtida do padrão primário de biftalato de potássio (KC8H5O4)
utilizado para padronizar o NaOH foi de 0,70656 g e o desvio padrão de
0,0017616 g, já a concentração encontrada para o NaOH padronizado foi de
0,9717 mol/L. Para as análises no refrigerante, inicialmente foi realizada
uma prova em branco preparando uma solução de ácido fosfórico (H3PO4) e
titulando-a com NaOH padronizado para detectar os saltos potenciométricos,
de modo que ao repetir esse procedimento nas amostras de refrigerante, foi
utilizado alíquotas de 0,1 a 0,1 mL nas imediações do ponto final.
O ácido fosfórico a ser titulado com a solução padronizada de NaOH possui
três hidrogênios ionizáveis, cujas constantes de ionização são
respectivamente K1 = 7,52 x 10-3, K2 = 6,23 x 10-8, K3 = 4,80 x 10-
13,contudo a constante de ionização do terceiro hidrogênio é tão pequena7,
que não aparece nos gráficos.
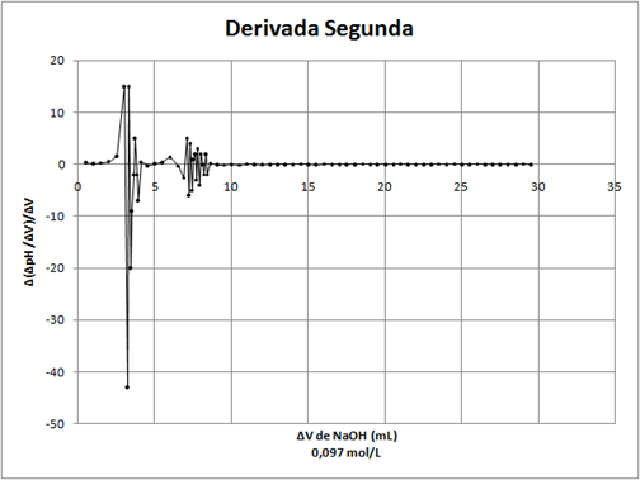
Conforme apresentado no Gráfico 1, o primeiro ponto final é alcançado quando
5,37 mL de NaOH são adicionados para neutralização, já o segundo ponto final
é obtido em 10,5 mL de NaOH, em uma concentração de 0,10 mol/L de H3PO4.
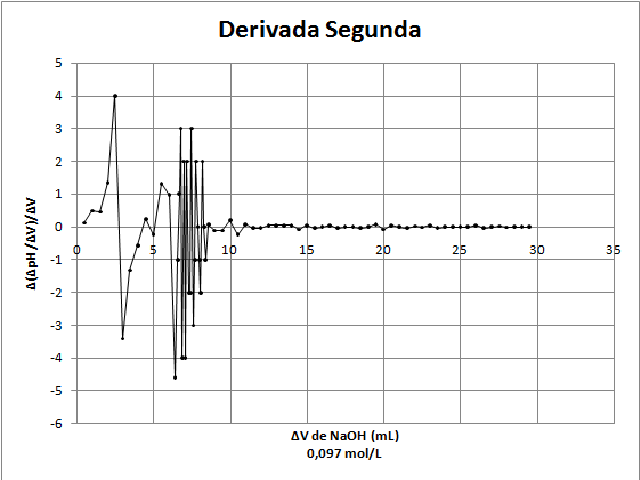
Para a segunda amostra de refrigerante obteve-se o Gráfico 2, em que o
primeiro ponto final é observado em 3,0 mL de NaOH e o segundo ponto final
em 6,4 mL de NaOH, em uma concentração de 0,059 g/100 mL de refrigerante.
Observou-se que em ambas amostras os valores apresentam uma aproximação
entre si, de modo que a média das concentrações de cada amostra foi de 0,059
g/100 mL de refrigerante com um desvio padrão de 0,0007, enquanto que o
valor de H3PO4 permitido pela legislação é 0,07 g/100 mL de refrigerante4,
logo pode-se inferir que o teor de H3PO4 da amostra de refrigerante da marca
Coca-cola está dentro do nível estabelecido pela legislação da ANVISA.
Conclusões
Concluiu-se que o teor de H3PO4 encontrado no refrigerante da marca coca-cola foi de 0,059 g/100 mL de refrigerante, o que significa que está dentro do limite recomendado pela legislação que é de 0,07 g/100 mL de refrigerante.
Agradecimentos
Agradecemos ao IFB.
Referências
[1] ABIR, Associação Brasileira das Indústrias de Refrigerantes. Disponível em: <https://abir.org.br/o-setor/bebidas/refrigerante/>. Acesso em: 15 de agosto de 2019.
[2] ROSA, S.E.S.; COSENZA, J.P.;LEÃO, L.T.S. Panorama do setor de bebidas no Brasil. BNDES Setorial, v. 23, p. 101-149, 2006.
[3] SKOOG, WEST, HOLLER, CROUCH. Fundamentos de Química Analítica. Tradução da 8ª Edição norte-americana. São Paulo-SP: Editora Thomson, 2006.
[4] BRASIL, Ministério da saúde. Agência Nacional de Vigilância Sanitária. Resolução nº 389, de 03 de agosto de 1999. Regulamento técnico que aprova o uso de aditivos alimentares, estabelecendo suas funções e seus limites máximos para a categoria de alimentos 16: Bebidas - subcategoria 16.2.2 - bebidas não alcoólicas e não gaseificadas. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/1999/res0389_05_08_1999.html>. Acesso em: 15 de agosto de 2019.
[5] CRIVELETTO, R. Estabilidade físico-química e sensorial de refrigerante sabor laranja durante armazenamento. Trabalho de Conclusão de Curso. Universidade Federal do Rio Grande do Sul - Instituto de ciência e Tecnologia de Alimentos.Porto Alegre, 2011.
[6] FIALHO, M.L.; REIS, K.P.; OLIVEIRA, R.B.; FRANCO, M.V.; SANTOS, H.L.; Fatores de riscos à saúde por ingestão excessiva de refrigerantes e as suas principais doenças causadas ao ser humano. Intraciência Revista Científica. Disponível em:<http://www.uniesp.edu.br/sites/_biblioteca/revistas/20190312104438.pdf>. Acesso em: 15 de agosto de 2019.
[7] BACCAN, N.; ANDRADE, J.C.; GODINHO, O.E.S; BARONE, J.S. Química Analítica Quantitativa Elementar. 3ª ed. São Paulo: Blucher - Instituto Mauá de tecnologia, 2001.









