APLICAÇÃO DE CROMATOGRAFIA GASOSA ACOPLADA A ESPECTROMETRIA DE MASSAS UTILIZANDO DILUIÇÃO ISOTÓPICA PARA CARACTERIZAÇÃO DE MATERIAL DE REFERÊNCIA CERTIFICADO DE HPA EM SOLUÇÃO
ISBN 978-85-85905-25-5
Área
Química Analítica
Autores
Guimarães, E.F. (INMETRO) ; Rodrigues, J.M. (INMETRO) ; Figueroa-villar, J.D. (IME) ; Almeida, R.R.R. (INMETRO) ; Carvalho, L.J. (INMETRO) ; Rego, E.C.P. (INMETRO)
Resumo
O desenvolvimento de um método analítico que provê resultados com menores incertezas de medição e mais exatos tem uma importância crucial na certificação de um MR, que desempenha um papel vital no provimento da rastreabilidade metrológica. Para caracterização do MRC de HPA desenvolvemos um método de cromatografia gasosa com espectrometria de massas de diluição isotópica e executamos duas técnicas de calibração: curva de calibração e exact matching. O desempenho do método foi avaliado quanto à sua adequação para a caracterização do MRC. As incertezas com o método da curva de calibração foram superiores em relação ao exact matching, justificando o uso deste último para a atribuição do valor da propriedade, enquanto o método da curva de calibração se adequa aos outros estudos de certificação.
Palavras chaves
HPA; MRC; Diluição isotópica
Introdução
A caracterização de um lote de candidato a material de referência certificado (MRC) é um requisito da norma ABNT NBR ISO 17034 (ABNT, 2017a), uma vez que pretende-se apresentar um valor de propriedade (fração mássica) no seu certificado. O produtor deve deixar claro se o mensurando é definido operacionalmente, caso dos resultados método-dependentes, ou se é definido independentemente de qualquer procedimento específico, como os resultados de pureza. A estratégia de caracterização de um MRC pode seguir várias abordagens. Para esse estudo foi adotado a caracterização em um único laboratório utilizando um único método primário de medição (MPM), uma vez que este MRC é uma matriz líquida, ou seja, uma matriz simples se comparada a matrizes sólidas ou pastosa e, principalmente porque os MPM provêm resultados com maior exatidão e menor incerteza de medição. A técnica de espectrometria de massas de diluição isotópica (EMDI) é reconhecida pelo CCQM como um MPM por razão para o estabelecimento de rastreabilidade ao mol. Nos MPM, os valores são diretamente rastreáveis ao SI permitindo uma cadeia de propagação da incerteza. O método de EMDI consiste no uso de um padrão isotopicamente enriquecido, para as análises inorgânicas, ou de um composto análogo isotopicamente marcado, para as análises orgânicas, como padrão interno na quantificação por espectrometria de massas. O cálculo da fração mássica desejada é medido pela razão entre as quantidades dos dois isotopólogos. Esta técnica tem sido empregada em diversas áreas da química analítica fornecendo medições de referência de alta exatidão. A rastreabilidade a partir desse MPM, onde há uma concordância exata entre as soluções de calibração e a solução de amostra, pode ser alcançada através de uma investigação minuciosa de todas as fontes de tendência do método (MACKAY et al., 2003). A vantagem da EMDI é que, como as propriedades químicas e físicas do analito e do seu padrão isotópico são muito semelhantes, qualquer discriminação em qualquer etapa do processo será sentida da mesma maneira por ambos os compostos, mantendo-se assim a razão de áreas do analito e do padrão interno. A técnica de diluição isotópica aplicada a compostos orgânicos apresenta duas vertentes: uma utilizando o padrão marcado isotopicamente como padrão interno do respectivo padrão nativo em uma curva de calibração, e a outra, denominada exact matching, realizada através da comparação da razão de áreas entre o analito e o padrão marcado isotopicamente na amostra frente à mesma razão de uma amostra sintética (preparada no mesmo laboratório) (SARGENT et al., 2002). A escolha de uma metodologia em detrimento da outra, baseia-se apenas em aspectos práticos, já que para a aplicação da técnica EMDI é necessário um conhecimento prévio da fração mássica do analito para a construção da amostra sintética, o que torna esta técnica praticamente inviável para laboratórios de rotina. Portanto, uma vez que a quantidade de padrão isotópico adicionado à amostra e utilizado nos padrões de calibração é conhecida, através da equação da curva de calibração, pode-se determinar com elevada confiabilidade a fração mássica da substância na amostra. Nesta técnica, uma massa de padrão marcado isotopicamente é adicionada na mesma fração mássica do analito na matriz e em mais outra solução padrão preparada de acordo com a fração mássica da substância em questão. Assim, através das análises cromatográficas da amostra e da solução padrão, teremos sinais analíticos idênticos quando medidos por espectrometria de massas, e a fração mássica do analito poderá ser determinada através da EQ. 1 (SARGENT et al., 2002). Wi= Wz*P*(mz/myc)*(my/ma)*(R'B/R'BC) EQ. 1 Onde: Wi é a fração mássica do analito na amostra; Wz é a fração mássica da solução do analito no padrão; mz é a massa de analito no padrão; myc é a massa de PI adicionada ao padrão; my é a massa de PI adicionada a amostra; ma é a massa de amostra; P é a pureza do analito; R'B é a razão de áreas na amostra (analito/PI); R'BC é a razão de áreas no padrão (analito/PI). A implantação das técnicas de EMDI, por curva de calibração ou por exact matching (RODRÍGUEZ-GONZÁLEZ et al., 2005), agrega maior exatidão com menor incerteza de medição, sendo, portanto uma ferramenta imprescindível para a metrologia química. Sendo o instituto de metrologia brasileiro, o Inmetro utiliza preferencialmente a EMDI em suas análises e têm empregado está técnica na caracterização do MR. A produção de MRC pelo Inmetro permitirá uma economia substancial aos laboratórios que já utilizam este tipo de material, pois estes MR importados são muito caros, já que as etapas de certificação são dispendiosas, além de minimizar os resultados falso positivos e negativos. Este trabalho aplicou a cromatografia gasosa acoplada a espectrometria de massas utilizando diluição isotópica no estudo de caracterização do candidato a MRC de hidrocarbonetos policíclicos aromáticos (HPAs) em solução.
Material e métodos
O tolueno grau HPLC foi adquirido da Tedia. Padrões sólidos de HPA naftaleno (N), acenaftileno (Acy), acenafteno (Ace), fluoreno (Fl), fenantreno (Phe), antraceno (A), fluoranteno (Fluo), pireno (Py), benzo[a]antraceno (B[a]A) e benzo[ghi]perileno (B[ghi]P) foram adquiridos de Aldrich. Padrões sólidos de HPA, criseno (Chry), benzo[k]fluoranteno (B[k]Fluo), benzofluoranteno (BFluo), benzo[a]pireno (B[a]P), dibenzo[a, h]antraceno (DiBA), indeno [123-cd] pireno (IndPy), foram adquiridos da AccuStandard. Padrões de HPA deuterado (PI) N-d8, Acy-d12, Ace-d10, Fl-d10, A-d10, Phe-d10, Flu-d10, Chry-d12, B[a]A-d12, Py-d12, B[k]Fluo-d12, BFluo-d12, B[a]P-d12, DiBA- d14, IndPy-d12, B[ghi]P-d12 foram obtidos da CIL. O SRM 2260a fornecido pelo NIST. O MRC de HPA (8363.0001) consiste de uma solução dos 16 HPAs em solução (GUIMARÃES et al., 2014). Todas as soluções foram preparadas gravimetricamente (balança XP205, 0,00001 g). A caracterização foi realizada por CG-EMDI, quantificando por exact matching e curva de calibração. O estudo CG-EMDI com curva de calibração está descrito em Guimarães et al., 2014. No estudo exact matching EMDI, a solução-mãe foi preparada pesando de 5 mg de cada um dos 16 HPAs em uma barquinha. Após cada pesagem foi feita a transferência quantitativa com tolueno obtendo a fração mássica alvo de 15 μg/g. A solução de PI foi preparada da mesma forma, afim de obter a fração mássica alvo de 21 μg/g. Foi preparado um blend, pesando 1 g da solução-mãe e sem tarar a balança, adicionou-se tolueno até completar 3 g, ficando na faixa de 5 µg/g. Em outro frasco, pesou-se 1 g da solução previamente preparada e em seguida foi feita a diluição gravimetrica, adicionou 1 g da solucão de PI (1:1 m/m). Na analise do MRC 8363.0001 e o SRM 2260a, foram preparadas 2 replicatas verdadeiras, pesando-se 0,5 g em cada frasco, no caso do SRM 2260a, pesou-se 1 g deste MRC. Na sequência, foi feita a diluição (1:1 m/m) adicionando PI. As análises foram realizadas em dois equipamentos diferentes, C1 foi utilizado o cromatógrafo à gás 6890, acoplado a espectrômetro de massas 5975B (Agilent) e C2 utilizou-se o cromatógrafo à gás GC-2010 acoplado a espectrômetro de massas GCMS-QP2010 (Shimadzu). Foram analisadas duas amostras MRC de HPA. Cada amostra foi injetada cinco vezes e cada injeção foi intercalada por blend. Assim, a sequência seguiu a ordem: 1ª injeção do blend, 1ª injeção da amostra A, 2ª injeção do blend, 2ª injeção da amostra A, 3ª injeção do blend, e assim por diante. No método C1, a injeção splitless; volume 1 μL; as temperaturas do injetor e do detector de 290 °C e 250 °C, respectivamente; modo Scan e SIM e no método C2 injeção splitless; volume 0,2 μL; as temperaturas do injetor, da interface e da fonte de íons em 290 °C, 280 °C e 250 °C, respectivamente; modo SIM. A coluna cromatográfica foi a VF-5ms (60 m x 250 mm x 0,25 μm) e forno em 60 °C (2 min), 120 °C (20 °C/2 min), 180 °C (6,0 °C/2 min), 290 °C (3,0 °C/29,33 min) em ambos os métodos.
Resultado e discussão
O MRC para 16 HPAs prioritários em tolueno (MRC 8363.0001) foi caracterizado
por CG-EMDI curva de calibração (GUIMARÃES et al., 2014), e quando terminou
sua validade, optou-se por refazer a caracterização por uma técnica mais
exata e mais precisa, ou seja, a EMDI por exact matching. Esta técnica
dispensa a elaboração de curvas de calibração, sendo necessário apenas o
preparo de um blend de calibração, além das amostras, ambos possuindo
concentrações semelhantes em seus analitos constituintes (STOKES, 2003).
Neste caso, a concentração alvo para os HPAs nativos e os deuterados foi
próxima de 5 µg/g, que é a concentração aproximada dos analitos presentes
neste MRC.
Devido a não disponibilidade de MRC para controle, as análises foram
realizadas em dois equipamentos diferentes a fim de validar o método C1 e o
método C2. Os cálculos para a determinação das frações mássicas dos HPAs
foram realizados através da EQ. 1. Na TAB. 1 os valores estão relatados em
forma de média das replicatas obtida pelo método C1, C2 e suas respectivas
incerteza-padrão combinada, uc1 e uc2 e ainda, a médias das duas análises
para cada HPA (µg/g), a incerteza-padrão combinada e a expandida.
TAB. 1 – Média das replicatas (µg/g) obtida pelo método C1, pelo método C2 e
suas respectivas incertezas combinadas, uc1 e uc2, e média das duas análises
para cada HPA (µg/g), com incerteza combinada (uc) e expandida (U).
Os resultados obtidos pelo método C1, C2 e também as médias destes valores
estão dentro da faixa da incerteza dos métodos e em função disto as médias
dos dois métodos foram combinadas, sendo desta forma estabelecido os valores
(fração mássica) certificados para todos os analitos.
As incertezas referentes às grandezas de entrada foram: fração mássica da
solução do analito usada no preparo do blend de calibração, massa da
amostra, massa do analito isótopo adicionado à amostra, massa do analito
adicionado ao blend de calibração, massa do analito isótopo adicionado ao
blend de calibração, pureza do analito e repetibilidade do processo,
calculadas utilizando o método relativo.
Nos cálculos de incerteza, para a massa pesada baseia-se na incerteza
emitida no certificado de calibração das balanças, pois se trata de
incerteza tipo B (GUIMARÃES et al., 2013).
No caso da incerteza inerente à repetibilidade do processo, por tratar-se de
uma medida experimental, foram calculadas de forma relativa, o resultado
desta equação foi dividido pela média das determinações da concentração do
analito (GUIMARÃES et al., 2013).
As equações que exprimem o cálculo da incerteza de medição da pureza dos
padrões de HPAs nativos, estão descritas em Guimarães (2013). A pureza do
padrão interno, diferentemente da pureza do padrão do analito, não é uma
fonte de incerteza nesta análise já que, independentemente do seu valor, o
padrão interno é adicionado ao blend de calibração e à amostra na mesma
fração mássica, fazendo com que ambos sejam divididos pelo mesmo fator, não
ocasionando, portanto, incerteza ao processo de análise.
Calculadas todas as incertezas necessárias para a incerteza da
caracterização (uc), deve-se realizar a combinação destas através da EQ. 2,
a qual apresenta o cálculo através do método relativo.
uc =Wx*Raiz((uWz/Wz)2+(umx/mx)2+(umy/my)2+(umz/mz)2+(umyc/myc)2+(up/p)2+
(urpt/X)2) Onde: Wx é a fração mássica do analito na amostra; uWz/Wz é a
contribuição de incerteza inerente à fração mássica da solução do analito
usada no preparo do blend de calibração (massa do analito e massa do
solvente); umx/mx é a contribuição da incerteza inerente à massa da amostra;
umy/my é a contribuição da incerteza inerente à massa do analito isótopo
adicionado à amostra; umz/mz é a contribuição da incerteza inerente à massa
do analito adicionado ao blend de calibração; umyc/myc é a contribuição da
incerteza inerente à massa do analito isótopo adicionado ao blend de
calibração; up/p é a contribuição de incerteza inerente à pureza do analito;
urpt/X é a contribuição da incerteza devido à repetibilidade do processo.
No método relativo, as componentes da incerteza são divididas pela grandeza
de entrada, a fim de que estas fiquem adimensionais. Logo, a combinação
através da soma das componentes estará expressa adimensionalmente,
necessitando serem posteriormente normalizadas para a unidade do mensurando.
Esta normalização ocorre através da multiplicação da incerteza-padrão
combinada na forma relativa pelo valor do mensurando, no caso, a fração
mássica dos HPAs.
A definição de um método analítico com menor incerteza de medição é
extremamente importante para os Institutos Nacionais de Metrologia (INMs).
Esses têm a missão de estar no ápice da cadeia metrológica, desenvolvendo
metodologias, foi empregado preferencialmente um método primário, com maior
exatidão e menor incerteza. Desta forma, estão aptos a garantir o
reconhecimento internacional das medições realizadas em seus países através
das comparações-chave ocorrem entre INM e dos processos de auditoria a que
são submetidos (peer review), sendo todo este processo de avaliações e
reconhecimento parte do Acordo de Reconhecimento Mútuo do Comitê
Internacional de Pesos e Medidas (BIPM, 2019).
Como podemos observar na FIG. 1, a incerteza de medição obtida aplicando a
técnica CG-EMDI, utilizando a quantificação por exact matching (nova
caracterização) é muito menor comparada a caracterização anterior (CG-EMDI
por curva de calibração).
FIG. 1 - Incerteza de medição por CG-EMDI aplicando a quantificação por
exact matching e por curva de calibração.
Em virtude do emprego da técnica de diluição isotópica (GC-EMDI), aplicando
exact matching na caracterização do MRC, reduziu-se os valores de incerteza
de medição na faixa de 5 a 18 %.
Os valores (fração mássica) certificados para todos os analitos foram
estabelecidos pela média dos resultados do método C1 e método C2, com as
respectivas incertezas expandidas, para um nível de confiança de 95 % (k =
2).
Sendo assim, foi emitido um novo certificado para o MRC de HPAs em tolueno,
o qual inclui, entre outras informações, o valor da propriedade certificada,
sua incerteza de medição e a declaração da rastreabilidade metrológica. A
incerteza-padrão combinada (uMRC) foi calculada com a combinação das
incertezas dos estudos de homogeneidade (ubb), de caracterização (ucar) e de
estabilidade de longa duração (ults). A caracterização foi realizada pela
técnica CG-EMDI, utilizando a quantificação por exact matching (nova
caracterização) e os demais estudos de certificação foram realizados pela
técnica CG-EMDI
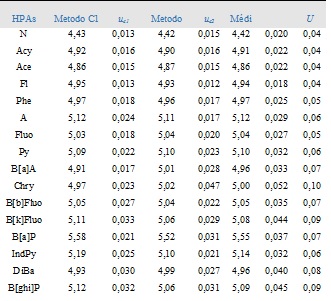
Média (µg/g) método C1, C2 e respectivas incertezas combinadas, uc1 e uc2, e média das análises HPA, com incerteza combinada (uc) e expandida (U).
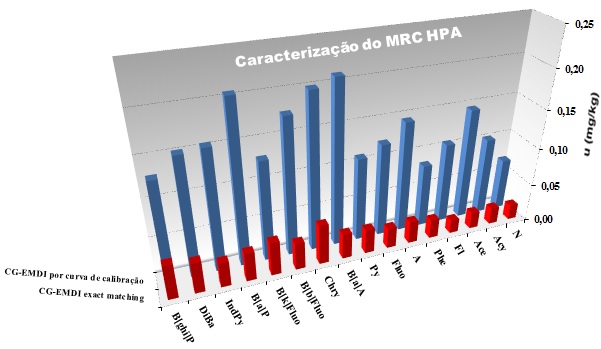
Incerteza de medição por CG-EMDI aplicando a quantificação por exact matching e por curva de calibração
Conclusões
O candidato a MRC de 16 HPAs prioritários em tolueno foi caracterizado com sucesso. Os valores certificados possuem rastreabilidade metrológica garantida por meio do uso da gravimetria e da EMDI, que são MPMs. O emprego da CG-EMDI por exact matching, que é mais exata do que a CG-EMDI por curva de calibração, na caracterização do MRC, resultou em redução de 5 a 18 % na incerteza do MRC. Esta prática é comum nos INMs sempre que ocorrem avanços nos procedimentos de caracterização dos materiais de referência. O emprego da EMDI por exact matching é recente nos INMs e agrega substancial valor ao MRC produzido, gerando valores com maior exatidão e menor incerteza de medição. Este foi o primeiro caso de utilização desta técnica no Laboratório de Análise Orgânica (Labor) do Inmetro, o que possibilitou a transferência da experiência adquirida para a quantificação de outros compostos orgânicos. A utilização da gravimetria no preparo do MRC e o uso da técnica de EMDI foram essenciais para a certificação do material de referência com confiabilidade e rastreabilidade ao Sistema Internacional de Unidades (SI). O MRC, produzido no Brasil, recebeu o código 8363.0001 e destina-se à área ambiental, se constituindo em uma ferramenta importante de provimento da rastreabilidade ao SI para os laboratórios de ensaio que analisam HPAs em variadas matrizes, principalmente para uso na calibração de instrumentos de cromatografia. Os resultados contribuirão com a comunidade científica para alertar sobre a importância da confiabilidade e rastreabilidade em medições dos HPAs, constituindo em um exemplo prático importante para as instituições que objetivam se acreditar como produtores de materiais de referência e irão buscar o reconhecimento para tal através da acreditação e ainda para os laboratórios de ensaio que têm um MRC disponível para provimento da rastreabilidade metrológica e, consequentemente, o atendimento a ABNT NBR ISO/IEC 17025 (ABNT, 2017).
Agradecimentos
Os autores agradecem à FAPERJ, FINEP e CNPq pelo apoio financeiro.
Referências
ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS (ABNT). NBR ISO 17034: Requisitos gerais para a competência de produtores de material de referência. Rio de Janeiro, 2017 a.
ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS (ABNT). NBR ISO/IEC 17025: Requisitos Gerais para competência de laboratórios de ensaio e calibração. Rio de Janeiro, 2017 b.
BUREAU INTERNATIONAL DES POIDS ET MESURES (BIPM). International equivalence of measurements: the CIPM MRA. Disponível: https://www.bipm.org/en/cipm-mra/ [capturado em 16 ago. 2019].
GUIMARÃES, E. F., REGO, E. C. P., CUNHA, C. M. H., RODRIGUES, J. M., FIGUEROA-VILLAR, J. D. Certified Reference Material for Traceability in Environmental Analysis: PAHs in Toluene Journal of the Brazilian Chemical Society, v. 25, n. 2, 351-360, 2014.
GUIMARÃES, E. F., RODRIGUES, J. M., DE LA CRUZ, M. H. C., SARTORI, A. V., SOUZA, V. FIGUEROA-VILLAR, J. D. Determination of PAHs: a practical example of validation and uncertainty assessment. Journal of Chromatographic Science, v. 51, 845-855, 2013.
MACKAY, L. G., TAYLOR, C. P., MYORS, R. B., HEARN, R., KING, B. High accuracy analysis by isotope dilution mass spectrometry using a interative exact matching technique. Accreditation Quality Assurance, v. 8, 191-194, 2003.
RODRÍGUEZ-GONZÁLEZ, P., MARCHANTE, G. J. M., ALONSO, J. I. G., SANZ, M. A. Isotope Dilution Analysis for Elemental Specification: A Tutorial Review. Spectrochimica Acta B, v. 60, 151-207, 2005.
SARGENT, M., HARRINGTON, C., HARTE, R. Guidelines for achieving high accuracy in isotope dilution mass spectrometry (IDMS). Analytical and Bioanalytical Chemistry, v. 377, 1091-1092, 2002.
STOKES, P., O'CONNOR, G. Development of a liquid chromatography-mass spectrometry method for the high-accuracy determination of creatinine in serum. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, v. 794, n.1, 125-136, 2003.









