Estudo Cinético da Degradação do Corante Amarelo Tartrazina por Processos Oxidativos Avançados
ISBN 978-85-85905-25-5
Área
Ambiental
Autores
Santos, D.M. (UFPE) ; Silva, M.G.N. (UFPE) ; Aquino, R.V.S. (UFPE) ; Barbosa, A.A. (UFPE) ; Carvalho, R.F. (UFPE) ; Silva, M.G. (UFPE) ; Irineu, M.D. (UFPE) ; Duarte-coelho, A.C. (UFPE) ; Rocha, O.R.S. (UFPE)
Resumo
Um dos fatores responsáveis pela poluição hídrica é o descarte inadequado e sem tratamento de efluentes industriais. Os Processos Oxidativos Avançados (POA) aparecem como uma forma alternativa e eficaz no tratamento desses efluentes. No presente trabalho foi realizado um estudo com o corante alimentício Amarelo Tartrazina, comparando o percentual de degradação do corante utilizando POA com H2O2, ZnO, TiO2 e CuO sob radiação UVC, em seguida foi realizado um estudo cinético para uma análise mais completa dos resultados. O sistema UVC/H2O2 apresentou a maior eficiência, com uma degradação total do corante em 90 minutos. Os sistemas contendo os fotocalisadores ZnO e TiO2 também apresentaram eficiência na remoção do corante.
Palavras chaves
POA; corante; radiação UVC
Introdução
As indústrias são lançadoras de rejeitos que, frequentemente, afetam os recursos hídricos. Indústrias distintas apresentam quantidades elevadas de corantes em seus efluentes (DOTTO et al., p.3230, 2016). No ramo alimentício, portanto, corantes, como o Amarelo Tartrazina, são adicionados aos alimentos com o intuito de garantir um aspecto que atraia os consumidores e forneça a aparência que foi perdida durante o processo de produção (YAMJALA; NAINAR; RAMISSETI, p.813, 2016). Os corantes sintéticos são favorecidos em relação aos naturais, devido a sua alta estabilidade à luz, ao oxigênio, ao calor, à variação de pH e pelo fato de promover uma coloração mais homogênea quando aplicados (NASCIMENTO JÚNIOR et al, p.304, 2018). Os corantes presentes nos efluentes industriais prejudicam a disponibilidade e a qualidade da água própria para o consumo. Além disso, altera ciclos biológicos, devido ao comprometimento da passagem de luz solar, interferindo nos processos fotossintéticos. (NATARAJAN; BAJAJ; TAYADE, p.202, 2018). Desse modo, o tratamento desses contaminantes faz-se necessário. Desafios ambientais e tecnológicos ainda existem, visto que os processos convencionais de tratamento, em alguns casos, não são eficazes, pois, ao invés de tratar por completo, geram outros tipos de poluentes (DEWIL et al, p.93, 2017). Então, novos estudos vêm sendo realizados e alternativas surgem a fim de solucionar este problema, entre elas, os Processos Oxidativos Avançados (POA) aparecem mostrando eficiência no ponto de vista econômico, técnico e ambiental para o tratamento de efluentes (RAMOS et al., p.510, 2018). Os POA geram e utilizam, principalmente, radicais hidroxila para oxidar compostos orgânicos, visto que esses radicais apresentam alto poder oxidante (E° = 2,8V), são altamente reativos, praticamente não seletivo e de fácil obtenção. Após a reação de oxidação, são formados compostos mais simples, e em caso de mineralização, é produzido dióxido de carbono, água e sais inorgânicos (BOCZKAJ; FERNANDES, p.610, 2017). Os POA se dividem em duas categorias, sistemas homogêneos e heterogêneos (REZA, KURNY, GULSHAN, p.1569, 2017). Um dos métodos de oxidação química homogênea que tem sido amplamente estudado é o uso do peróxido de hidrogênio (H2O2) em conjunto com a radiação UV (NAVARRO; GABALDÓN; GOMÉZ-LOPÉZ, p.888, 2017). Esse processo envolve a fotólise do peróxido de hidrogênio (fotoperoxidação) para gerar radicais hidroxila. Nos sistemas heterogêneos a formação dos referidos radicais ocorre por meio do uso de radiação na presença de semicondutores, que nesse caso atuam como fotocatalisadores (SOARES; ALVES, p.339, 2018). Por causa da irradiação dos fótons, elétrons (e-) na superfície do semicondutor são excitados para a banda de condução, deixando lacunas positivas na banda de valência. As lacunas podem reagir com doadores de elétrons presente na solução, a fim de gerar radicais oxidantes fortes, e estes oxidarem os compostos orgânicos. Ou, podem simplesmente, oxidar os substratos por transferência direta de elétrons (REZA, KURNY, GULSHAN, p.1570, 2017). O presente trabalho tem como objetivo analisar a eficiência dos POA na degradação do corante alimentício Amarelo Tartrazina em sistemas contendo H2O2, TiO2, ZnO e CuO em conjunto com radiação UVC, e realizar um estudo cinético comparativo dos sistemas.
Material e métodos
ESTUDO DE DEGRADAÇÃO- Nos ensaios de degradação foram utilizados o corante Amarelo Tartrazina (AT) fornecido por F.Trajano com concentração 15 mg.L-1. O oxidante peróxido de hidrogênio (H2O2) e os fotocatalisadores dióxido de titânio P25 (TiO2), óxido de zinco (ZnO) e óxido de cobre II (CuO) foram obtidos de Evonik Degussa Brasil Ltda., Biodinâmica Química e Farmacêutica Ltda. e VETEC, respectivamente. Os testes de fotodegradação foram feitos nos sistemas: UVC/H2O2, UVC/TiO2, UVC/ZnO e UVC/CuO. Nos sistemas foram usados 0,1 g dos fotocatalisadores (TiO2, ZnO e CuO) e 5,96 mmol.L-1 do peróxido de hidrogênio (obtido através de cálculos estequiométricos), com a utilização de uma lâmpada de radiação UVC (ILUMISAMPA, 20 W). Os experimentos foram executados em recipientes de vidro com formato cilíndrico e volume de 400 mL (altura de 5,5 cm e diâmetro de 9,0 cm). Em todos os sistemas houve agitação magnética (FISATOM, 751). Em cada experimento fez-se o uso de um volume fixo de 300 mL da solução de AT. Inicialmente, os sistemas com os fotocatalisadores ficaram 30 minutos sob ausência de luz, para ocorrer o equilíbrio de adsorção. Os testes de fotodegradação tiveram duração de 90 minutos, com coleta de amostras nos seguintes tempos: 1,5, 15, 30, 45, 60, 75 e 90 minutos. Posteriormente, a absorbância das amostras foi medida em um espectrofotômetro UV-Visível (SPECTROQUANT PHARO, 300) no comprimento de onda (λ) de 427 nm. Assim, a degradação da solução de corante AT mediante o efeito da fotocatálise foi observada. ESTUDO CINÉTICO- Foi realizado um ajuste do modelo cinético de pseudo- primeira ordem (Equação 1) em relação aos dados experimentais usando o software OriginPro 8 (AQUINO et al, p. 2506, 2019; NGUYEN; JUANG, p.273, 2015, KAUR; BANSAL; SUD, p. 386, 2013). Para cada estudo, determinou-se o coeficiente de regressão linear (R²), a constante de velocidade da reação (k), o erro puro, o erro residual e o tempo de meia vida em t=0. ln([C]/[Co]) = - kt (1) Na equação 1, C é a concentração do corante variando com o tempo e Co é a concentração inicial.
Resultado e discussão
O comportamento da degradação do corante AT para os sistemas UVC/H2O2,
UVC/ZnO, UVC/TiO2 e UVC/CuO é apresentado na Figura 1. Os resultados
experimentais mostraram que o sistema UVC/H2O2 obteve uma maior eficiência
na degradação, visto que no tempo de 90 minutos ocorreu a remoção de todo o
corante (100%). Nesse mesmo tempo, o sistema UVC/ZnO, apresentou remoção de
85,24%, seguido do UVC/TiO2 (69,36%) e por último o UVC/CuO (16,03%), com
uma taxa de degradação pequena quando comparado com outros sistemas
estudados.
A melhor eficiência no sistema UVC/H2O2 pode ser explicada pela geração de
radicais hidroxila ser prevalecida pelo fato da molécula do peróxido de
hidrogênio ser quebrada em comprimentos de onda λ < 290nm, e a radiação do
tipo UVC emitir comprimentos de onda na faixa de 100-280 nm. Enquanto, por
exemplo, o semicondutor TiO2 possui maior eficiência de fotoativação em
comprimentos de onda entre 300-390 nm (NASCIMENTO JÚNIOR et al, p.4, 2019).
Pesquisas alegaram que a eficiência quântica do ZnO é
consideravelmente maior que a do TiO2, justificando sua maior eficiência no
experimento (CHAKRABARTI; DUTTA; p.269, 2004). O CuO é um semicondutor do
tipo-P com banda gap estreita de ~1,2 eV. O desempenho do CuO é fortemente
influenciado pela sua morfologia e natureza cristalográfica. Morfologias
regulares com superfície rugosa aumentam a área da superfície e
consequentemente, apresentam locais para a fotocatálise (ANDRADE NETO et al,
p. 651, 2019).
Assim, a natureza do composto orgânico e das estruturas presentes
é fundamental no primeiro passo de um processo fotocatalítico. A baixa
eficiência do sistema contendo o CuO na degradação de AT pode ser explicada
pela influência da sua morfologia, estrutura eletrônica, efeito de carga e
superfície.
ESTUDO CINÉTICO- A Tabela 1 apresenta os resultados obtidos com um ajuste do
modelo cinético de pseudo-primeira ordem, visto que a degradação tende a
seguir esse modelo enquanto o corante encontra-se em excesso, e a constante
global da taxa cinética (ou constante de velocidade) depende apenas da
concentração dos radicais oxidantes (NASCIMENTO JÚNIOR et al, p.4, 2019).
Como o experimento contendo o fotocatalisador CuO na presença de radiação
UVC não foi eficiente na degradação do corante, optou-se por não prosseguir
com referido sistema no estudo cinético.
A eficiência dos sistemas pode ser comparada pelos valores da constante
global de taxa cinética (k) (WU; CHANG, p.267, 2006). Como a melhor
eficiência se deu no sistema UVC/H2O2, este apresentou a melhor velocidade
de degradação, ou seja, a remoção do corante ocorre mais rapidamente,
resultando, portanto, em um tempo de meia vida menor desse contaminante
orgânico.
Os sistemas UVC/H2O2, UVC/ZnO e UVC/TiO2 apresentaram um coeficiente
de regressão linear maior que 0,98, que significa que tais sistemas atendem
de forma satisfatória ao ajuste de modelo cinético de pseudo-primeira ordem.
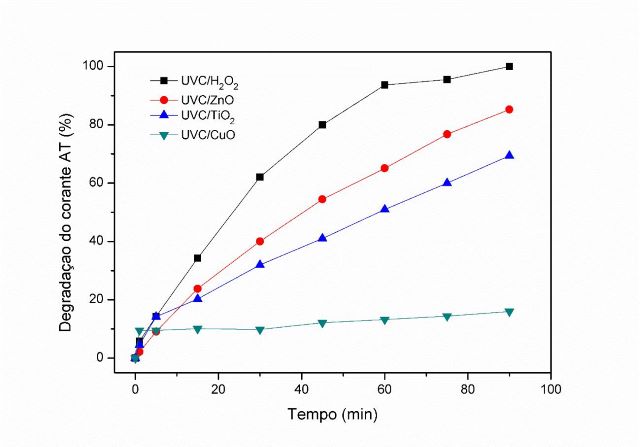
Percentual de degradação do corante AT em função do tempo nos referidos sistemas.
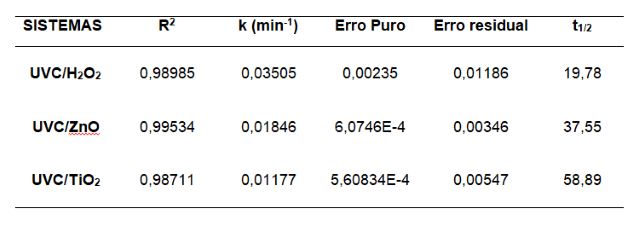
Dados do estudo cinético – Coeficiente de regressão linear (R²), constante de velocidade (k), erro puro, erro residual e tempo de meia vida.
Conclusões
Dentre os sistemas estudados no presente trabalho, o sistema mais eficiente na degradação do corante AT foi o UVC/H2O2. A ordem de eficiência dos experimentos foram UVC/H2O2 > UVC/ZnO > UVC/TiO2 >> UVC/CuO. O teste contendo o CuO não apresentou eficiência na degradação do corante, enquanto que o ZnO e o TiO2 atuaram de forma significativa na degradação do AT. O ajuste do modelo cinético de pseudo-primeira ordem representou de forma adequada os sistemas que apresentaram eficiência na degradação com R²>0,98 e a constante global de taxa cinética (k) é representativa na comparação dos referidos sistemas.
Agradecimentos
A Universidade Federal de Pernambuco pela disponibilização de recursos e estrutura laboratorial necessários para a realização deste trabalho.
Referências
ANDRADE NETO, N. F.; OLIVEIRA, P. M.; NASCIMENTO, R. M.; PASKOCIMAS, C. A.; BOMIO, M. R. D.; MOTTA, F. V. Influence of pH on the morphology and photocatalytic activity of CuO obtained by the sonochemical method using different surfactants. Ceramics International, v. 45, 651-658, 2019.
AQUINO, R. V. S.; BARBOSA, A. A.; RIBEIRO, L. B.; OLIVEIRA, A. F. B.; SILVA, J. P.; AZOUBEL, P. M.; ROCHA, O.R.S. Degradation of leaf Green food dye by heterogeneous photocatalysis with TiO2 over a polyethylene terephthalate plate. Chemical Papers, v. 73, 2501-2512, 2019.
BOCZKAJ, G.; FERNANDES, A. Wastewater treatment by means of advanced oxidation processes at basic pH conditions: A review. Chemical Engineering Journal, v.320, 608-633, 2017.
CHAKRABARTI, S.; DUTTA, B. K. Photocatalytic degradation of model textile dyes in wastewater using ZnO as semiconductor catalyst. Journal of Hazardous Materials, v. B112, 269-278, 2004.
DEWIL, R.; MANTZAVINOS, D.; POULIOS, J. RODRIGO, M. A. New perspectives for Advanced Oxidation Processes. Journal of Environmental Management, v.195, 93-99, 2017.
DOTTO, G. L.; RODRIGUES, F. K.; TANABE, E. H.; FRÖHLICH, R.; BERTUOL, D. A.; MARTINS, T. R.; FOLETTO, E. L. Development of chitosan/bentonite hybrid composite to remove hazardous anionic and cationic dyes from colored effluents. Journal of Environmental Chemical Engineering, v.4, 3230–3239, 2016.
KAUR, P.; BANSAL, P.; SUD, D. Heterostructured Nanophotocatalysts for degradation of Organophosphate Pesticides from Aqueous Streams. Journal of the Korean Chemical Society, v. 57, n° 3, 382-388, 2013.
NASCIMENTO JÚNIOR, W. J.; ROCHA, O. R. S.; DANTAS, R. F.; SILVA, J. P.; BARBOSA, A. A. Kinetic study of food dyes removal from aqueous solutions by solar heterogeneous photocatalysis with artificial neural networks and phytotoxicity assessment. Desalination and Water Treatment, v.104, 304-314, 2018.
NASCIMENTO JÚNIOR, W. J.; AQUINO, R. V. S.; BARBOSA, A. A.; ROCHA, O. R. Development of a new PET flow reactor applied to food dyes removal with advanced oxidative processes. Journal of Water Process Engineering, v. 31, 1-7, 2019.
NATARAJAN, S.; BAJAJ, H. C.; TAYADE, R. J. Recent advances based on the synergetic effect of adsorption for removal of dyes from waste water using photocatalytic process. Journal of Environmental Sciences, v.65, 201-222, 2018.
NAVARRO, P.; GABALDÓN, J. A.; GÓMEZ-LÓPEZ, V.M. Degradation of an azo dye by a fast and innovative-pulsed light/H2O2 advanced oxidation process. Dyes and Pigments, v. 136, 887-892, 2017.
NGUYEN, A. T.; JUANG, R. S. Photocatalytic degradation of p-chlorophenol by hybrid H2O2 and TiO2 in aqueous suspensions under UV irradiation. Journal of Environmental Management, v. 147, 271-277, 2015.
RAMOS, J. M. P.; CARVALHO, C. M.; PAIVA e SILVA, C. L.; TONHOLO, J. Processos Oxidativos Avançados no tratamento de efluente contendo Verde Malaquita: Estudo Prospectivo. Cad. Prospec. Edição Especial, v.11, 509-520, abr./jun. 2018.
REZA, K. M.; KURNY, A.; GULSHAN, F. Parameters affecting the photocatalytic degradation of dyes using TiO2: a review. Applied Water Science, v.7, 1569–1578, 2017.
SOARES, L.; ALVES, A. Photocatalytic properties of TiO2 and TiO2/WO3 films applied as semiconductors in heterogeneous photocatalysis. Materials Letters, v.211, 339–342, 2018.
YAMJALA, K.; NAINAR, M. S.; RAMISETTI, N. R. Methods for the analysis of azo dyes employed in food industry – A review. Food Chemistry, v.192, 813-824, 2016.
WU, C. H.; CHANG, C.L. Decolorization of Reactive Red 2 by advanced oxidation processes: Comparative studies of homogeneous and heterogeneous systems. Journal of Hazardous Materials, v. B128 ; 265-272, 2006.









