ALTERAÇÕES MORFOLÓGICAS E NA EXPRESSÃO GÊNICA DE ZEBRAFISH (Danio rerio) OCASIONADAS PELO INSETICIDA ENDOSULFAN QUANTIFICADO EM ALFACE CRESPA
ISBN 978-85-85905-25-5
Área
Ambiental
Autores
Mello, G.G. (UNIVERSIDADE FEDERAL DE JATAÍ) ; Gonçalves, B.F. (UNIVERSIDADE FEDERAL DE JATAÍ) ; Souza, I.F.C. (UNIVERSIDADE FEDERAL DE JATAÍ) ; Oliveira, G.A. (UNIVERSIDADE FEDERAL DE JATAÍ) ; Machado, M.R.F. (UNIVERSIDADE FEDERAL DE JATAÍ) ; Gielfi, F. (UNIVERSIDADE FEDERAL DE JATAÍ) ; Oliveira, F.M. (UNIVERSIDADE FEDERAL DE JATAÍ) ; Malaquias, K.S. (UNIVERSIDADE FEDERAL DE JATAÍ)
Resumo
O uso de produtos fitossanitários na agricultura tem trazido preocupações devido aos seus efeitos em organismos vivos visto que estes causam danos agudos e crônicos. Para avaliar os efeitos de toxidade do endosulfan na análise de alterações morfológicas e na expressão gênica dos embriões de Zebrafish, os mesmos foram submetidos a soluções em concentrações encontradas em alface crespa. Ao fim da avaliação os embriões apresentaram uma taxa significativa de mortalidade além de uma série de teratogenias. O teste em zebrafish indica que, ainda que as concentrações encontradas estejam abaixo da ingestão diária aceitável, o endosulfan pode causar danos no desenvolvimento embrionário, evidenciando a elevada toxicidade deste defensivo agrícola.
Palavras chaves
Endosulfan; Danio Rerio; Expressão gênica
Introdução
O desenvolvimento das práticas agrícolas proporcionou o aumento da produção e redução da perda de produtividade (AGRODEFESA, 2018). Os defensivos fitossanitários foram inseridos nesse meio visando controlar a ação de insetos e doenças que possam prejudicar as plantações (GODOY e OLIVEIRA, 2008). Alguns desses produtos químicos podem causar efeitos adversos em organismos vivos, como é o caso do endosulfan, classificado como um poluente orgânico persistente (POPs). Este inseticida foi banido do Brasil em 2010, contudo pode ser adquirido de forma ilegal e seu uso contamina solo, água de rios, mananciais e lençol freático (ALMEIDA e BARBOSA, 2013). Para o estudo do efeito toxicológico, um modelo que está sendo usado atualmente é o Zebrafish (Danio rerio), pois este apresentar rápido desenvolvimento, transparência embrionária, capacidade de absorver substâncias adicionadas diretamente na água, baixo custo de criação e manutenção. Além disso, tem cerca de 70% de grau de homologia aos genes de humanos (RODRIGUES, 2016). A toxicidade também pode ser avaliada por biomarcadores. Os indicadores de genotoxicidade permitem avaliar os efeitos de exposições de compostos químicos ao material genético por meio da avaliação de mutação gênica, dano cromossômico ou lesão no DNA (AMORIN, 2013). No presente estudo foi avaliada a toxicidade do endosulfan residual quantificado em alface crespa, por meio da observação das alterações morfológicas em embriões de zebrafish e biomarcadores de genotoxicidade nos embriões.
Material e métodos
A quali e quantificação do Endosulfan em alface crespa, adquirida de 8 comerciantes diferentes na cidade de Jataí-GO, foi realizada por meio da cromatografia gasosa aliada à espectrometria de massas (CG-EM). O padrão de Endosulfan foi extraído do produto comercial Thiodan CE® (apresenta 35%m/v do ativo), por meio de extração líquido-liquido básica com diclorometano. O Endosulfan extraído foi usado para a confecção da curva de calibração com as seguintes concentrações: 0,5 ppm; 1,00 ppm; 1,5 ppm; 2,00 ppm; 2,5 ppm. As condições iniciais estabelecidas resultaram na equação de reta y = 0,438x - 0,0309 e nos seguintes parâmetros: coeficiente de determinação (r²) 0,998. Para análise do inseticida nas amostras de alface, foram maceradas 100g de folhas, com 30mL de etanol e o extrato submetido a banho ultrasson por 30min. O processo de extração restante foi o mesmo descrito para o Endosulfan (PRESTES, et al., 2009). Para os ensaios de toxicidade, os embriões de zebrafish foram mantidos de acordo com condições laboratoriais padrão de manutenção. Os embriões foram obtidos por cruzamento natural e os viáveis foram selecionados para o estudo. Foram utilizadas as concentrações de endosulfan quantificadas. Para cada concentração, foi utilizado doze embriões distribuídas numa microplaca de cultura de 96 poços contendo um volume final de 200 microlitros (RODRIGUES, 2016). Os efeitos teratogênicos e letalidade, foram analisadas por microscopia de contraste de fase e foram tiradas fotografias a cada 24h. Os testes com os biomarcadores foram realizados utilizando o gene β-actina como gene referência. Os embriões foram armazenados por 48h em thiazol para posterior extração do RNA (AMORIM, 2013).
Resultado e discussão
Os limites de detecção e quantificação foram, respectivamente, ≤ 0,22 ppm e
≤ 0,8 ppm. A análise qualitativa revelou que das oito amostras analisadas
quatro continham resíduos de endosulfan. Destas, três foram quantificadas,
todas abaixo do limite de ingestão diária aceitável (BRASIL, 2018). As
concentrações encontradas foram de: 0,007mg, 0,013mg e 0,018mg. Estas
tiveram efeito de toxicidade testado em zebrafish. Os resultados estão
expostos na tabela 1 e figura 1. Os ensaios da expressão gênica estão em fase
final de análise.
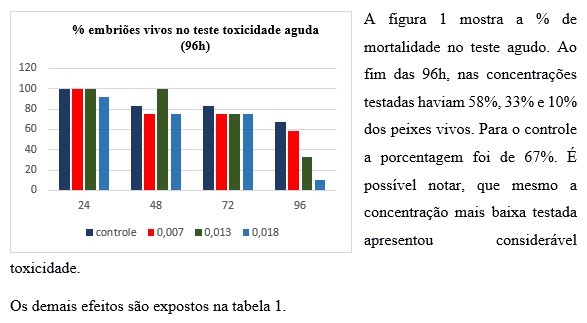
A figura 1 mostra a % de mortalidade no teste agudo.
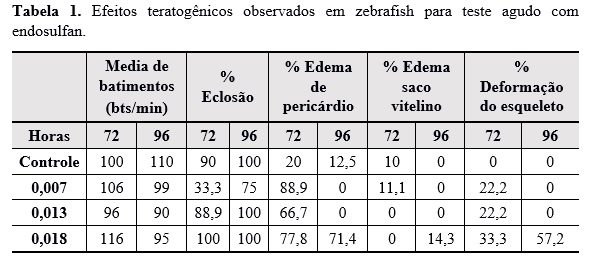
Efeitos teratogênicos observados em zebrafish para teste agudo com endosulfan.
Conclusões
O método de extração líquido-líquido e quantificação por CG-EM mostraram-se eficientes, sendo possível estabelecer LD e LQ baixos. A partir das observações dos resultados de toxicidade obtidos em embriões de zebrafish é concludente que apesar dessas concentrações serem consideradas abaixo do índice de ingestão diário elas podem causar dados no desenvolvimento embrionário tais como edemas de pericárdio e saco vitelino, deformação no esqueleto e retardo na eclosão. Houve uma grande taxa de mortalidade causada pela intoxicação do endosulfan entre o período de 72 a 96 horas.
Agradecimentos
Referências
AGRODEFESA. Lista de Agrotóxicos Goiás. Goiás, Nov. de 2014, atualizado em Jan. de 2018. Disponível em: < http://www.agrodefesa.go.gov.br/post/ver/186593/lista-agrotoxicos-goias>. Acessado em: 09 de set. 2018.
ALMEIDA, do Carmo Diego; BARBOSA, do Carmo Ana Paula. Comportamento ambiental e toxidade dos herbicidas atrazina e simazina. Rev. Ambient, Água vol.8, nº1. Taubaté, São Paulo. Apr. 2013.
AMORIM LCA. O uso de biomarcadores na avaliação da exposição ocupacional a substâncias químicas. Rev Bras Med Trab. 2003; 1(2):124-32.
BRASIL, 2018. Agencia nacional de vigilância sanitária. Disponível em: <http://portal.anvisa.gov.br/duvidas-sobre-agrotoxicos-em-alimentos>. Acesso em: 03 de agosto de 2018.
GODOY, R.C.B. & OLIVEIRA, M.I. Agrotóxicos no brasil: processo de registro, riscos à saúde e programas de monitoramento. Cruz das Almas Bahia. Embrapa mandioca e fruticultura tropical, documentos 134, 2008. p. 30.
PERES, F., MOREIRA, JC., AND DUBOIS, GS. Agrotóxicos, saúde e ambiente: uma introdução ao tema. In: PERES, F., AND MOREIRA, JC., ORGS. É VENENO OU É REMÉDIO?: AGROTÓXICOS, SAÚDE E AMBIENTE. Rio de Janeiro: editora Fiocruz, 2003. p. 21-41.
PRESTES, O.D., FRIGGI, C.A., ADAIME, M.B. e ZANELLA, R.. QuEChERS – um método moderno de preparo de amostra para determinação multirresíduo de pesticidas em alimentos por métodos cromatográficos acoplados à espectrometria de massas. Quim. Nova, v. 32, n 6, p.1620-1634, 2009.
RODRIGUES, V. C. et al. Aspectos Ambientais, Forenses e de Saúde Pública em relação ao uso de Agrotóxicos em um Município do Estado de Goiás, Brasil. Sinergia, Vol. 17, n. 1, p. 56-62, 2016.









