ESTUDO CINÉTICO E ROTAS DA INATIVAÇÃO DE COLIFORMES TERMOTOLERANTES POR PROCESSO FENTON, H2O2/UV-C e UV-C
ISBN 978-85-85905-25-5
Área
Ambiental
Autores
Ramos, R.O. (UFPB) ; Lima, E.D. (UEPB) ; Lopes, W.S. (UEPB) ; Albuquerque, M.V.C. (UEPB) ; Sousa, J.T. (UEPB) ; Araújo, M.C.U. (UFPB) ; Leite, V.D. (UEPB) ; Lopes, W.S. (UEPB)
Resumo
Neste estudo, um reator híbrido UASB/Filtro seguido de processos oxidativos (Fenton, H2O2/UV-C e UV-C) foi empregado no tratamento de esgoto doméstico. A cinética de inativação e rotas de oxidação dos coliformes termotolerantes (TC) foram estudadas. O tratamento microbiológico inativou 97% de TC, reduzindo 99% da turbidez e 98% do COT. Após os processos de oxidação os TC foram completamente inativados e a turbidez (0,1 UNT) e COT (3,8 mg/L), pós Fenton, atenderam as preconizações de potabilidade. A cinética de inativação de TC para Fenton, H2O2/UV-C e UV-C foram melhor ajustados ao modelo de 1° ordem e Fenton apresentou maior contante (0,39/mim). As rotas indicaram que a ação de radicais OH prova oxidação e rompimento nas tês camadas da parede celular, expondo o material genético.
Palavras chaves
Coliformes ; cinética de inativação; rotas de oxidação por POA
Introdução
De modo simplificado, o envelope celular (EC) da E. coli, que representa bem os coliformes termotolerantes, pode ser definido como uma sobreposição de três camadas, a saber: (i) uma membrana externa (OM) composta por uma de base fosfolipídios, na qual predomina a fostatidiletanolamina (PE) e o fosfatidilglicerol (PG), que são ácidos graxos ligados ao glicerol-3-fosfato (Gidden, et al. 2009), e estão revestidos por uma a camada de lipopolissacarídeo constituída principalmente pelo Lipídeo A, que delimita interface célula/meio reacional (Díaz-Mejía et al., 2009; Klein e Raina, 2019); (ii) o periplasma (PP), que é estruturado por cadeias de peptidoglicano, na qual os glicanos (o ácido N-acetilmurâmico e a N-acetilglucosamina ), estão unidos por ligações β, estando reticulados através de filamentos laterais dos peptídeos L-alanina (LA), D-glutamato (DG), ácido diaminopimélico (DP-A) e D- alanina (DA) (Wolf e Underhill, 2018); (iii) uma membrana interna (IM) que consiste em uma bi-camada fosfolipídica, também chamada membrana citoplasmática, formada por moléculas de ácidos graxos ligados ao glicerol-3 fosfato, em que 75% é a fostatidiletanolamina (PE) e 20% fosfatidilglicerol (PG) (Zerbib, 2017; Mohan Babu et al, 2018). A Figura 1 apresenta uma ilustração de uma célula de E. coli, expondo as principais estruturas destas três camadas, com as respectivas organizações e composições químicas. Dentre os processos de oxidação avançada, foto-Fenton, Fenton, H2O2/UV-C e UV-C estão entre os mais citados, contudo, nenhum estudo já desenvolvido apresenta uma abordagem aprofundada para comparação entre tais processos na inativação de coliformes. Além disso, até o presente momento, não foram apresentadas rotas reacionais que explique como ocorre o rompimento da parede celular de um coliforme. Neste estudo, uma planta de tratamento microbiológico/oxidativo foi empregada objetivando a produção de água potável a partir de esgoto doméstico e a cinética de inativação e rotas de oxidação de coliformes totais foram estudadas para os processos Fenton, H2O2/UV-C e UV-C.
Material e métodos
Reagentes: Acetonitrila (99,99%) obtida a partir de Sigma-Aldrich (St. Louis, MO). Sulfato ferroso heptahidratado (95%), peróxido de hidrogênio (35%), hidróxido de sódio (99%) e ácido clorídrico (98%) foram obtidos a partir de Vetec (S. Paulo, BR). Água ultra-pura 18.2 MΩ.cm (Master System MS 2000, Gehaka) foi usada no preparo das soluções. Sistema experimental: Um sistema piloto com processos microbiológicos/oxidativos foi avaliado no tratamento de esgoto doméstico, objetivando a produção de água isenta de coliformes termotolerantes (TC) e com níveis de turbidez e carbono orgânico total (COT) preconizados para águas de reuso potável do tipo A. O sistema de tratamento microbiológico (Figura 2 a-g), foi constituído de um reator anaeróbio híbrido, como descrito por De Sousa et al. (2016), composto por um UASB em sequência com filtro anaeróbio recheado com espumas de poliuretano. O sistema operou uma vazão de entrada 2,5 L/H e a cada 3,2 Hs um sifão descarregava no filtro de areia (regime intermitente e sentido descendente) 8 L do efluente armazenado no tanque de equilíbrio, a uma vazão de 96 L/H. O tratamento por processos oxidativos foram conduzidos em um reator tipo PFR tubular de 7,5 L (figura 2 h- m), equipado com lâmpada UV-C de vapor de mercúrio (254 nm e 15 W), com taxa superficial 22 mW/cm². A lâmina de efluente entre o tubo de quartzo e parede interna do reator foi 73 cm. O reator operou acoplado à um tanque de equalização de 0,5 L e a um trocador de calor do tipo capacitor de vidro, com uma bomba propelindo o efluente a 10 L/mim. Os ensaios de oxidação foram realizados em batelada. Durante a execução dos experimentos, o efluente pré- tratado oriundo do tratamento microbiológico seguia para o reator PFR até o total preenchimento (8 L) e, em seguida, procedia-se as bateladas dos POA. Nos processos H2O2/UV-C (1,5 mmol/L H2O2 e pH 8) e Fenton (0,5 mmol/L Fe(II), 1,5 mmol/L H2O2 e pH 8) empregou-se reagentes em níveis já discutidos na literatura (Fernandes et al. 2014; Rodríguez-Chueca et al., 2015). Estudo cinético: Os perfis cinéticos da inativação de TC dos POA foram testados nos modelos pseudo de 1º e 2º ordem, que são descritos pelas equações 1 e 3, respectivamente. O tempo de meia vida (t1/2) para o modelo de 1º ordem foi determinado através da equação 2, pela equação 4 obteve-se o t1/2 para o modelo de 2º ordem. (ln[Ca] = ln[Ca0] - kt Equação 1); (t1/2 = ln 2 [k][/-1] Equação 2); (1/[Ca] = 1/[Ca0] + kt Equação 3); (t1/2 = [Ca0][/-1] [k][/-1] Equação 4). Procedimentos analíticos: No monitoramento das plantas de tratamento, os pontos de amostragem foram: (i) tanque de equalização contendo o esgoto bruto; (ii) efluente do sistema híbrido UASB/F. anaeróbio (iii) efluente do filtro de areia e (iv) efluente do reator de POA. Durante a etapa oxidação foram coletadas amostras em 0, 5, 15, 30, 45 e 60 min, as análises de TC foram realizadas no instante da amostragem e 24 H após a oxidação.
Resultado e discussão
A concentração de TC no efluente bruto (EB), em base logarítmica, foi de 7,9
UFC 100/mL. O processo de tratamento microbiológico removeu 97,65 %, dos
quais 96,8 % foram removidos no reator híbrido UASB/Filtro anaeróbio e 0,82 %
no filtro de areia. A pesar da significativa remoção de TC, a parcela
remanescente (2,95 %) é da ordem [10][/6] UFC/100 ml. Conforme apresentado na
Tabela (n) da Figura 2, os níveis de turbidez obtidos após os processos Fenton
e H2O2/UV-C já estão abaixo dos níveis preconizados pelas portarias de
potabilidade de águas (EPA, 2012). Contudo, apenas o processo Fenton resultou
em um nível de COT próximo aos limites máximos estipulados para águas naturais
(4 mg [L][/-1]) e para água tratada (2 mg [L][/-1]).
Estudo cinético: As curvas (o) e (p) da Figura 2 apresentam as cinéticas de
inativação de coliformes pelos processos Fenton, H2O2/UV-C e UV-C. Os dados
cinéticos de k e t/2 estão presentes na Tabela (n) da Figura 2. Os
coeficientes de correlação de Pearson (R²) sugerem que o perfil cinético da
inativação de TC por H2O2/UV-C e UV-C foram melhor ajustados ao modelo cinético
pseudo de 1°. Este comportamento cinético também foi identificado por outros
autores durante a inativação de coliformes por radiação UV-C e por ação de
radicais OH• (Ansa et al., 2015; Sun et al., 2016; Garkusheva et al., 2017).
Apesar dos dados para o processo Fenton terem sido insuficientes para cálculo
dos parâmetros cinéticos, pela equação de regressão linear é possível estimar
que a constante cinética de 1º ordem é 0,39/mim. Esta constante é cerca de seis
vezes maior que a do processo H2O2/UV-C e aproximadamente 18 vezes maior que a
de UV-C. O tempo t/2 para inativação de [10][/6] UFC 100/ml de TC para UV-C é
próximo ao dobro do t/2 do H2O2/UV-C. A partir da constante estimada para o
processo Fenton, pode-se obter o t/2 1,77 min.
A diferença das taxas de reação entre estes processos está associada
principalmente formação dos radicais OH•. Na reação Fenton, a formação dos
radicais OH• é intensa no primeiro minuto de reação, em função do processo de
clivagem da molécula de H2O2 que é catalisada pelos íons de ferro. No processo
H2O2/UV-C, a clivagem de H2O2 depende da radiação que promove a fotólize das
moléculas de H2O2.
Proposta de mecanismo reacional para inativação de TC por ação de radicais
OH•: Durante a inativação, a ação dos radicais OH• está voltada para a oxidação
das estruturas apresentadas na Figura 1a. Este processo se inicia com o
rompimento das camadas mais externas do EC, até a exposição do material
genético. No processo apenas com radiação UV-C, a absorção de energia promove o
rompimento de ligações resultando na desnaturação de algumas estruturas. A
Figura 1 (b1) apresenta uma proposta de rota de inativação por ação de radiais
OH• na membrana externa.
Na OM o processo de oxidação é iniciado na interface célula/meio reacional,
com adição de OH• nas ligações C=O dos ácidos graxos ligados a glucosamina,
provocando o rompimento das ligações CO-N e CO-O e resultando na saída das
ramificações na forma de ácidos (3R)-3-hidroxytetradecanoic (C14H28O3) e
pentadecanoic (C15H30O3) (1-Figura 1b). O radical OH• age também na ligação
P=O por abstração de elétrons, o que desencadeia uma reação de abstração de H•
em moléculas água, resultando na conversão P=O para P-OH (1-Figura b1). Com a
saída dos ácidos graxos, a glucosamina e o grupamento fosfato ficam mais
expostos, deste modo, o radical OH• agirá extraindo todos os grupos OH
presentes na molécula (2-Figura b1). Na sequência: (i) OH• irá ligar-se a
glucosamina, rompendo o anel heterocíclico e a ligação C-O-P; (ii) 2-
aminoexane-1,5-diol derivada da glucosamina é oxidada até completa mineração e
(iii) a oxidação do grupamento fosfato resulta no phospinous acid (3-Figura
b1). A próxima camada da OM exposta é formada pela fostatidiletanolamina (PE) e
o fosfatidilglicerol (PG) (Figura 1 b2). A pesar dos grupamentos R ligados ao
glicerol-3-fosfato serem diferentes para PE e PG, a oxidação destas moléculas é
iniciada pelo grupamento fosfato. O mesmo processo de conversão de P=O em P-OH
ocorre como já foi descrito, seguido das reações de abstração dos grupamentos
OH. Em seguida, os ataques dos radicais OH• são voltados para as ligações C-O e
R-O dos ácidos graxos, resultando na formação dos ácidos pentadecanoic
(C15H30O2) e (7E)-hexadec-7-enoic (C16H30O2) (3-Figura 1 b2). Em PE a ação de
OH• na ligação R-O gera hidroxymethanaminiun, enquanto em PG gera propane-
1,2,3-triol. Após estas etapas, a estrutura reticular do PP é o próximo alvo
das reações de oxidação, conforme apresentado na Figura 1 (b3). A oxidação
começa por uma reação de adição de OH• no carbono da ponte β entre o ácido N-
acetilmurâmico (verde) e a N-acetilglucosamina (vermelho) (1-Figura b3). A N-
acetilglucosamina está reticulada apenas por estas ligações em ponte, deste
modo, após a quebra da ligação ela é espalhada no meio reacional e mineralizada
(1-Figura b1). Na sequência: (i) ácido N-acetilmurâmico sofrerá outra adição de
OH• no carbono do anel heterocíclico ligado ao grupamento D-lactato (Azul);
(ii) uma ligação C-OH é formada (2-Figura b3) e (iii) o retículo entre glicano
e peptídeos é quebrado (3-Figura b3) convertendo ácido N-acetilmurâmico em N-
acetilglucosamina. Em seguida, uma adição de OH• ocorre na carbonila que liga o
grupo D-lactato a cadeia de peptídeos, formando (2S)-2-methoxypropanoic acid e
liberando LA-DG-DPA-DA no meio reacional (4-Figura b3). Os carbonos C=O dos
peptídeos sofrerão adição de OH•, resultando na formação dos respectivos
monômeros, que serão mineralizados em sequência. As oxidações de
fostatidiletanolamina (PE) e do fosfatidilglicerol (PG) na IM ocorrem como
descrito para OM, contudo, as reações inicias são voltadas para quebra das
ligações entre os ácidos graxos e a glucosamina, conforme descrito na oxidação
do lipídio A. Após o rompimento de OM e PP a pressão interna já rompe a
estrutura da IM expondo o material genético, que será mineralizado pelos
radicais OH•, inativando de modo definitivo a célula de coliforme. Vale
ressaltar que a desnaturação de algumas estruturas do envelope celular já
provocam a inativação destes organismos, pois muitas das estruturas
responsáveis pelo metabolismo celular são desnaturadas.

Estrutura genérica de uma célula de E. coli e rota de degradação da parede celular. OM - MEMBRANA EXTERNA, PP - PERIPLASMA, IM - MEMBRANA INTERNA.
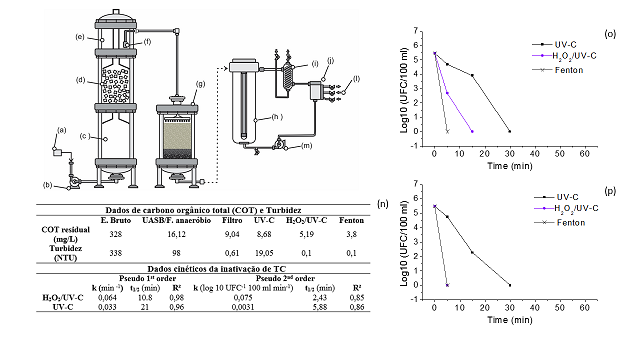
Sistema experimental de tratamento, curvas de inativação de coliformes e tabelas de dados cinéticos, de COT e Turbidez.
Conclusões
Por meio do sistema de tratamento microbiológico/oxidativo foi possível obter, a partir de esgoto doméstico, água isenta de coliformes termotolerantes e com níveis de COT e turbidez preconizados para água potável. As cinéticas de inativação de coliformes obedeceram aos modelo de 1º ordem para todos os processos oxidativos avaliados. Além disso, a velocidade de reação para Fenton foi 6 vezes maior que a de H2O2/UV-C e 16 vezes maior que a de UV-C. As rotas de degradação indicaram que os radicais OH provocam o rompimento da parede celular dos coliformes por meio de mecanismos reacionais que envolvem reações de adição, abstração de elétrons, de hidrogênio e de oxigênio.
Agradecimentos
Ao CNPq A CAPES
Referências
Adiyiah, J. (2015). Sunlight inactivation of faecal coliforms in domestic wastewater, Desalination and Water Treatment, v.57(30), 13979-13986.
Ansa, E. D. O., Andoh, A. H., Nienu, P., Banu, R., Akrong, M., Acheampong, M. A., & Adiyiah, J. (2015). Sunlight inactivation of faecal coliforms in domestic wastewater, Desalination and Water Treatment, v. 57(30), 13979 13986.
Babu, M., Bundalovic-Torma, C., Calmettes, C., Phanse, S., Zhang, Q., Jiang, Y., … Emili, A. (2017). Global landscape of cell envelope protein complexes in Escherichia coli. Nature Biotechnology, v.36(1), 103–112.
De Sousa, J. T., Lima, J. de F., da Silva, V. C., Leite, V. D., & Lopes, W. S. (2016). Recovery of elemental sulphur from anaerobic effluents through the biological oxidation of sulphides. Environmental Technology, v.38(5), 529–537.
Díaz-Mejía, J. J., Babu, M., & Emili, A. (2009). Computational and experimental approaches to chart theEscherichia colicell-envelope-associated proteome and interactome. FEMS Microbiology Reviews, v.33(1), 66–97.
Fernandes, L., Lucas, M. S., Maldonado, M. I., Oller, I., & Sampaio, A. (2014). Treatment of pulp mill wastewater by Cryptococcus podzolicus and solar photo-Fenton: A case study. Chemical Engineering Journal, v.245, 158–165.
Garkusheva, N., Matafonova, G., Tsenter, I., Beck, S., Batoev, V., & Linden, K. (2017). Simultaneous atrazine degradation and E. coli inactivation by simulated solar photo-Fenton-like process using persulfate, Journal of Environmental Science and Health, Part A, v.52(9), 849–855.
Klein, G., & Raina, S. (2019). Regulated Assembly of LPS, Its Structural Alterations and Cellular Response to LPS Defects. International Journal of Molecular Sciences, v.20(2), 356.
Wolf, A. J., & Underhill, D. M. (2018). Peptidoglycan recognition by the innate immune system. Nature Reviews Immunology, v.18(4), 243–254.
Rodríguez-Chueca, J., Ormad, M. P., Mosteo, R., & Ovelleiro, J. L. (2015). Kinetic modeling of Escherichia coli and Enterococcus sp. inactivation in wastewater treatment by photo-Fenton and H 2 O 2 /UV–vis processes. Chemical Engineering Science, v.138, 730–740.
Sun, P., Tyree, C., & Huang, C.-H. (2016). Inactivation of Escherichia coli, Bacteriophage MS2, and Bacillus Spores under UV/H2O2 and UV/Peroxydisulfate Advanced Disinfection Conditions, Environmental Science & Technology, v.50(8), 4448–4458.
United States Environmental Protection Agency, Guidelines for Water Reuse 2012, EPA/600/R-12/618, Office of Wastewater Management, Washington, D.C.









