ESTUDO DA ISOTERMA DE ADSORÇÃO DO Cu(II) EM CINZA DE CASCA DE ARROZ PARA TRATAMENTO DE ÁGUA PRODUZIDA DO PETRÓLEO
ISBN 978-85-85905-25-5
Área
Ambiental
Autores
Silva, E.C. (UFERSA) ; Pereira, K.R.A. (UFERSA) ; Fagundes, F.P. (UNP) ; Fagundes, K.R.S. (UFERSA) ; Silva, G.G. (UNP) ; Gonçalves, F.C.P. (UFERSA)
Resumo
A água produzida (AP) é um efluente da produção de petróleo e apresenta diversos metais tóxicos. O objetivo deste trabalho é o estudo da isoterma de adsorção de íons de Cu(II) utilizando a cinza de casca de arroz (CCA) em meio aquoso. Inicialmente, a CCA foi obtida a partir do processo de calcinação a 500ºC. Os experimentos foram realizados em banho finito, sob agitação e para faixas de concentração do adsorbato e massa do adsorvente pré-determinados. Para construção das isotermas de adsorção, foram utilizados os modelos de Langmuir e Freundlich. Os resultados foram uma eficiência de remoção de 96,52% e capacidade de adsorção de 15,37 mg/g, sendo o modelo de Langmuir que melhor se ajustou aos dados experimentais. Com isto a CCA representa uma aplicação promissora para tratamento da AP.
Palavras chaves
Cinza da casca de arroz; Água produzida; Isotermas de adsorção
Introdução
A água produzida é um efluente de composição complexa, pois apresenta mistura de contaminantes sob a forma de óleos, gorduras, produtos petrolíferos, compostos inorgânicos e sólidos, além de metais pesados. Dentre os quais, o Cu(II) destaca-se em virtude de sua capacidade de complexação e concentração no efluente, necessitando, portanto, de medidas mitigadoras capazes de minimizar o impacto causado por esse metal no meio ambiente (ALI et al., 2019a; AL-GHOUTI et al., 2019; ALI et al., 2019). No estado do Rio Grande do Norte, a exploração e produção de petróleo se apresenta em estágio de declínio de produção. De acordo com AL-GHOUTI et al. (2019), para campos que se encontram em estágio de declínio de produção, conhecidos como campos maduros, o volume de água produzida pode atingir 98% ou uma relação água/óleo de cerca 3/1, onde a produção em um nível global é de 39,5 milhões de metros cúbicos por dia. No Brasil o reuso e descarte da AP são regulados pela Resolução do Conselho Nacional de Meio Ambiente (CONAMA) sendo a resolução 430/2011, na qual dispõe sobre condições, parâmetros, padrões e diretrizes para gestão do lançamento de efluentes em corpos de água receptores. Dentre os metais tóxicos presentes, a resolução trata que os efluentes de qualquer fonte poluidora somente poderão ser lançados no corpo receptor desde que seja obedecida a quantidade de até 1,0 mg.L-1 de cobre dissolvido. Em paralelo a esse problema, o resíduo da agroindústria é responsável por gerar inúmeras fontes de biomassa que não são aproveitadas ou que, simplesmente, não se há aplicação (rejeitos). Entretanto, a cinza da casca de arroz (CCA) tem recebido grande atenção devido às suas propriedades físico- químicas como porosidade e quantidade de grupos funcionais capazes de se ligar física e quimicamente aos metais tóxicos de águas residuais. A CCA apresenta uma estrutura fibrosa, porosa, com alta superfície específica e apresenta alta concentração de sílica na faixa 85 a 95% (FERNANDES et al., 2016; QUESADA et al., 2017), sendo estas características atrativas como material alternativo para aplicação no tratamento de efluentes, especialmente, em processos de adsorção. O processo de adsorção vem sendo bastante aplicado no tratamento da AP de campos de petróleo, devido sua alta seletividade, baixo custo, alta eficiência de remoção de diversos contaminantes. Segundo Sivashankar et al. (2014), a adsorção é um processo físico e/ou químico em que um material é centrado numa superfície sólida a partir do seu ambiente líquido ou gasoso, onde podem ser classificado de natureza física ou química, chamadas respectivamente de fisiossorção ou quimissorção. O critério para desenvolvimento de novos adsorventes envolve fatores de capacidade de adsorção, reciclagem, alta porosidade, superfície do adsorvente e custo. Um dos adsorventes mais comuns é o carvão ativado para remoção de vários compostos orgânicos e íons metálicos, devido suas excelentes características no processo de adsorção, porém sua preparação é cara e economicamente inviável, tornando sua aplicação limitada e não se apresenta em grande disponibilidade (MOR; CHHODEN; RAVINDRA, 2016). Para se ter ideia do mecanismo de adsorção e dos potenciais passos limitantes de velocidade, que podem incluir transporte de massa e reações químicas, alguns modelos matemáticos são reportados na literatura (Langmuir, Freudlich, dentre outros) de forma a mapear o equilíbrio e a cinética de adsorção, parâmetros esses, essenciais no desenvolvimento de novas superfícies adsorventes (THUAN et al.,2017; MOR; CHHODEN; RAVINDRA, 2016) Nesse contexto, esse trabalho tem por objetivo avaliar o estudo da isoterma de adsorção de íons de Cu(II) utilizando as cinzas da casca de arroz (CCA) como adsorvente em meio aquoso, a fim de se obter e compreender os mecanismos envolvidos nas interações entre o adsorvente e o adsorbato. Além disso, avaliar a potencialidade desse bioadsorvente no tratamento da AP de petróleo.
Material e métodos
Inicialmente os bagaços da casca de arroz foram calcinados em temperatura de 500°C por 2 horas com bateladas de 10 gramas de insumo em um equipamento MUFLA modelo 305°C da Shimadzu, seguido de um processo de separação granulométrica em peneiras com diferentes tamanhos de malha, de forma a obter uma granulometria de 150 mesh. Os experimentos foram conduzidos em ensaios em banho finito sendo avaliados diferentes concentrações de CuSO4 (adsorbato) na faixa de 2500-5000 mg/L e concentração de adsorvente na faixa de 1-7 g para um volume de 40 ml da solução. Através da técnica de espectrofotometria na região do UV-visível (equipamento de UV-VIS modelo 201 da SHIMADZU), foi construída uma curva padrão de absorbância (λ = 650 nm) versus concentração de Cu(II) (mg/L), de forma a quantificar indiretamente a eficiência de adsorção em cada meio reacional envolvido. Previamente, foram realizados testes de estabilidade com base na cinética de degradação da amostra ao longo do tempo (120 minutos), em presença do ar atmosférico, luz e umidade, de forma a avaliar possíveis interferências causadas por esses fatores. Os ensaios de adsorção foram realizados em banho finito e em triplicata. Todas as equações envolvidas no processo de adsorção são mostradas na figura 1. A quantidade de adsorbato adsorvido por grama do CCA, representado por qe, foi determinada usando a equação 1 (THUAN et al.,2017; YAGUB; SEM; ANG, 2014), onde: qe é a quantidade do soluto adsorvida no equilíbrio por grama de material seco (mg/L); Co é concentração do soluto na solução inicial (mg/L); Ce é concentração do soluto que permanece em solução no equilíbrio (mg/L); V é volume total da solução (L) e m é a massa do adsorvente (g).. Para avaliar a eficiência de remoção (%) de cada sistema, foi calculado a partir da concentração inicial (Co) e da concentração do soluto que permanece em solução no equilíbrio (Ce), utilizando a equação 2, onde: EF é a eficiência de remoção do adsorbato nas CCA’s (%); Co é concentração do soluto na solução inicial (mg/L) e Ce é concentração do soluto que permanece em solução no equilíbrio (mg/L). Para avaliar o equilíbrio de adsorção a partir da concentração do adsorbato, sendo mantido a massa de adsorvente e tempo de contato ideal, para uma temperatura 25±2°C, velocidade de agitação de 300 rpm e pH igual 6,0. Os modelos teóricos utilizados foram os de Langmuir e Freundlich, sendo a escolha do modelo que melhor ajustar os dados experimentais com base no coeficiente de regressão (R²). As equações na forma linearizada são mostradas nas equações 3 e 4 (THUAN et al.,2017; YAGUB; SEM; ANG, 2014).
Resultado e discussão
A temperatura de calcinação da casca de arroz foi determinada a partir do
trabalho desenvolvido por Cordeiro (2009), na qual
avaliou o efeito da temperatura de calcinação da casca de arroz em relação à
área superficial obtida. Para temperaturas
compreendidas na faixa de 500 e 600°C, foram obtidos os melhores resultados
com valores na faixa de 40,71 e 43,26 m²/g,
respectivamente, onde em temperaturas maiores foi observado um decréscimo
dessa propriedades em decorrência da fusão da
estrutura da sílica que por consequência resulta em um aumento de massa
específica.
A estabilidade da solução aquosa de Cu(II) em função do tempo foi
obtida no intervalo de 120 minutos, sendo que a
cada 30 minutos foi retirada uma amostra da solução e logo realizada sua
leitura utilizando um espectrofotômetro na região
UV-Visível (Comprimento de onda 820 nm). Os valores obtidos foram
praticamente constantes, o que é levado a considerar a
baixa interferência externa no meio reacional, o que caracteriza, portanto,
a alta estabilidade da solução frente a esses
parâmetros, além de que qualquer alteração na concentração do sobrenadante
se dará em função da interação com o adsorvente.
A curva analítica foi construída, conforme figura 1 a) Curva
analítica da solução aquosa de Cu(II), com o intuito de
avaliar indiretamente a concentração final do sobrenadante após o processo
de adsorção, tomando-se por referência o valor da
concentração final do sobrenadante em função da absorbância, sendo o
comprimento de onda utilizado 820nm, o qual melhor
faixa de avaliação de absorbância máxima. De acordo a regressão linear dos
resultados, foi possível a transformação dos
valores de absorbância em concentração final, com um coeficiente de
regressão (R²) superior a 0,99.
A fim de mensurar possíveis alterações nos resultados dos ensaios de
adsorção, foi avaliada a interação dos sistemas
variando apenas a concentração do adsorvente no meio aquoso e respectiva
capacidade adsorvida de contaminante, para um tempo
de contato de 15 minutos, pH de 6,0 e velocidade de agitação de 300 rpm. A
eficiência de adsorção em função da concentração
de adsorvente, é observado na figura 1 b) Eficiência de remoção do Cu(II) em
função da concentração do adsorvente. A partir
disto, observa-se que em maiores proporções da cinza da casca de arroz para
uma concentração inicial de soluto, houve um
aumento da eficiência de remoção de cada sistema utilizado. Para adsorção do
Cu(II), a eficiência variou entre 15,11 a
93,45%, sendo a maior eficiência atingida com 7 g da CCA em um volume de 40
mL de solução, sendo assim, esta concentração
utilizada para realização dos outros ensaios de adsorção. Fato este, devido
a certa massa fixa do adsorvente poder adsorver
uma quantidade máxima de adsorbato (VADIVELAN; KUMAR, 2005). Além disto, os
grupos funcionais presentes na superfície do
adsorvente e da natureza do material precursor são determinantes para
retenção do adsorbato e taxa de adsorção (DOMINGUES,
2005).
Em virtude da casca de arroz ser primariamente formada por sílica,
os resultados de adsorção gerados podem ser
justificados. A fase sólida quando entra em contato com uma fase líquida, a
superfície do sólido fica carregada, ou seja,
com excesso de carga que consequentemente polariza a interface e altera as
propriedades das duas fases. No caso da sílica
contida no CCA, a superfície está carregada negativamente, o que é
responsável por promover uma ou várias camadas para
tentar neutralizá-la. Os íons de Cu(II) podem, então, ser adsorvidos nos
locais onde os átomos de oxigênio possuem ligações
incompletas na superfície do adsorvente amorfo (CCA), através de forças
eletrostáticas (PREZZI et al., 1997).
A isoterma do processo de adsorção do Cu(II) na superfície da CCA foi obtida
relacionando a capacidade adsorvida (qe) em
função da concentração do adsorbato no equilíbrio (Ce), conforme figura 2 a)
Isoterma de adsorção do Cu(II). A partir do
gráfico se obteve uma capacidade adsorvida no equilíbrio de 15,37 mg/g. De
acordo com Srivastava; Mall; Mishra (2006),
durante o processo de adsorção de íons metálicos na superfície da CCA,
ocorre a hidrólise do dióxido de silício, sendo
produzido o grupo SiOH (grupo silanol). Esse processo é responsável por
promover uma reação de troca catiônica ocorrida pela
substituição dos grupos silanol na superfície dos íons metálicos da solução.
Os modelos matemáticos de Langmuir e Freundlich foram aplicados aos dados
experimentais a partir das funções linearizadas de
cada modelo, obtendo-se os gráficos conforme a figura 2 b) Modelos de
Langmuir e Freundlich. Com isto foram determinados os
parâmetros de cada modelo, conforme apresentado figura 2 c) Parâmetros
modelos de Langmuir e Freundlich. Como o modelo de
Langmuir se ajustou melhor para os dados experimentais, isto conferido pelo
coeficiente de regressão (R²) superior a 0,99,
tem-se que o processo de adsorção ocorre em monocamada, onde cada sítio de
adsorção só interage com uma única molécula. Esse
modelo parte da premissa da existência de um número definido de sítios,
todos de mesma energia, e de que as moléculas do
adsorbato não interagem umas com as outras (YAGUB; SEM; ANG 2014). Além
disso, foi obtida a capacidade máxima adsorvida (qm)
de 15,47 mg/g e a constante de Langmuir (KL) de 0,047 L/mg. A Figura 2 d)
ilustra as isotermas de adsorção dos modelos em
função dos dados experimentais. De acordo com os gráficos apresentados, há
um melhor ajuste dos dados experimentais à
isoterma de Langmuir, conforme discutido previamente nesse trabalho.
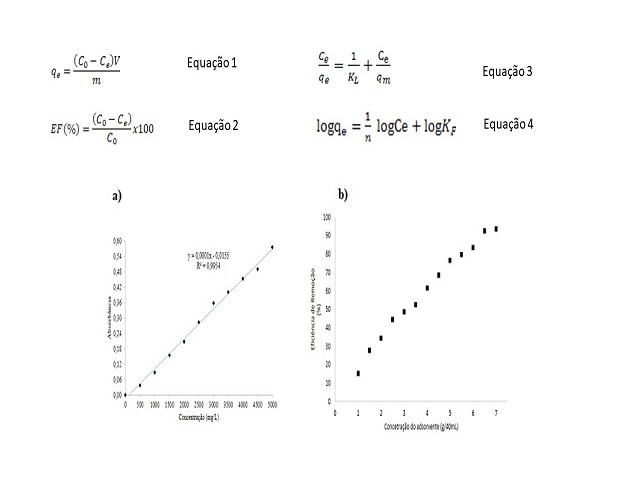
Equações envolvidas no calculo do processo de adsorção e gráficos a)curva analítica e b)eficiência de remoção em função da concentração do adsorvente.
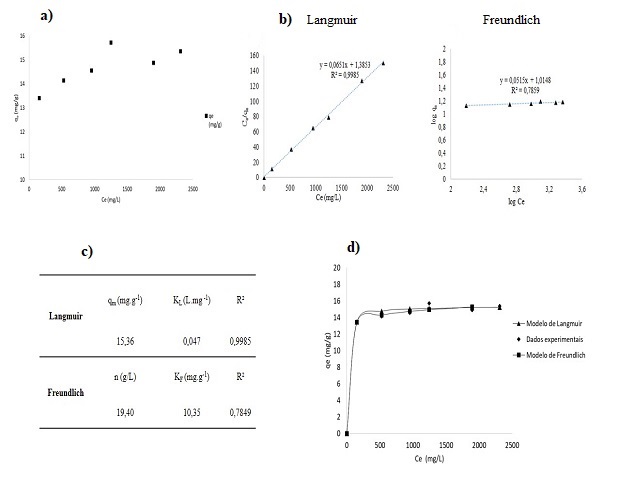
a) Isoterma de adsorção, b) Modelo de Langmuir e modelo Freundlich, c) parâmetros dos modelos teóricos e d)comparação das isotermas de adsorção.
Conclusões
Através dos ensaios de adsorção foi possível quantificar o máximo de Cu(II) a ser adsorvido na matriz da CCA. Os resultados apontam uma eficiência de remoção próxima a 97 % utilizando um tempo de 15 minutos e 7g de adsorvente para um volume de solução de 40 mL. Resultados esses, evidenciados em função da cinética e equilíbrio de adsorção através do modelo teórico de Langmuir. Além disso, foi observado uma capacidade máxima de adsorção de 15,47 mg/g, para faixa de concentração inicial de adsorbato de 2500 a 5000 mg/L para a mesma concentração de adsorvente e volume de solução. A adsorção de cobre na superfície das cinzas de casca de arroz pode ser descrita satisfatoriamente pelo modelo de Langmuir. Isto indica que os sítios de adsorção desses adsorventes podem ser considerados uniformes e o processo ocorre em monocamadas. Desse modo, a utilização da cinza da casca de arroz representa uma opção promissora para a preparação de adsorvente de baixo custo, especialmente para a remoção de metais pesados contidos em efluentes oriundos da exploração e produção de petróleo. O entendimento desses mecanismos de adsorção utilizando como suporte CCA, representa um desafio-chave no desenvolvimento de novas metodologias renováveis capazes de aumentar a eficiência de adsorção em diferentes meios reacionais.
Agradecimentos
Os autores agradecem à Universidade Potiguar – Campus Mossoró-RN, pelo apoio e suporte.
Referências
AL-GHOUTI, M. A. et al. Produced water characteristics, treatment and reuse : A review. Journal of Water Process Engineering, v. 28, n. February, p. 222–239, 2019.
ALI, N. et al. Environmental perspectives of interfacially active and magnetically recoverable composite materials – A review. Science of the Total Environment, v. 670, p. 523–538, 2019.
BRASIL. MINISTÉRIO DO MEIO AMBIENTE. CONSELHO NACIONAL DO MEIO AMBIENTE. Resolução CONAMA nº 430, de 13 de maio de 2011. Dispõe Sobre As Condições e Padrões de lançamento de Efluentes, Complementa e Altera resolução no 357, de 17 de Março de 2005, Do conselho Nacional do Meio Ambiente-conama. [S.l], Disponível em: <http://www.labb.com.br/wp-content/pdf/Resolucao_CONAMA_430_11.pdf>. Acesso em: 05 março. 2019.
DOMINGUES, V. M. F. Utilização de um produto natural (cortiça) como adsorvente de pesticidas piretróides em águas. Tese (Doutorado em Engenharia Química) - Faculdade de Engenharia da Universidade do Porto, Porto. 2005.
FERNANDES, I. J. et al. Characterization of rice husk ash produced using different biomass. Fuel, v.165, p. 351-359, 2016.
MOR, Suman; CHHODEN, Kalzang; RAVINDRA, Khaiwal. Application of agro-waste rice husk ash for the removal of phosphate from the wastewater. Elsevier Journal of Cleaner Production. 673- 680. 2016.
PREZZI, M.; MONTEIRO P.J.M.; SPOSITO, G. The alkali–silica reaction: Part I. Use of double-layer theory to explain the behavior of reaction product gels. ACI Materials Journal, 123, 1997.
QUESADA, D. E. et al. Characterization and evaluation of rice husk ash and wood ash in sustainable clay matrix bricks. Ceramics International, 43, p. 463-475, 2017.
SIVASHANKAR, R. et al. Magnetic composite an environmental super adsorbent for dye sequestration – A review. Environmental Nanotechnology, Monitoring & Management, v. 1–2, p. 36–49, 2014.
SRIVASTAVA, Vimal Chandra; MALL, Indra Deo; MISHRA, Indra Mani. Characterization of mesoporous rice husk ash (RHA) and adsorption kinetics of metal ions from aqueous solution onto RHA. Journal of Hazardous Materials. B134, 257–267, 2006.
THUAN, Tran Van; QUYNH, Bui Thi Phuong; NGUYEN, Trinh Duy; Van Thi HO, Thanh; BACH, Long Giang. Response surface methodology approach for optimization of Cu2+, Ni2+ and Pb 2+ adsorption using KOH-activated carbon from banana peel. Surfaces and Interfaces, 209–217, 2017.
VADIVELAN, V.; KUMAR K. Vasanth. Equilibrium, kinetics, mechanism, and process design for the sorption of methylene blue onto rice husk. Elsevier. Journal of Colloid and Interface Science. pág 90–100. 2005.
YAGUB, Mustafa T.; SEN Tushar Kanti ; ANG M. Removal of cationic dye methylene blue (MB) from aqueous solution by ground raw and base modified pine cone poder. Environmental Earth Sciences. 71, 1507–1519, 2014.









