ADSORÇÃO DE ÁCIDO ACETILSALICÍLICO EM CARBONOS ATIVADOS
ISBN 978-85-85905-25-5
Área
Ambiental
Autores
Penha, V.C.S. (UFERSA) ; Sousa, D.I.S. (UFERSA) ; Frutuoso, R.M.S. (UFERSA) ; Soares, A.L.B. (UFERSA) ; Ferreira, V.S.C. (UFERSA) ; Cavalcante, M.R.S. (UFERSA) ; Barbosa, A.R.S. (IFRN) ; Bezerra, D.P. (IFRN) ; Rios, R.B. (UFERSA) ; Silva, F.W.M. (UFERSA)
Resumo
Nesse estudo, amostras de carbonos ativados (CA) comercial (CAC) e sintetizado (CAS) foram avaliadas na adsorção de ácido acetilsalicílico (AAS) em solução aquosa. Realizou-se a caracterização dos materiais em relação ao ponto de carga zero (pHpcz). Previamente, aos experimentos de adsorção, foi realizado o teste de pH para identificar qual meio concede maior capacidade de adsorção. Foram feitas cinéticas de adsorção utilizando os pH’s 2 (ideal), 6,43 (pHpcz) e 8 para o CAC e o pH 2 (ideal) para o CAS. No estudo das isotermas, os modelos de Langmuir e Freundlich se ajustaram bem aos dados experimentais. A 30 oC e concentração de equilíbrio de 116 mg/L, capacidades de adsorção de 125 e 60 mg AAS/g de CA foram observadas para o CAC e CAS, respectivamente.
Palavras chaves
Ácido Acetilsalicílico; Adsorção; Carbono Ativado
Introdução
A contaminação do meio ambiente a partir de compostos farmacêuticos ativos, desencadeou a necessidade de desenvolver tecnologias no intuito de remover esses poluentes encontrados na água. Os fármacos são considerados contaminantes emergentes de ambientes aquáticos com potenciais efeitos nocivos ao bioma e a saúde humana (BURKINA et al., 2015). Diversos estudos indicam que estas substâncias podem agir como desreguladores endócrinos, podendo interferir nas atividades biológicas dos organismos enquanto os antibióticos, por sua vez, podem contribuir para a resistência bacteriana (DEBLONDE et al., 2011). Os fármacos são exemplos de contaminantes na água que não são totalmente removidos pelos métodos de separação convencionais aplicados nas estações de tratamento de água, e são chamados de micropoluentes emergentes por terem sido detectados e quantificados pelo avanço de novas técnicas analíticas. Com o intuito de remover esses compostos, novas tecnologias de separação são avaliadas, entre elas a adsorção (RIVERA-UTRILLA, 2013). A remoção por adsorção de fármacos diluídos em água tem sido amplamente estudada, usando principalmente carbono ativado como adsorvente (HOPPEN,2017; FERREIRA et al., 2018; SOUSA et al., 2019). Diante dessas considerações, o presente trabalho visa ao estudo experimental da adsorção do fármaco ácido acetilsalicílico (AAS) em amostras de carbono ativado. O AAS é um dos fármacos descartados de forma incorreta pela população, sendo um dos medicamentos mais comumente detectados na água. A metodologia consiste na medição de dados fundamentais de cinética de adsorção e de equilíbrio de adsorção para avaliar a remoção do AAS sob diferentes condições experimentais (natureza porosa do adsorvente, pH, concentração de AAS, etc).
Material e métodos
MATERIAIS Adsorvato O ácido acetil salicílico foi utilizado como adsorvato. O fármaco foi obtido na forma pulverizada junto a empresa FAGRON, com pureza nominal de 100%. As soluções aquosas foram preparadas usando água milli Q no pH e concentração desejados. Adsorvente O adsorvente utilizado foi um carbono ativado comercial (CAC), denominado por WV1050 produzido pela empresa Mead-Westvavo (RIOS, 2015). Para efeito de comparação, foi usado um carbono ativado sintetizado (CAS) a partir de caroço pêssego, denominado por A10a Xp=0,9 (MAIA et al., 2018). MÉTODOS CARACTERIZAÇÃO DO ADSORVENTE Os adsorventes foram caracterizados em relação ao potencial de carga zero (pHpcz). Já a caracterização textural (área superficial, volume de microporos, microporosidade, etc.)está descrita em SOUSA et al. (2019). Potencial de Carga Zero (pHPCZ) O ponto de carga zero é quando valor de carga líquida superficial do adsorvente é nula, ou seja, a quantidade de cargas negativas é igual às de cargas positivas. Os testes foram realizados em duplicata. A metodologia completa está descrita em SOUSA et al. (2019). ENSAIOS DE ADSORÇÃO Teste de pH Este experimento consiste em determinar qual o pH que concede maior quantidade adsorvida de ácido acetil salicílico. Os pH’s avaliados foram 2, 5, 8, 11 e o pHpcz. Cinética de Adsorção Nos experimentos de cinética, foi obtido o tempo de equilíbrio para adsorção do ASS nos adsorventes. Foram preparadas soluções aquosas usando água milli Q com concentração inicial de 100 mg/L em diferentes pHs. Isoterma de Adsorção As isotermas de adsorção foram determinadas a 30oC. Foram determinadas em pH 2 com base no teste prévio de pH. Para maiores detalhes sobre a metodologia empregada, sugerimos consultar SOUSA et al. (2019).
Resultado e discussão
CARACTERIZAÇÃO DOS ADSORVENTES
As amostras de adsorventes foram previamente em relação às suas propriedades
texturais: área superficial específica, volume de microporos, volume total
de poros e microporosidade. Ambas as amostras se caracterizaram como sendo
microporosas e apresentaram área superficial de 1674 e 1922 m2/g para o CAC
e CAS, respectivamente. Por sua vez, a microporosidade do CAC (54%) foi
maior que o do CAS (42%). Em relação a determinação do potencial de carga
zero, os valores foram de pHpcz=6,43 (CAC) e 7,17 (CAS). A caracterização
textural está descrita em SOUSA et al. (2019).
TESTE DE PH
A Tabela 1 apresenta as quantidades de AAS adsorvidas em relação aos pH’s
estudados. Pode-se dizer que o pH de solução influencia na capacidade de
adsorção. Além disso, tanto para a amostra comercial quanto para
sintetizada, o pH 2 permitiu uma maior capacidade de adsorção.
CINÉTICA E ISOTERMAS DE ADSORÇÃO
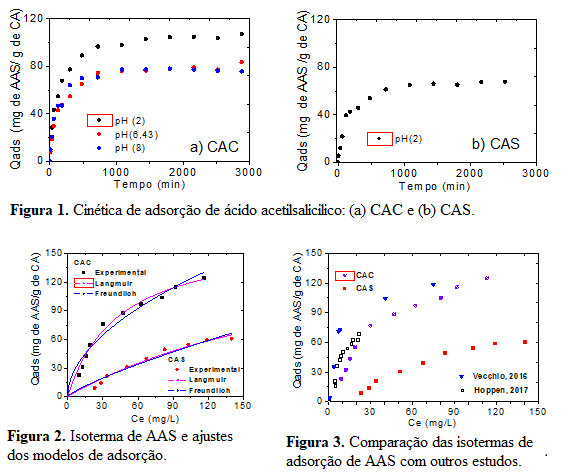
A Figura 1 mostra as cinéticas de adsorção do AAS a 30oC. Para o CAC, se
observa maior eficiência da adsorção do AAS em pH 2, conforme o teste
prévio. Os tempos de equilíbrio em pH 2 foram de 12h (720 min) para o CAC
(em pH 2) e de 18 h (1080 min) para o CAS.
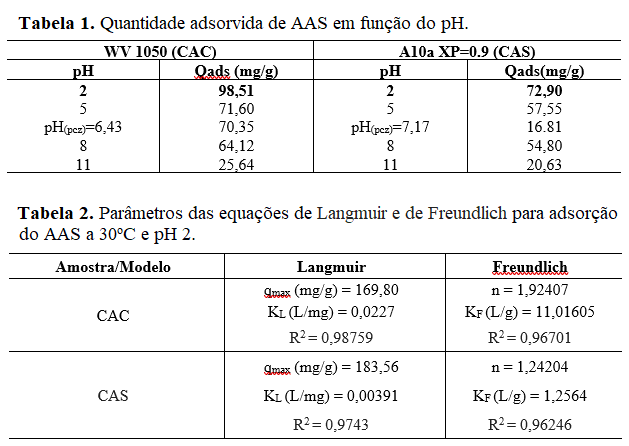
A isotermas de adsorção a 30º C e pH 2 são mostradas na Figura 2. A amostra
sintetizada adsorveu menos AAS em relação a comercial. A única análise que
temos para comparar as duas amostras é a caracterização textural que mostra
que ambas são microporosas. Neste sentido, a amostra comercial possui maior
fração de microporos, o que pode justificar maior capacidade de adsorção.
Conforme Beninati et al. (2008), as moléculas do AAS se acomodam melhor nos
microporos. Finalmente, a Figura 3 faz um comparativo das isotermas com
outros trabalhos que mostra que foram obtidas capacidades de adsorção
similares.
Conclusões
O presente trabalho fez um estudo da remoção do ácido acetilsalicílico a partir de uma solução aquosa usando carbonos ativados. Com os resultados obtidos foi possível concluir que o efeito do pH de solução foi significativo para adsorção do fármaco, na qual o pH 2 possibilitou uma maior capacidade de adsorção para ambas as amostras. Na investigação do equilíbrio de adsorção, a amostra comercial teve maior capacidade de remoção, provavelmente por ter uma maior fração de microporos. Para uma análise mais fundamentada, são necessários outros dados de caracterização.
Agradecimentos
Os autores agradecem ao Grupo de Pesquisa em Separações por Adsorção (GPSA) da Universidade Federal do Ceará (UFC) e a Universidad Nacional de San Luis-Ar por gentilmente conceder as amostras de carbono ativado e a água Milli-Q.
Referências
BENINATI, S.; SEMERARO, D.; MASTRAGOSTINO, M. Adsorption of paracetamol and acetylsalicylic acid onto commercial activated carbons. Adsorption Science &Technology, v. 26, n. 9, p. 721-734, 2008.
BURKINA, V.; ZLABEK, V.; ZAMARATSKAIA, G. Effects of pharmaceuticals present in aquatic environment on Phase I metabolism in fish. Environ Toxicol Pharmacol 40, p. 430–444, 2015.
DEBLONDE, T.; COSSU-LEGUILLE, C.; HARTEMANN, P. Emerging pollutants in wastewater: A review of the literature. International Journal of Hygiene and Environmental Health, v. 214, n. 6, p. 442–448, 2011.
FERREIRA, R. C.; LIMA, H. H. C.; COUTO JUNIOR, O. M.; ARROYO, P. A.; CARVALHO, K. Q.; BARROS, M. A. S. D. Utilização de carvão ativado de dendê in natura e funcionalizado em meio ácido na adsorção de paracetamol. Revista Matéria, vol. 63, N° 1, 2018.
HOPPEN, M. I. Adsorção e dessorção do ácido acetilsalicílico em carvão ativado de casca de coco de babaçu in natura e funcionalizado com HNO3. Dissertação (Mestrado em Ciência e Tecnologia Ambiental). Universidade Tecnológica Federal do Paraná, Curitiba, 2017.
RIVERA-UTRILLA, J.; SÁNCHEZ-POLO, M.; FERRO-GARCÍA, M.Á.; PRADOS-JOYA, G.; OCAMPO-PÉREZ, R. Pharmaceuticals as emerging contaminants and their removal from water. A review. Chemosphere, v. 93, n. 7, p. 1268-1287, 2013.
SOUSA, D. I. S.; BRITO, A. L. S.; PENHA, V. C. S.; SILVA, F. W. M. Adsorção de ácido acetilsalicílico em carbono ativado. TCC. Universidade Federal Rural do Semi-Árido, Mossoró-RN, 2019.









