Estudo da degradação do triclosan em meio aquoso: Efeito da oxigenação na peroxidação foto-assistida
ISBN 978-85-85905-25-5
Área
Ambiental
Autores
Oliveira, H.L. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Medeiros, J.B. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Silva, I.M. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Cunha, C.O. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Araújo, K.C. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Cézar, K.L. (UNIVERSIDADE FEDERAL DA PARAÍBA)
Resumo
Dentre os poluentes emergentes atuais, destaca-se o triclosan com várias aplicações, principalmente, nos mercados de higiene pessoal e cosméticos. A presença deste composto orgânico no meio ambiente pode acarretar em vários desequilíbrios, como bactérias super-resistentes. Este trabalho propôs uma forma de tratamento alternativo através do processo oxidativo avançado empregando o sistema UV/H2O2 para o tratamento de efluente sintético de triclosan, sob radiação UV-A, analisando fatores como oxigenação do meio reacional, pH, concentração de oxidante e tempo. Foram obtidos resultados satisfatórios, com uma taxa de degradação de triclosan de 66,9% em 90 minutos em condições ótimas (pH = 4,0 e [H2O2] = 5 mgL-1 com oxigenação).
Palavras chaves
triclosan; peróxido de hidrogênio; oxigênio
Introdução
Por muito tempo, foram avaliados processos de tratamento de água com foco em metais pesados, hidrocarbonetos poliaromáticos, pesticidas, entre outros. Com isso, os micropoluentes entraram em foco como uma preocupação global pela presença destes nos corpos hídricos. Destacam-se nesse grupo, os produtos de higiene pessoal, fármacos e pesticidas, denominados de poluentes emergentes, pois tratam-se de novos contaminantes que não possuem regulamentações específicas para suas concentrações no meio ambiente (TIBURTIUS e SCHEFFER, 2014). O 5-cloro-2-(2,4-diclorofenoxi)-fenol, ou mais conhecido como triclosan, possui uma produção de 350 toneladas a nível mundial, sendo usado como matéria-prima em produtos farmacêuticos de higiene pessoal e cosméticos. O triclosan é uma substância insolúvel em água, com exceção de soluções alcalinas, e solúvel em uma grande gama de solventes orgânicos. Possui atividade bactericida, impedindo a síntese dos ácidos graxos através da inibição da enzima enoil redutase (TIBURTIUS e SCHEFFER, 2014). O triclosan vem sendo encontrado em diversos ambientes, como águas superficiais, efluentes de estações de tratamento e existem casos onde foi detectado em alimentos. Uma das grandes preocupações com o triclosan no meio ambiente é a possibilidade do triclosan transformar-se em substâncias mais persistentes e com maiores níveis de toxicidade, como dioxinas e clorofenóis. Além disso, a presença do triclosan no ambiente pode ocasionar no surgimento de superbactérias, caso estas bactérias entrem no organismo humano, podem causar infecções que não podem ser curadas facilmente com os antibióticos disponíveis no mercado (MELO, 2010; TIBURTIUS e SCHEFFER, 2014). Uma alternativa de tratamento para esses poluentes emergentes são os processos oxidativos avançados. Os POAs incluem a fotocatálise heterogênea e homogênea com base na radiação ultravioleta (UV), visível e solar. Eles consistem na geração de radicais altamente reativos capazes de promover a oxidação de poluentes orgânicos. O sistema UV/H2O2 trata-se da combinação de radiação ultravioleta com um agente oxidante, sendo este o peróxido de hidrogênio. O processo consiste na formação de radicais hidroxila pela fotólise direta de H2O2. Vários fatores podem influenciar o processo UV/H2O2, entre eles podem-se destacar a concentração de oxidante, pH, intensidade da lâmpada, tempo, entre outros (SOARES, 2011). Nesse contexto, o trabalho teve como objetivo geral analisar e avaliar o processo UV/H2O2 utilizando radiação UV-A em diferentes condições de pH, concentração de oxidante, e o efeito da oxigenação e tempo nesse tratamento.
Material e métodos
Os reagentes utilizados foram de grau analítico. O trilosan do fabricante Anastácio adquirido na Codossal Química, ambos na cidade de Recife (PE). As amostras de triclosan foram preparadas diluindo-se 10 mg do fármaco em 1 mL de dimetilsulfóxido P.A. ACS (ALPHATEC), logo após transferiu-se para um balão volumétrico de um litro e completou-se com água destilada, obtendo-se uma concentração de 10 mgL-1 de triclosan. O peróxido de hidrogênio P.A. 29% w/v (SYNTH), empregado como agente oxidante nos testes fotocatalíticos. As acidificação e alcalinização das amostras foram realizadas com soluções de ácido clorídrico (0,1 molL-1) e hidróxido de sódio (0,1 molL-1), respectivamente. Para a oxigenação, utilizou-se uma bomba de ar da marca JAD, modelo SC-3500, com uma potência de 2,5 W e uma vazão máxima de 3,2 Lmin-1. A vazão foi distribuída em quatro mangueiras de borracha com comprimentos de aproximadamente 55,0 cm e diâmetros internos de 0,5 cm, onde cada saída possui 0,8 Lmin-1 de vazão de ar. O aparato experimental foi constituído de um reator instalado em uma caixa de MDF, com dimensões de 71 cm de comprimento, 19,5 cm de altura e 27 cm de largura, equipado com 3 lâmpadas UV-A (luz negra) com 20 W de potência cada uma, totalizando 60 W de radiação UV-A. A luz negra emite radiação na região do ultravioleta no comprimento de onda entre 320 a 400 nm. A caixa foi revestida em seu interior com papel alumínio a fim de concentrar a radiação. Os testes foram realizados com 250 mL da solução das amostras em tanques de 400 mL, acionando-se as lâmpadas 15 minutos antes do início da reação para a estabilização da radiação. Em períodos determinados, foram retiradas alíquotas de 4 mL, com o auxílio de pipetas graduadas, e levadas para análise em um espectrofotômetro UV-Visível Agilent modelo 8453, utilizando uma cubeta de quartzo com um comprimento do percurso óptico de 10 mm, a um comprimento de onda de 280 nm para o triclosan. O planejamento fatorial é fundamental para a determinação das variáveis que exercem maior influência, afim de se obter as melhores condições e rendimentos nos experimentos. Neste trabalho, seguiu-se um planejamento fatorial de 2n (n = 4), com quatro repetições no ponto central, totalizando vinte experimentos. As variáveis foram vazão de ar (com nível inferior e superior de 0 e 1,6 Lmin-1, respectivamente), a concentração de peróxido de hidrogênio (com nível inferior e superior de 5 e 15 mgL-1, respectivamente), o pH (com nível inferior e superior de 4,0 e 8,0, respectivamente) e o tempo (com nível inferior e superior de 60 e 90 minutos, respectivamente). A variável resposta foi a porcentagem de degradação do triclosan. O tratamento de dados foi realizado através da versão gratuita do software Statistica, v.7.0.
Resultado e discussão
Com objetivo de determinar as melhores condições da fotocatálise homogênea
do triclosan foi realizado um planejamento experimental 24. Os
resultados mostram que os maiores rendimentos de degradação do triclosan
foram de 66,9%, 69,4% e 62,3%. Com os resultados dos pontos centrais foi
possível determinar o erro puro do experimento de 0,0092. Os efeitos das
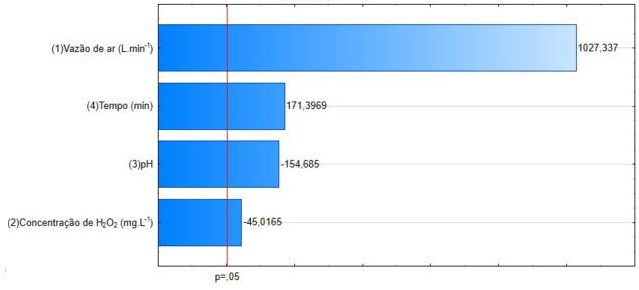
variáveis independentes estão mostrados no gráfico de pareto, Figura 1,
sendo as variáveis independentes: vazão de ar, concentração de
H2O2, pH e tempo. De acordo com o gráfico de pareto de
efeitos padronizados, as quatro variáveis apresentaram-se estatisticamente
significantes, com um nível de confiança de 95%. Na Figura 1, pode-se
observar que as variáveis independentes vazão de ar e tempo apresentam
efeito significativo positivo, e as variáveis pH e concentração de
H2O2 apresentaram efeito significativo negativo.
Apesar de o efeito significativo da concentração de
H2O2 ser para uma concentração de 5 mgL-1
(limite inferior), o experimento que apresentou maior degradação de
triclosan foi com as condições de 1,6 de Lmin-1 de vazão de ar,
pH 4,0, 90 min e concentração de H2O2 de 15
mgL-1 obtendo-se 69,4% de degradação do triclosan. Porém, o
experimento com 1,6 de Lmin-1 de vazão de ar, pH 4,0, 90 min e
concentração de H2O2 de 5 mgL-1 obteve
66,9% de degradação do triclosan. Outro resultado de degradação foi de 62,3%
nas condições de 1,6 de Lmin-1 de vazão de ar, pH 8,0, 90 min e
concentração de H2O2 de 5 mgL-1. Ao
observar esses resultados descritos e seguindo os efeitos significativos
apresentados na Figura 1, as melhores condições escolhidas para o processo
foram: 1,6 de Lmin-1 de vazão de ar, pH 4,0, 90 min e
concentração de H2O2 de 5 mgL-1. Além
disso, o processo torna-se menos dispendioso, uma vez que, será requerido
menores quantidades de peróxido. Os melhores resultados obtidos em pH ácido
corroboram com Soares (2011), onde obteve melhores rendimentos de degradação
em pH 4,0, porém sem apresentar muita discrepância em relação ao pH 9, para
a degradação do diclofenaco, carbamazepina e lidocaína através do processo
UV/H2O2.Ainda analisando os dados do gráfico de
pareto, nota-se que a variável vazão de ar foi a que mais apresentou
influência sobre o processo, sendo este efeito quase seis vezes maior que a
do tempo, segundo maior efeito significativo. A oxidação de amostras de
soluções contendo poluentes orgânico utilizando ar ou oxigênio, seja o
processo homogêneo ou heterogêneo, são bastantes pesquisados como um
processo alternativo, onde os produtos são CO2 e H2O.
O oxigênio é um dos oxidantes mais empregados por seu custo ser barato e ser
uma fonte limpa de oxidação, ou seja, ele não irá introduzir outros
poluentes no sistema. Estudos mostram que em vazões mais baixas de ar, a
transferência de oxigênio para a fase líquida possui maior eficiência em
relação às vazões maiores (TEXEIRA e JARDIM, 2004). De acordo com os
resultados e o gráfico de pareto, o que ocorre é que para vazão de ar de 1,6
Lmin-1 (limite superior) foi observada uma maior e mais rápida
degradação do triclosan quando comparadas à vazão de 0,8 Lmin-1
(ponto central), a ausência de vazão de ar no sistema obteve um rendimento
muito baixo, quase desprezível em alguns casos, com degradações de 3,9%,
0,16%, 4,4% e 4,3% do triclosan. Esse resultado também torna-se satisfatório
tendo em vista que sem a preseça de um catalisador, como nos processos
Fenton e fotoheterogênios, conseguiu-se degradar mais de 50% do triclosan do
meio reacional em um tempo de 90 minutos. Silva (2017) alcançou uma taxa de
degradação de aproximadamente 80% de triclosan em 120 minutos, utilizando
uma amostra com concentração de 10 mgL-1 de triclosan submetida à
irradiação por lâmpada UV-A com potência de 60 W e com 50 mg de
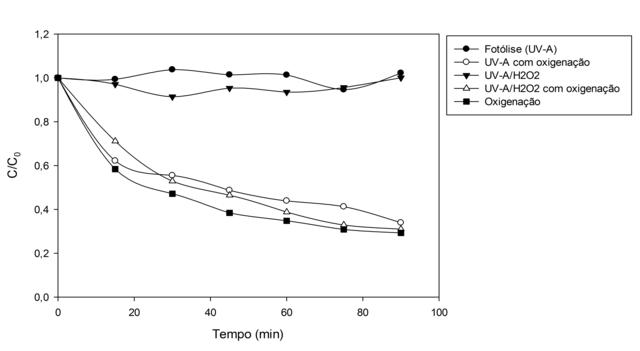
TiO2. Na Figura 2 estão representadas as cinéticas para os testes
de fotólise (UV-A), UV-A com oxigenação, UV-A/H2O2
(com a concentração de peróxido de 5 mgL-1), UV-
A/H2O2 (com a concentração de peróxido de 5
mgL-1) com oxigenação e apenas oxigenação sem a presença de luz.
Lembrando-se que a oxigenação se dá através da vazão de ar no sistema. De
acordo com a Figura 2, a fotólise não obteve nenhuma degradação
considerável, notasse alguns pequenos aumentos e quedas nas concentrações de
triclosan entre intervalos de tempo. Pode estar ocorrendo a formação de
produtos com o comprimento de onda próximo do triclosan (280 nm) e o
equipamento lê a formação desses produtos em concentrações de triclosan,
mesmo sem se tratar do triclosan pelo fato do espectrofotômetro não ser um
equipamento muito sensível, como os cromatógrafos por exemplo. Tratando de
forma análoga pelo fato do triclosan ser um composto fenólico sintético,
esses resultados são próximos do trabalho de Mota et al. (2005) sobre
a degradação do fenol, onde não houve quase nenhuma degradação do fenol nos
processos de UV/H2O2 com luz UV-A, explicando que uma
possível causa é por conta da radiação da luz negra (320 a 400 nm) não ser
adequada para este tipo de processo, uma vez que a decomposição do peróxido
de hidrogênio ocorre abaixo de 290 nm. Nos experimentos, foi verificado
através de fitas de testes rápidos de peróxido, que medem concentrações de
H2O2 entre 0 e 25 mgL-1, o peróxido de
hidrogênio residual, comprovou-se que as concentrações de peróxido de
hidrogênio após o tratamento permaneciam iguais as concentrações iniciais,
ou seja, não havia a quebra homolítica do peróxido de hidrogênio,
consequentemente, não havendo a formação do radical hidroxila. Dessa forma,
para que houvesse a decomposição do peróxido de hidrogênio necessitaria de
algum catalisador, como nos processos Fenton e heterogêneos. Ainda
analisando os resultados do gráfico da Figura 2, pode-se dizer que apenas a
oxigenação da solução de amostra sintética do triclosan já é suficiente para
a degradação do triclosan, tendo a maior taxa de degradação diante dos
outros testes. Todos os outros testes onde a oxigenação estava presente,
teve taxas de degradação consideráveis, porém, pode-se observar que não há a
necessidade da radiação e do agente oxidante peróxido de hidrogênio para
degradação do triclosan. Segundo Teixeira e Jardim (2004), muitos processos
oxidativos avançados utilizam o O2 como agente oxidante auxiliar.
Thompson et al. (2005) em seu trabalho sobre a remoção do triclosan
no tratamento de águas residuais, observou que em tratamentos de águas
residuais com o uso do iodo ativado que oferece a manutenção de altos níveis
de oxigênio dissolvido no sistema, a biodegradação foi vista como o
principal mecanismo de remoção do triclosan. Por outro lado, onde os níveis
de oxigênio dissolvido era baixos, o mecanismo de remoção do triclosan deu-
se por sorção. De acordo com Tiburtius et al. (2009), estima-se que a
presença de oxigênio nos processos oxidativos avançados leve a geração de
espécies ativas de oxigênio, como oxigênio singlete (1O2),
radical superóxido, ou até mesmo o radical hidroxila. Além disso, durante o
processo de oxidação, o oxigênio pode reagir com radicais que são formados
durante a degradação, produzindo superóxidos, que se decompõem
espontaneamente. Rafqah et al. (2006) constatou no estudo da
fototransformação do triclosan na presença do catalisador dióxido de
titânio, que o desaparecimento do triclosan nas soluções dependia fortemente
das concentrações de oxigênio, quando a irradiação foi realizada em solução
saturada de oxigênio a eficiência da degradação do triclosan aumentou.
Fonte: Elaborada pelo autor.
Fonte: Elaborada pelo autor.
Conclusões
De acordo com os resultados obtidos e discutidos no trabalho, pode-se concluir que para o triclosan foram obtidos valores satisfatórios de degradação para o processo fotocatalítico homogêneo. Entretanto, verificou-se que a eficiência da degradação do triclosan era originada da oxigenação através da inserção de uma vazão de ar no sistema. Podendo-se assim dispensar a necessidade de um agente oxidante como o peróxido de hidrogênio, ou até mesmo a radiação UV-A. Esse resultado é positivo, pois apenas com uma fonte de borbulhamento de ar em um reator, o triclosan pode ser degradado em mais de 50%, descartando a necessidade de algum catalisador com etapas de centrifugação e filtração como é no caso das fotocatálises heterogêneas e Fenton, e a necessidade de algum outro a gente oxidante, tornando o processo menos dispendioso.
Agradecimentos
À Universidade Federal da Paraíba, aos colegas do Laboratório de Estudos de Química Ambiental e à professora coordenadora do projeto por todo apoio e confiança.
Referências
MELO, C. F. Conversão do biocida triclosan catalisada por enzimas oxidativas e avaliação da remoção da atividade antibacteriana. Tese (Doutorado), Universidade Federal do Rio de Janeiro, Rio de Janeiro, 2010. MOTA, A. L. N.; MURANAKA, C. T.; MORAES, J. E. F.; NASCIMENTO, C. A. O.; FILHO, O. C. Aplicação do processo foto-fenton na fotodegradação do fenol em meio aquoso utilizando lâmpadas de luz negra como fonte de radiação. Anais. Lima: Federation de Ingenieros Quimicos del Perú, 2005. RAFQAH, S.; WONG-WAH-CHUNG, P.; NELIEU, S.; EINHORN, J.; SARAKHA, M. Phototransformation of triclosan in the presence of TiO2 in aqueous suspension: Mechanistic approach. Applied Catalysis B: Environmental, v. 66, 2006. SILVA, R. P. Estudo da fotodegradação em águas: Avaliação da degradação e toxicidade. Tese (Doutorado), Universidade Federal da Paraíba, João Pessoa, 2017. SOARES, T. Avaliação da eficiência de tratamentos com radiação UV e UV/H2O2 na degradação de micropoluentes orgânicos. Dissertação (mestrado profissional), Universidade Federal do Paraná, Curitiba, 2011. TEIXEIRA, C. P. de A. B.; JARDIM, W. de F. Processos Oxidativos Avançados – Conceitos teóricos. Caderno temático, Universidade Estadual de Campinas, São Paulo, 2004. TIBURTIUS, E. R. L.; SCHEFFER, E. W. O. Triclosan: Destino no Meio Ambiente e Perspectivas no Tratamento de Águas de Abastecimento Público. Revista Virtual de Química, v. 6, n. 6, 2014. TIBURTIUS, E. R. L.; ZAMORA, P. P. Degradação de benzeno, tolueno e xilenos em águas contaminadas por gasolina, utilizando-se processos foto-fenton. Quim. Nova, v. 32, n. 8, 2009. THOMPSON, A.; GRIFFIN, R.; STUETZ, R.; CARTMELL, E. The fate and removal of triclosan during wastewater treatment. Water Environ. Res., v. 77, n. 63, 2005.









