EFEITO INFLAMATÓRIO DA LECTINA DE SEMENTES DE Dioclea sclerocarpa EM CAMUNDONGOS
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Marques, G.F.O. (UFC) ; Borba, R.N.S. (UECE) ; Silva, J.N.R. (UECE) ; Oliveira, M.V. (UFC) ; Lóssio, C.F. (UFC) ; Nascimento, K.S. (UFC) ; Assreuy, A.M.S. (UECE)
Resumo
A inflamação é uma resposta de defesa do sistema imune, que elimina patógenos e atua no reparo tecidual. Neste processo, os mediadores inflamatórios possuem papel central em vias complexas que levam a indução, aumento e regulação de células inflamatórias. Assim, o estudo de produtos naturais que possam interferir neste processo é de extrema relevância. Diante dos dados obtidos pelo nosso grupo e da literatura vigente, lectinas de leguminosas têm sido apontadas como moduladores potenciais desses processos, por sua capacidade de se ligar reversivelmente à carboidratos. O objetivo deste trabalho foi avaliar os mediadores inflamatórios envolvidos no efeito da lectina isolada de planta Dioclea sclerocarpa (DSL), utilizando modelos clássicos de inflamação aguda.
Palavras chaves
Lectinas vegetais; Diocleinae; inflamação aguda
Introdução
O estudo experimental com lectinas, proteínas que possuem a propriedade de ligação reversível e específica a carboidratos (LIS; SHARON, 1998), vem contribuindo para o entendimento de vários processos biológicos que envolvem o reconhecimento proteína-carboidrato. Dentre estes processos está a adesão de leucócitos ao endotélio vascular, que constitui importante etapa do processo inflamatório. Desta forma, o papel modulador de lectinas de leguminosas no processo inflamatório agudo tem sido descrito, sugerindo sua utilização como ferramentas importantes para a compreensão deste processo. Estudos envolvendo lectinas isoladas de sementes de plantas da família Leguminosae, especialmente as pertencentes à subtribo Diocleinae, têm sido amplamente descritos em modelos de inflamação aguda em roedores. A inflamação é uma resposta dos tecidos vascularizados a estímulos agressivos para eliminar microrganismos ou outros agentes irritantes, podendo haver uma prevenção ou uma progressão da mesma. A inflamação aguda inicia-se quase que imediatamente à injúria, tem uma duração relativamente curta e se manifesta por alterações vasculares, permitindo que proteínas plasmáticas e leucócitos deixem a circulação. A inflamação crônica tem uma duração mais prolongada e histologicamente está associada a presença de linfócitos, macrófagos e proliferação dos vasos sanguíneos (KUMAR et al., p. 43, 2010). O aumento da permeabilidade vascular e a vasodilatação ocorre devido a ação de vários mediadores, em especial o óxido nítrico, a bradicinina, a serotonina e a histamina (BHANDARI et al., 2005). Isto possibilita a lentificação do fluxo sanguíneo e a aproximação dos leucócitos ao endotélio para interagir com componentes da matriz extracelular e desencadear os eventos celulares (McEVER, 1991). Os neutrófilos são o tipo celular mais importante nas fases iniciais do processo inflamatório, fagocitando e eliminando microorganismos pela ação de espécies reativas do oxigênio e nitrogênio, e por enzimas proteolíticas (SPRINGER, 1995). O principal evento celular que ocorre na inflamação é a migração dos leucócitos para o espaço extracelular. A ativação das células endoteliais, por sinais teciduais e mediadores inflamatórios, induzem a expressão de moléculas de adesão (selectinas L, E e P) tanto nos leucócitos quanto nas células endoteliais, facilitando o rolamento das células pelo endotélio (WAGNER; ROTH, 2000). A etapa seguinte ao rolamento, a adesão, é mediada pelas integrinas, que possuem ligantes induzidos pelo TNF-α e a IL-1β como a molécula-1 de adesão de célula vascular (VCAM-1, ligante da integrina VLA-4) e a molécula-1 de adesão intercelular (ICAM-1, ligante das integrinas LFA-1 e Mac-1) (PANÉS et al., 1999). Estas ligações tornam-se fortes pela ação das quimiocinas, permitindo a adesão destas células ao endotélio (COOK-MILLS; DEEM, 2005). A transmigração dos leucócitos firmemente aderidos ao endotélio ocorre via junções endoteliais (CINES et al., 1998), sendo facilitada pela interação das integrinas com a fibrina e a fibronectina (SNYDERMAN; DIDSBURY, 1991). A partir de então, os leucócitos seguem para o foco inflamatório por quimiotaxia. Os eventos inflamatórios, em qualquer fase do processo, são mediados por substâncias provenientes do plasma sanguíneo ou de células que se encontram no foco inflamatório, sejam elas residentes ou não. Essas substâncias são chamadas de mediadores inflamatórios que, quando estimuladas, podem modular o processo inflamatório positiva ou negativamente (KUMAR et al., 2010). As lectinas de leguminosas apresentam ação anti- ou pró-inflamatórias, envolvendo o sítio de reconhecimento a carboidratos (domínio lectínico). Por via endovenosa as ações manifestadas são anti-inflamatórias (ASSREUY et al., 1997; ALENCAR et al., 1999; ALENCAR et al., 2005; NAPIMOGA et al., 2007; NASCIMENTO et al., 2009; ROCHA et al., 2011; BEZERRA et al., 2014), enquanto por via local, as ações manifestadas são pró- inflamatórias (ASSREUY et al., 2009; DELATORRE et al., 2011; RANGEL et al., 2012; SIMÕES et al., 2012; ALENCAR et al., 2013; SANTIAGO et al., 2014; PINTO-JUNIOR et al., 2017a; PINTO-JUNIOR et al., 2017b; OSTERNE et al., 2017). A lectina isolada da planta Dioclea sclerocarpa (DSL), objeto deste estudo, demonstrou efeito vasodilatador in vitro em aortas isoladas de ratos, envolvendo o sítio de reconhecimento a carboidratos e óxido nítrico (BARROSO-NETO et al., 2016). Entretanto, não há registros na literatura sobre tal efeito em modelos experimentais in vivo. Diante do exposto, o objetivo deste trabalho foi investigar a atividade pró-inflamatória da DSL em modelos agudos de inflamação em ratos.
Material e métodos
Animais: foram utilizados camundongos Swiss (20-30 g) mantidos em condições ambientais controladas (23 ± 2 °C; ciclo claro/escuro de 12 h), com acesso livre a água e ração. Os protocolos experimentais foram aprovados pelo comitê de Ética Institucional (CEUA/UECE n° 2732620/2017). Lectina: o isolamento da lectina de Dioclea sclerocarpa (DSL) foi realizado por cromatografia de troca iônica (em coluna de DEAE-Sephacel) seguida de cromatografia de afinidade (coluna de manose-sepharose) no Laboratório de Moléculas Biologicamente Ativas (BioMoLab), Departamento de Bioquímica e Biologia Molecular da Universidade Federal do Ceará (UFC), sob a coordenação do Professor Dr. Benildo Sousa Cavada. Modelo de Edema de Pata: na avaliação do edema de pata, os volumes de líquido deslocados pelas patas traseiras de cada animal foram medidos por hidropletismometria antes (tempo zero) e após a indução do edema pela DSL (3, 30 e 300 μg/pata) através de injeção subcutânea (s.c.) intraplantar. O edema foi calculado como a diferença entre a medida dos volumes (mL) de líquido obtidos em cada tempo após o estímulo em relação ao volume basal (tempo zero). A área sob a curva-ASC (unidades arbitrárias) foi calculada utilizando-se o método do Trapézio (LANDUCCI et al., 1995). O grupo controle recebeu salina (s.c) na pata contralateral. 1) Modulação Farmacológica: neste modelo também foi investigada a participação de mediadores inflamatórios por bloqueio farmacológico. Para isso, os animais foram pré-tratados 30 minutos antes da indução do edema de pata pela DSL (300 mg/pata) com os seguintes bloqueadores farmacológicos: L-NAME (25 mg/Kg; e.v.), inibidor da enzima óxido nítrico sintase, indometacina (5 mg/Kg; s.c.), inibidor inespecífico da enzima ciclooxigenase, infliximab (45 mg/Kg; i.p.), inibidor da citocina TNF-α (10 mg/kg). 2) Atividade da Mieloperoxidase (MPO: Os tecidos das patas foram removidos 4 h após a administração da DSL (300 μg/pata), homogenizados com o tampão HTAB e adicionado à solução de o-dianosidina, contendo 1% de peróxido de hidrogênio (H2O2). Em seguida, as amostras foram mensuradas a A450 nm. Os dados foram expressos como pmol/mg de tecido (BRADLEY et al., 1982).
Resultado e discussão
DSL induziu edema de pata nas doses de 30 μg (117,5 ± 12,3 ASC) e de 300 μg (306,5 ± 21,2 ASC), comparados ao controle de salina (55,0 ± 9,8 ASC). Nossos resultados demonstraram que a DSL induziu a formação de edema de pata de curta duração (aguda) nas 3 doses testadas, uma manifestação típica das lectinas de Diocleinae. A literatura relata, em trabalhos anteriores do nosso grupo, que lectinas desta subtribo podem produzir efeitos inflamatórios quando administradas por via local, assim como a lectina de Canavalia brasiliensis e Dioclea grandiflora (ASSREUY et al., 1997), Dioclea wilsonii (RANGEL et al., 2012), Dioclea virgata (DELATORRE et al., 2011), Dioclea reflexa (PINTO-JUNIOR et al., 2016) e Dioclea lasiophylla (PINTO-JUNIOR et al., 2017). Além disso, um trabalho anterior mostrou que a lectina de DSL apresentou efeito vasodilatador in vitro (BARROSO-NETO et al., 2016). O edema é um dos sinais clínicos mais evidentes da inflamação e está associado à vasodilatação e ao extravasamento de proteínas, proporcionado por substâncias voasoativas como o óxido nítrico (SALVEMINI et al., 1993) e as prostaglandinas (ALLER et al., 2007). O edema induzido pela DSL (300 μg/pata) foi inibido em 56% por indometacina, em 47% por L-NAME e em 24% por infliximabe. O efeito edematogênico produzido pela DSL foi inibido pela indometacina (inibidor da enzima COX), pelo L-NAME (inibidor não-seletivo da enzima óxido nítrico sintase) e pelo infliximab (inibidor do TNF-α), sugerindo que este efeito ocorra com a participação de prostaglandinas, óxido nítrico e TNF-α. A lectina de Dioclea rostrata, pertecente à mesma subtribo da DSL, estimulou a produção destes mediadores inflamatórios em macrófagos (FIGUEIREDO et al., 2009). DSL (300 μg) aumentou os níveis da enzima mieloperoxidase nos tecidos das patas dos animais em 634 vezes, comparado ao controle de salina (452533 ± 132546 vs. salina: 713 ± 3,9 pmol/mg). A MPO, presente em leucócitos granulocíticos e monocíticos, têm como função principal a produção de espécies reativas de oxigênio (EROS), que auxilia na fagocitose e morte de patógenos (VAN DER VEEN; WINTHER; HEERINGA, 2009). A lectina isolada de Dioclea violacea (DvL), também da subtribo Diocleinae, quando administrada na pata de ratos produziu edema de pata caracterizado por infiltrado neutrofílico e aumento da atividade de mieloperoxidase (ALENCAR et al. 2013). Em nossos resultados, o aumento da atividade da MPO juntamente com a prevenção do efeito edematogênico da DSL pelo bloqueio da via da óxido nítrico sintase sugerem que o efeito inflamatório seja devido ao aumento dos níveis de marcadores de estresse oxidativo, tais como NO e MPO.
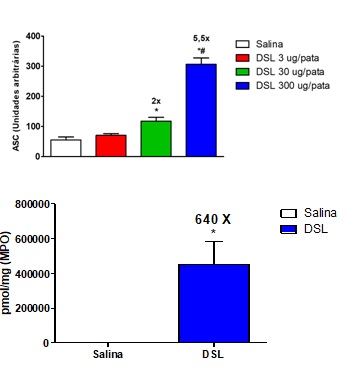
DSL (3, 30 e 300 ug/pata) ou salina foram administradas e o edema avaliado por hidropletismometria. Após 4 h, a atividade da MPO foi mensurada.
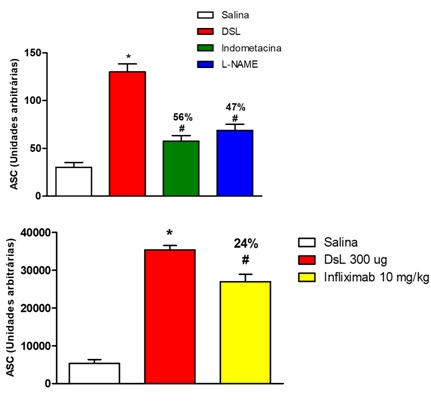
30 minutos antes da indução do edema de pata pela DSL, os animais foram tratados com L-NAME, indometacina e infliximab.
Conclusões
A lectina de Dioclea sclerocarpa (DSL) apresenta efeito edematogênico, mediado por prostaglandinas, óxido nítrico e TNF-α.
Agradecimentos
CNPq (Conselho Nacional de Desnvolvimento Científico e Tecnológico) e FUNCAP (Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico).
Referências
ALENCAR, N. M. N., TEIXEIRA, E. H., ASSREUY, A. M. S., CAVADA, B. S.,
FLORES, C. A., RIBEIRO, R. A. Leguminous lectins as tools for studying the role of sugar residues in leukocyte recruitment. Mediators Inflamm.,v. 8, p. 107-
113, 1999.
ALENCAR, N. M. N., CAVALCANTE, C. F.; VASCONCELOS, M. P.; LEITE, K.
B.; ARAGÃO, K. S.; ASSREUY, A. M.; NOGUEIRA, N. A.; CAVADA, B. S.;
VALE, M. R. Anti-inflammatory anda ntimicrobial effect of lectin from
Lonchocarpus sericeus in experimental rat model of infectious peritonitis. J
Pharm Pharmacol., v. 57, nº 7, 919-922, 2005.
ALENCAR, N. M.; MOTA, M. R.; RODRIGUES, N. V.; MARTINS, J. L.; DO
NASCIMENTO, K. S.; ASSREUY, A. M.; CAVADA, B. S. Neutrophil-infiltrated
paw edema induced by mannose-binding Dioclea violacea lectin. Pharmacol
Rep., v. 65, nº 1, 220-225, 2013.
ALLER, M. A.; ARIAS, J. L.; CRUZ. A.; ARIAS, J. Inflammation: a way to understanding the evolution of portal hypertension. Theor Biol Med Model., v. 4, nº 1, 1-25, 2007.
ASSREUY, A. M. S., SHIBUYA, M. D.; MARTINS, G. J.; DE SOUZA, M. L.;
CAVADA, B. S.; MOREIRA, R. A.; OLIVEIRA, J. T.; RIBEIRO, R. A.; FLORES,
C. A. Antiinflammatory effect of glucose-mannose binding lectins isolated from
Brazilian beens. Mediat Inflamm., v. 6, nº 3, 201-210, 1997.
ASSREUY, A. M. S.; FONTENELE, S. R.; PIRES, A. F.; FERNANDES, D. C.;
RODRIGUES, N. V.; BEZERRA, E. H.; MOURA,T. R.; NASCIMENTO, K. S.;
CAVADA, B. S. Vasodilator effects of Diocleinae lectins from the Canavalia
genus. Naunyn Schmiedebergs Arch Pharmacol., v. 380, nº 6, 509-521, 2009.
BARROSO-NETO, I. L; DELATORRE, P; TEIXEIRA, C. S; CORREIA, J. L. A.,
CAJAZEIRAS, J. B.; PEREIRA, R. I.; NASCIMENTO, K. S.; LARANJEIRA, E.
P.; PIRES, A. F.; ASSREUY, A. M.; ROCHA, B. A.; CAVADA, B. S. Structural
Analysis of a Dioclea sclerocarpa lectin: Study on the vasorelaxant properties
of Dioclea lectins. Int J Biol Macromol., v. 82, 464-470, 2016.
BRADLEY, W. A.; GILLIAM, E. B.; GOTTO, A. M. Jr.; GIANTURCO. S.H. Apolipoprotein-E degradation in human very low density lipoproteins by plasma protease(s): chemical and biological consequences. Biochem Biophys Res Commun., v. 109, nº 4, 1360-1367, 1982.
BEZERRA, G. A.; VIERTLMAYR, R., MOURA, T. R.; DELATORRE, P.;
ROCHA, B. A.; DO NASCIMENTO, K. S.; FIGUEIREDO, J. G.; BEZERRA, I.
G.; TEIXEIRA, C. S.; SIMÕES, R. C.; NAGANO, C. S.; DE ALENCAR, N. M.;
GRUBER, K.; CAVADA, B. S. Structural studies of an anti-inflammatory lectin
from Canavalia boliviana seeds in complex with dimannosides. PLoSOne., v.
9, nº 5, e97015, 2014.
BHANDARI, P.; BATEMAN, A. C.; MEHTA, R. L.; PATEL, P. Mucosal expression of cyclooxygenase isoforms 1 and 2 is increased with worsening damage to the gastric mucosa. Histopathology, v. 46, nº 3, 280-286, 2005.
CINES, D. B.; POLLAK, E. S.; BUCK, C. A.; LOSCALZO, J.; ZIMMERMAN, G.
A., et al. Endothelial cells in physiology and in the pathophysiology of vascular
disorders. Blood., v. 91, nº 10, 3527-3561, 1998.
COOK-MILLS, J. M.; DEEM, T. L. Active participation of endothelial cells in
inflammation. J. Leukoc. Biol., v. 77, 487-495, 2005.
DELATORRE, P.; ROCHA, B. A.;SIMÕES, R. C.;PEREIRA-JÚNIOR, F. N.;
SILVA, H.C., BEZERRA, E. H.; BEZERRA, M. J.; MARINHO, E. S.; GADELHA, C. A.; SANTI-GADELHA, T.; FARIAS, D. L.; ASSREUY, A. M.; MARQUES-DOMINGOS, G. F.; NAGANO, C. S.; CAVADA, B. S. Mass spectrometry and X-ray diffraction analysis of two Crystal types of Dioclea virgata lectin: an antinociceptive protein candidate to structure/function analysis. Appl Biochem Biotechnol., v.164, nº 6, 741-754, 2011.
FIGUEIREDO, P. R.; MARTINS, M. R.; MONTENEGRO, R. M.; ALBANO, M. F.; MONTENEGRO, R. M. JR. Influence of serum IGF-I and testosterone on lipid and glycemic profile in acromegalic men. Arq Bras Endocrinol Metabol., v. 53, nº 8, 1026-1032, 2009.
KUMAR, V.; ABBAS, A. K.; FAUSTO, N. Patologia: Bases patológicas das
doenças. 8a ed. Rio de Janeiro: Elsevier, 43-78, 2010.
LANDUCCI, E. C.; ANTUNES, E.; DONATO, J. L.; FARO, R.; HYSLOP, S.; MARANGONI, S.; OLIVEIRA, B.; CIRINO, G.; DE NUCCI, G. Inhibition of carrageenin-induced rat paw oedema by crotapotin, a polypeptide complexed with phospholipase A2. Br J Pharmacol., v.114, nº 3, 578-583, 1995.
LIS H, SHARON N. Lectins: Carbohydrate-Specific Proteins That Mediate
Cellular Recognition. Chem Rev., v. 98, nº 2, 637-674, 1998.
McEVER, R. P. Leukocyte interactions mediated by selectins. Thromb. Haemost. v. 66, 80-87, 1991.
NAPIMOGA, M. H.; CAVADA, B. S.; ALENCAR, N. M.; MOTA, M. L.;
BITTENCOURT, F. S.; ALVES-FILHO, J. C.; GRESPAN, R.; GONÇALVES, R.
B.; CLEMENTE-NAPIMOGA, J. T.; DE FREITAS, A., PARADA, C. A.;
FERREIRA, S. H.; CUNHA, F. Q. Lonchocarpus sericeus lectin decreases
Leukocyte migration and mechanical hypernociception by inhibiting cytokine and chemokines production. Int Immunopharmacol., v. 7, nº 6, 824-835, 2007.
NASCIMENTO, K. S.; GRANGEIRO, T. B.; CAVADA, B. S.; SAMPAIO, A. H.
NUNES, B.S. Lectin extracted from Canavalia grandiflora seeds presentes
potential anti-inflammatory and analgesic effects. Naunyn Schmiedebergs
Arch Pharmacol., v. 379, nº 6, 609-616, 2009.
OSTERNE, V. J.; SILVA-FILHO, J. C.; SANTIAGO, M. Q.; PINTO-JUNIOR, V.
R.; ALMEIDA, A. C., BARRETO, A. A. G. C.; WOLIN, I. A. V.; NASCIMENTO, A. P. M.; AMORIM, R. M. F.; ROCHA, B. A. M.; DELATORRE, P.; NAGANO, C. S.; LEAL, R. B.; ASSREUY, A. M. S.; NASCIMENTO, K. S.; CAVADA, B. S. Structural characterization of a lectin from Canavalia virosa seeds with inflammatory and cytotoxic activities. Int. J. Biol. Macromol., v. 94, p. 271-282, 2017.
PANÉS, J.; PERRY, M.; GRANGER, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br J Pharmacol., v. 126, 537-550, 1999.
PINTO-JUNIOR, V. R.; CORREIA, J. L.; PEREIRA, R. I.; PEREIRA-JUNIOR, F.
N.; SANTIAGO, M. Q., et al. Purification and molecular characterization of a
novel mannose-specific lectin from Dioclea reflexa Hook. seeds with
inflammatory activity. J. Mol. Recognit., v. 29, 134-141, 2017a.
PINTO-JUNIOR, V. R.; OSTERNE, V. J. S.; SANTIAGO, M. Q.; LOSSIO, C. F.; NAGANO, C. S.; ROCHA, C. R. C.; NASCIMENTO, J. C. F.; NASCIMENTO, F. L. F.; SILVA, I. B.; OLIVEIRA, A. S.; CORREIA, J. L. A.; LEAL, R. B.; ASSREUY, A. M. S.; CAVADA, B. S.; NASCIMENTO, K. S. Molecular modeling, docking and dynamics simulations of the Dioclea lasiophylla Mart. ex Benth seed lectin: an edematogenic and hypernociceptive protein. Biochimie, v. 35, 126-136, 2017b.
ROCHA, B. A.; DELATORRE, P.; OLIVEIRA, T. M.; BENEVIDES, R. G.;
PIRES, A. F.; SOUSA, A. A.; ASSREUY, A. M.; DEBRAY, H.; AZEVEDO, W. F.
JR.; SAMPAIO, A. H.; CAVADA, B. S. Structural basis for both pro- and anti-
inflammatory response induced by mannose-specific legume lectin from
Cymbosema roseum. Biochimie, v. 93, nº 5, 806-816, 2011.
SANTIAGO, M. Q.; LEITÃO, C. C.; PEREIRA, F. N.; PINTO-JUNIOR, V. R.;
OSTERNE, V. J.;LOSSIO, C. F.; CAJAZEIRAS, J. B.; SILVA, H. C.; ARRUDA,
F. V.; PEREIRA, L. P.; ASSREUY, A. M.; NASCIMENTO, K. S.; NAGANO, C.
S.; CAVADA, B. S. Purification, characterization and partial sequence of a pro-
Inflammatory lectin from seeds of Canavalia oxyphylla Standl. & amp; L. O. Williams. J Mol Recognit., v. 27, nº 3, 117-123, 2014.
SNYDERMAN, R.; DIDSBURY, J. Molecular mechanisms of leukocyte
activation by chemoattractants. Agents Actions Suppl., v. 35, 3-8, 1991.
SPRINGER, T. A. Traffic signals on endothelium for lymphocyte recirculation
And leukocyteemigration. Annu. Rev. Physiol. v.57, 827-872, 1995.
RANGEL, T. B.; ROCHA, B. A.;BEZERRA, G. A.; ASSREUY, A. M.; PIRES, A.
F.; DO NASCIMENTO, A. S.; BEZERRA, M. J., DO NASCIMENTO, K.
S.;NAGANO, C. S.; SAMPAIO, A. H.; GRUBER, K.; DELATORRE, P.;
FERNANDES, P. M.; CAVADA, B. S. Crystal structure of a pro-inflammatory
lectin from the seeds of Dioclea wilsonii Standl. Biochimie, v. 94, nº 2, 525-
532, 2012.
SALVEMINI, D.; PISTELLI, A.; ANGGARD, E. Vascular and anti-platelet actions of 1,2- and 1,3-glyceryl dinitrate. Br J Pharmacol., v. 110, nº 3, 937-942, 1993.
SIMÕES, R. C.; ROCHA, B. A.; BEZERRA, M. J.; BARROSO-NETO, I. L.;
PEREIRA-JUNIOR, F. N.; DA MOURA, R.; DO NASCIMENTO, K. S.; NAGANO, C. S.; DELATORRE, P.; PIRES, A. F.; ASSREUY, A. M.; SAMPAIO, A. H.; CAVADA, B. S. Protein crystal content analysis by mass spectrometry and preliminary X-ray diffraction of a lectin from Canavalia grandiflora seeds with modulatory role in inflammation. Rapid Commun Mass Spectrom., v. 26, nº 7, 811-818, 2012.
WAGNER, J. G., ROTH, R. A. Neutrophil migration mechanisms, with an
emphasis on the pulmonary vasculature. Pharmacol Rev., v. 52, 349-374,
2000.









