Prospecção Fitoquímica, Quantificação de Fenóis e Flavonóides Totais e Avaliação das Ações Antioxidantes e Anticolinesterase do Extrato Etanólico da Casca da Paineira – [i]Ceiba pentandra[/i] (L.) Gaerth
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Lopes, F.F.S. (UECE) ; Silva, M.V.F. (UECE) ; Fernandes, V.B. (UECE) ; Guerra, D.L. (UECE) ; Morais, S.M. (UECE)
Resumo
A espécie Ceiba pentandra, apresenta várias propriedades curativas na medicina popular. O objetivo deste trabalho foi caracterizar as classes de compostos do metabolismo secundário, quantificar os Fenóis e Flavonóides Totais, avaliar a atividade antioxidante e a ação anticolinesterase do extrato etanólico das cascas da Paineira. O teor de Fenóis foi de 352,58 ± 9,22 mg EAG/g de extrato e o de Flavonoides de 8,12 ± 0,49 mg EQ/g de extrato. A atividade antioxidante apresentou uma inibição do radical DPPH com valor de 4,19±0,16 μg/mL. A ação anticolinesterase foi de 15,87 ± 0,02 μg/mL. Pode-se inferir que os compostos presentes no extrato, demostraram uma boa atividade antioxidante e que o extrato possui uma boa ação anticolinestarasica.
Palavras chaves
Paineira; Antioxidantes; Antiacetilcolinesterase
Introdução
O uso de plantas medicinais como medicamento é tão antigo quanto a própria humanidade, considerado uma prática milenar, alguns autores defendem que o hábito de recorrer a flora para combater afecções já vinha sendo desenvolvida desde a idade das cavernas (FERNANDES, 2004; OLIVEIRA, 2011). Há relatos do uso da flora para a cura sendo aplicadas nas mais diferentes culturas em todas as camadas sociais por todo planeta, em diferentes épocas da história da humanidade. Por definição plantas medicinais são espécies vegetais, cultivadas ou não, utilizadas com propósitos terapêuticos (MONTEIRO; BRANDELLI, 2017). Para Matos (2002) elas podem ser usadas, conforme o caso, em preparações diversas para serem ingeridas, ditas de uso interno (chás infusos, cozimentos, maceração, etc.) e em preparações outras para uso na pele ou nas mucosas das atividades naturais, ditas de uso externo. A Ceiba pentandra (L.) Gaerth é uma árvore pertence ao gênero Malvaceae e originária da América Central. No Brasil seu domínio fitogeográfico predomina-se na região norte (MUÑOZ-CAZARES et al., 2018). Conhecida popularmente no Brasil por Paineira, Sumaúma, Barriguda ou Árvore-da-seda, a C. pentandra é uma árvore de grande porte, podendo atingir até 50 m de altura e 2m de diâmetro, apresenta amplas sapopemas basais, com 80 a 160 cm de diâmetro, sua casca possui cor verde-acinzentada revestida de acúleos, as folhas são compostas, digitadas, alternas, longo-pecioladas, com 5 a 7 folíolos dígito-palmados, inflorescências em panículas terminais, com flores esbranquiçadas, o fruto é uma cápsula de aproximadamente 7 cm de diâmetro por 8 a 16 cm de comprimento, com 120 a 175 sementes envolvidas por paina, arredondadas, de cerca de 6 mm de diâmetro (SOUZA et al., 2005). As diferentes partes da Paineira têm sido utilizadas na medicina tradicional, contra bronquites, asma, tosse, doença de pele, diarreia, disenteria, gonorreia, doenças oculares, artrite, febre, infecções parasitárias, picada de insetos e no tratamento de diabéticos (LOGANAYAKI; SIDDHURAJU; MANIAN, 2013). Estudos demostraram que o extrato da casca contém propriedades anti-inflamatórias tanto in vitro como in vivo e que dado oralmente para ratos diabéticos por um período de 4 semanas, produziu a diminuição do nível da glicose do sangue (LOGANAYAKI; SIDDHURAJU; MANIAN, 2013). Os compostos fenólicos são as substâncias fitoquímicas mais abundantes nas plantas, eles são considerados os principais responsáveis pela ação antioxidante de várias substâncias de origem vegetal, também apresentam atividades biológicas como anti-inflamatória, antimicrobiana, antivirais, antialérgica e cardioprotetora entre outros benefícios (LIMA, 2013; WERMUNT, 2015). Entre os principais compostos fenólicos existentes destaca-se os flavonólicos que são considerados ótimos antioxidantes naturais (MORAIS; VIEIRA, 2018). A enzima acetilcolinesterase (AChE) é um neurotransmissor que está presente em quase todos animais, pertencente à família das esterases essa enzima é considera uma das mais importantes do sistema de transmissão de impulsos nervosos (MARQUES; CAIXETA, 2016; AZEVEDO, 2013). Segundo Petronilho e Figueroa-Villar (2014), os impulsos nervosos precisam ser transferidos continuamente de um neurônio para outro, esse processo é realizado por mediadores químicos, como serotonina, dopamina, glutamato, noradrenalina e a acetilcolina (ACh). Atualmente há vários fármacos que miram as sinapses colinérgicas, eles objetivam a ação direta na enzima AChE, podendo reativá-la ou inibi-la. Como também agir nos receptores como antagonista e agonistas (ARAUJO; SANTOS; GONSALVES, 2016). Caso o inibidor da AChE (IAChE) apresente ação no Sistema Nervoso Central (SNC), como por exemplo a Rivastigmina, este tem muita utilidade no tratamento da demência associada às doenças de Parkinson e Alzheimer (ARAUJO; SANTOS; GONSALVES, 2016). Nesse contexto, o objetivo deste trabalho foi a prospecção dos metabólitos secundários presentes no Extrato Etanólico da Casca da Paineira (EECP), assim como determinar o teor de fenóis e flavonoides Totais correlacionando com sua atividade antioxidante e ação anticolinesterásica in vitro, na tentativa de justificar as propriedades medicinais atribuídas a espécie.
Material e métodos
A casca da Paineira foi coletada no Parque Estadual do Cocó situado na cidade de Fortaleza, no mês de Outubro de 2018. Utilizou-se 50 gramas de casca de Paineira. O Extrato Etanólico da Casca da Paineira (EECP) foi obtido através da maceração por 10 dias, em que o líquido extrator foi 300 mL de etanol 96º GL. Após esse período colocou-se o extrato em rota evaporador para retirar o excesso de etanol, logo em seguida no banho-maria até evaporação total do solvente. Após esse processo inicial, foram realizados os testes fitoquímicos qualitativos para averiguar as classes de metabólitos secundários presentes, seguindo a metodologia descrita por Matos (2009). Pesou-se 20 mg do EEPC e dissolveu-se em 20 mL de etanol para ser utilizado em 8 tubos de ensaio para 4 testes, onde um tubo de ensaio com a solução serviu como comparação. Outros 4 tubos foram utilizados para os testes restantes com o extrato seco. A determinação do teor de fenóis totais foi realizado baseado no método colorimétrico do Folin-Ciocalteu por meio de espectroscopia na região do UV- Vis descrito por Sousa et al. (2007). A determinação do teor de flavonoides totais foi realizado pelo método colorimétrico do cloreto de alumínio (AlCl3) por meio de espectroscopia na região do UV-Vis descrito por Funari e Ferro (2006). No teste de atividade antioxidante (método DPPH), utilizou-se a metodologia proposta por Yepez et al. (2002) com adaptações. Para a preparação da solução mãe (10.000 ppm), 15 mg do EECP foi solubilizado em 1,5 ml de metanol. Em seguida, foram realizadas diluições em série. Foram feitas diluições para 5.000, 1.000, 500, 100, 50, 10 e 5 ppm. Em tubos de ensaio, 1.9 mL da solução de DPPH e 0,1 mL da amostra foram misturados, em triplicata. Após 30 minutos no escuro, realizou-se a leitura no espectrofotômetro UV-VIS, no comprimento de onda de 515 nm. A concentração Inibitória para 50% do radical livre foi calculada a partir da equação da reta obtida através dos valores do índice de varredura. O valor da CI50 foi comparado ao padrão de Quercetina. A ação da atividade enzimática da acetilcolinesterase (AChE) foi determinada em microplacas de 96 poços de fundo chato pelo método espectrofotométrico de Ellman et al. (1961), modificado por Rhee et al (2001) e Trevisan et al. (2003). Para a preparação da placa de teste foi utilizado as seguintes soluções por poço: 25 µL de iodeto de acetiltiocolina (15 mM), 125 µL de 5,5’–ditiobis-[2- nitrobenzóico] na solução Tris/HCl (50 nM, pH=8), com 0,1 M de NaCl e 0,02 M de MgCl2.6 H2O.(3 mM, DTNB ou reagente de Ellman), 50 µL da solução Tris/HCl (50 nM, pH=8), com 0,1% de albumina sérica bovina (BSA), 25 µL da amostra de extrato dissolvida em Etanol (2 mg.mL-1) e diluída 10 vezes na solução Tris/HCl (50 mM, pH=8) para obter uma concentração final de 0,2 mg.mL-1 (TREVISAN et al., 2003). O padrão utilizado como controle positivo foi a fisostigmina. Todos os testes foram em triplicata.
Resultado e discussão
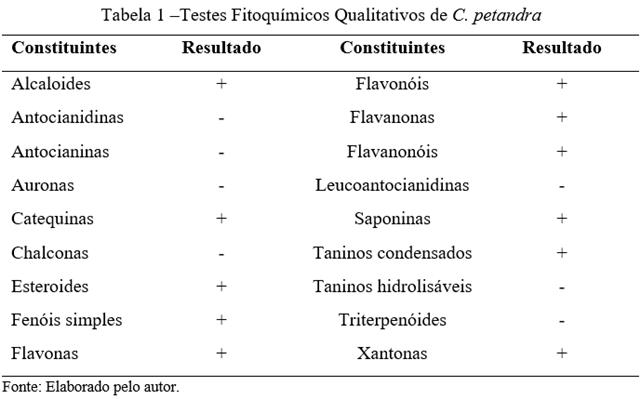
Os resultados dos testes fitoquímicos qualitativos realizados no EECP foram
expostos na tabela 1. A prospecção fitoquímica realizada identificou a
presença de importantes metabólicos secundários no EECP. Alcaloides,
catequinas, esteroides, fenóis simples, flavonoides, saponinas, taninos
condensados e xantonas são compostos que cientificamente já forram comprovados
com alguma propriedade farmacológica. Em relação a quantificação dos fenóis
totais, foram encontrados os seguintes valores de absorbância: 0,149; 0,142;
0,145. Utilizou-se a curva de calibração do ácido gálico (y = 0,127x - 0,011),
determinando-se a concentração relativa para cada absorbância. Os valores das
concentrações encontradas foram: 362,20; 343,83; 351,71. A média foi de
352,58. O desvio padrão foi de 9,22. Portanto, o teor de Fenóis totais
contidos no EECP foi de 352,58 ± 9,22 mg EAG/g de extrato. Em relação a
quantificação dos flavonoides totais, foram obtidos os seguintes valores de
absorbância: 0,080; 0,078; 0,070. Usou-se a curva de calibração da quercetina
(y= 0,067 x - 0,011) para determinar a concentração correspondente a cada
absorbância. Os valores das concentrações encontradas foram: 8,49; 8,30; 7,56.
A média foi de 8,12. O desvio padrão foi de 0,49. Portanto, o teor de
flavonóides totais contidos no EECP foi de 8,12 ± 0,49 mg EQ/g de extrato. A
atividade antioxidante foi analisada por meio do método do radical livre DPPH.
A absorbância inicial do radical livre DPPH foi de 0,630. Com os valores dos
índices de varredura, obteve-se por meio do programa Excel uma curva de
calibração para cada amostra, que gerou uma equação da reta para calcular a
concentração inibitória para 50% da amostra. A avaliação da atividade
antioxidante apresentou uma inibição do radical livre DPPH, com valor de CI50
= 4,19 ±0,16 μg/mL. O padrão positivo da quercetina no ensaio apresentou CI50
= 1,32 ± 0,05 μg/mL, sendo assim o extrato apresentou uma boa atividade
antioxidante, que pode ser justificada pela presença de metabólicos
secundários importantes. A prospecção fitoquímica do EECP revelou a presença
de alcaloides, catequinas, esteroides, fenóis simples, flavonas, flavonóis,
flavanonas, flavanonóis, saponinas, taninos condensados e xantonas. Anosike
et al. (2012), em sua investigação fitoquímica do EECP encontraram
ainda triterpenóides, resina, proteínas, glicosídeos e carboidrato. A inibição
da (AChE) foi de 15,87 ± 0,02 μg/mL. O padrão positivo da Fisostigmina foi de
1,15 ± 0,05 μg/mL. Em comparação com o padrão o EECP mostrou-se eficaz quanto
a inibição da AChE. Este resultado reforça a necessidade da intensificação do
estudo químico dessa espécie, bioguiado pela ação antiacetilcolinesterásica,
para poder identificar e isolar o composto responsável pela inibição observada
e contribuir para aumento do número de compostos químicos ativos pertencentes
a estas classes de metabólitos secundários, os quais poderão ser potenciais
candidatos para o tratamento da Doença de Alzheimer (MORAIS et al.,
2013).
Testes fitoquímicos qualitativos do extrato etanólico das cascas da C. petandra.
Conclusões
O Extrato Etanólico da Casca da Paineira (EECP) revelou a presença de alcaloides, catequinas, esteroides, fenóis simples, flavonas, flavonóis, flavanonas, flavanonóis, saponinas, taninos condensados e xantonas. Estes dados corroboram com estudos anteriores em que C. pentandra mostrou a presença de substâncias antioxidantes como Compostos Fenólicos, Flavonólicos, Alcaloides, Esteroides e Saponinas. O EECP revelou boa atividade antioxidante, o que pode ser atribuída ao alto teor de compostos fenólicos presentes no extrato. O valor baixo da atividade anticolinesterase pode indicar um possível tratamento contra doenças do sistema nervoso como a Doença de Alzheimer. Tais dados corroboram com o potencial farmacológico e fitoterápico da espécie, sendo necessários mais estudos para identificação dos seus compostos bioativos.
Agradecimentos
Agradecemos primeiramente à Deus, a orientação da profª Drª Selene Maia de Morais. E a todos os envolvidos no Laboratório de Química dos Produtos Naturais (LQPN).
Referências
ANOSIKE, C. A. et al. Phytochemical screening and antimicrobial activity of the petroleum ether, methanol and ethanol extracts of Ceiba pentandra stem bark. Journal Of Medicinal Plants Research, [s.l], v. 6, n. 46, p.5743-5747, dez. 2012. DOI: 10.5897/JMPR12.978. Http://www.academicjournals.org/JMPR.
ARAÚJO, C. R. M.; SANTOS, V. L. A.; GONSALVES, A. A. Acetilcolinesterase AChE: Uma Enzima de Interesse Farmacológico. Revista Virtual de Química, [s.l.], v. 8, n. 6, p.00-00, nov. 2016.
AZEVEDO, D. S. Utilização do teste de inibição da enzima acetilcolinesterase aplicado no estudo da degradação abiótica dos agrotóxicos organofosforados. 2013. 40 f. TCC (Graduação em Química) - Curso de Licenciatura em Química, Centro de Ciência e Tecnologia, Universidade Estadual do Norte Fluminense Darcy Ribeiro, Campos de Goytacazes, 2013.
ELLMAN, G. L.; COURTNEY, K. D.; ANDRES, V. JR.; FEATHERSTONE, R. M. A new and rapid colorimetric of acetylcholinesterase determination of acetylcholinesterase activity. Biochemical Pharmacology, v. 7, p. 88–95, 1961.
FERNANDES, T. M. Plantas medicinais: memória da ciência no Brasil. Rio de Janeiro: Editora Fiocruz, 2004. 260 p. ISBN 978-85-7541-348-7. Disponível em: <http://books.scielo.org/id/bg6yw>. Acesso em: 15 fev. 2019.
FUNARI, C. S; FERRO, V. O. Análise de própolis. Ciência e Tecnologia de Alimentos, Campinas, v. 26, n. 1, p. 171-178, 2006.
LIMA, F. O. Estudo comparativo da bioatividade de compostos fenólicos em plantas medicinais. 2013. 145 f. Tese (Doutorado em Química Analítica) - Programa de Pós Graduação em Química, Centro de Ciências Naturais e Exatas, Universidade Federal de Santa Maria, Santa Maria, 2013.
LOGANAYAKI, N.; SIDDHURAJU, P.; MANIAN, S. Antioxidant activity and free radical scavenging capacity of phenolic extracts from Helicteres isora L. and Ceiba pentandra L. Journal Of Food Science And Technology, [s.l.], v. 50, n. 4, p.687-695, jul. 2013. Springer Science and Business Media LLC. http://dx.doi.org/10.1007/s13197-011-0389-x.
MARQUES, P. V.; CAIXETA, B. T. A importância da avaliação das dosagens das colinesterases em casos de intoxicações por organofosforados. Psicologia e Saúde em Debate, [s.l.], v. 2, n. 1, p.1-17, maio 2016. Psicologia e Saúde em Debate. http://dx.doi.org/10.22289/2446-922x.v2n1a1.
MATOS, F. J. A. Introdução a Fitoquímica Experimental. 3 ed., Edições UFC, Fortaleza, 148 p., 2009.
MONTEIRO, S. C.; BRANDELLI, C. L. C. Farmacobotânica: aspectos teóricos e aplicação. [s. l.]: Artmed, 2017. 172 p. ISBN: 9788582714416. Disponível em: <https://www.grupoa.com.br/farmacobotanica-ebook-p989216>. Acesso em: 20 mar. 2018.
MORAIS, S. M. de et al. Correlação entre as atividades antiradical, antiacetilcolinesterase e teor de fenóis totais de extratos de plantas medicinais de farmácias vivas. Revista Brasileira de Plantas Medicinais, [s.l.], v. 15, n. 4, p.575-582, 2013. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s1516-05722013000400014.
MORAIS, S. M.; VIEIRA, Í. G. P. (organizadores). Introdução à prospecção de produtos naturais (livro eletrônico). Fortaleza, CE: EdUECE, 2018. 151 p.
MUÑOZ-CAZARES, N. et al. Phytochemical screening and anti-virulence properties of Ceiba pentandra and Ceiba aesculifolia (Malvaceae) bark extracts and fractions. Botanical Sciences, [s.l.], v. 96, n. 3, p.415-425, 14 set. 2018. Botanical Sciences, Sociedad Botanica de Mexico, AC. http://dx.doi.org/10.17129/botsci.1902.
OLIVEIRA, H. W. C. Cerrado e Plantas Medicinais: Algumas Reflexões sobre o Uso e a Conservação. 2011. 29 f. TCC (Graduação em Ciências Naturais) - Curso de Ciências Naturais, Centro de Ciências, Universidade de Brasília, Planaltina, 2011.
PETRONILHO, E. C.; FIGUEROA-VILLAR, J. D. Agents for Defense Against Chemical Warfare: Reactivators of the Inhibited Acetylcholinesterase with Organophosphorus Neurotoxic Compounds. Revista Virtual de Química, [s.l.], v. 6, n. 3, p.671-686, mar. 2014. Sociedade Brasileira de Quimica (SBQ). http://dx.doi.org/ 10.5935/1984-6835.20140042.
RHEE, I. K. et al. Screening for acetylcholinesterase inhibitors from Amaryllidaceae using silica gel thin-layer chromatography in combination with bioactivity staining. Journal of Chromatography A, [s.l.], v. 915, n. 1-2, p.217-223, abr. 2001. Elsevier BV. http://dx.doi.org/10.1016/s0021-9673(01)00624-0.
SOUSA, C. M. M. et al. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Química Nova, [s.l.], v. 30, n. 2, p.351-355, 19 jan. 2007.
SOUZA, C. R. et al. Sumaúma Ceiba pentandra (L.) Gaerth. Manaus: Embrapa Amazônia Ocidental, 2005. 22 p. (ISSN 1517-3135). Embrapa Amazônia Ocidental. Documentos; 41.
TREVISAN, M. T. S. et al. Seleção de plantas com atividade anticolinasterase para tratamento da doença de Alzheimer. Química Nova, [s.l.], v. 26, n. 3, p.301-304, maio 2003. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/ s0100-40422003000300002.
WERMUTH, D. Compostos fenólicos e atividade antibacteriana de extratos de folhas de jambeiro vermelho (Syzygium malaccense). 2015. 32 f. Monografia (Especialização em Gestão da Qualidade na Tecnologia de Alimentos) - Curso de Especialização em Gestão da Qualidade na Tecnologia de Alimentos, Universidade Tecnológica Federal do Paraná, Francisco Beltrão, 2015.
YEPEZ, B.; ESPINOSA, M.; LÓPEZ, S.; BOLAÑOS, G. Producing antioxidantfractions from herbaceous matrices by supercritical fluid extraction. Fluid Phase Equilibria, 194, 879-884. 2002.









