CARACTERIZAÇÃO DOS FLAVONOIDES PRESENTES NO EXTRATO ETANÓLICO DAS FOLHAS DE OURATEA FIELDINGIANA (GARDNER) ENGL. POR CROMATOGRAFIA LÍQUIDA DE ALTA EFICIÊNCIA E AVALIAÇÃO DA ATIVIDADE ANTIACETILCONINESTERASE
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Frota, L.S. (UECE) ; Alves, D.R. (UECE) ; Rodrigues, A.L.M. (UECE) ; Guerra, D.L. (UECE) ; Freitas, L.S. (UECE) ; Morais, S.M. (UECE)
Resumo
O presente trabalho objetivou identificar os diversos tipos de flavonoides presentes no extrato etanólico das folhas de O. fieldingiana (E.E.F.O.F.) submetido a extração prévia da clorofila e avaliar o efeito inibidor da enzima acetilcolinesterase. O extrato foi obtido por maceração em álcool comercial 70%, e após evaporação do solvente, foi filtrado, obtendo-se um material graxoso contendo clorofila e uma solução aquosa castanha rica em flavonoides, a qual foi liofilizada e denominada de E.E.F.O.F. A atividade anticolinesterasica do E.E.F.O.F. foi relevante e sendo analisado por Cromatografia Líquida de Alta Eficiência foram caracterizados os flavonoides rutina, isoquercitrina, kaempferol-3-O-rutinosídeo, quercetina, apigenina e amentoflavona.
Palavras chaves
Ouratea fieldingiana; HPLC; Acetilcolina
Introdução
A Ouratea fieldingiana é uma espécie arbórea pertencente à família das Ochnaceae. Esta família compreende cerca de 27 gêneros e 600 espécies tropicais distribuídas em zonas tropicais e subtropicais em todo o mundo (AMARAL, 1991). Ouratea é o maior gênero desta família e compreende aproximadamente 300 espécies tropicais que ocorrem principalmente na América do Sul e África tropical (HEYWOOD, 1978; DAHLGREN, 1980). Dentre essas espécies, 120 são endêmicas da zona neotropical (SASTRE, 1988; SALVADOR et al., 2010) em 28 espécies recentemente descritas (SASTRE, 1995; 1997; 2001; 2004; 2005; 2006; 2007; YAMAMOTO, 1995; SALVADOR et al., 2006). As espécies são sempre-verdes, arbustiva ou arbórea (CHACON, 2011; CARVALHO et al., 2000). A família Ochnaceae tem sido caracterizada como uma importante fonte de biflavonóides e devido às características estruturais e diferentes padrões de ligação entre os monômeros, determinados grupos dessas substâncias têm sido considerados marcadores quimiotaxonômicos de alguns gêneros (SUZART, 2007). Os biflavonóides são dímeros de flavonóides formados através de reações radicalares. Existe um interesse crescente em desvendar novas moléculas provenientes destas reações, entretanto, os estudos ainda são bastantes preliminares, pois, a função destas moléculas nas plantas e o exato mecanismo da biossíntese desses dímeros ainda não foram elucidados. O grande acúmulo de biflavonóides em algumas espécies e a ampla distribuição em vários tecidos (folhas, casca, raízes, pólen, frutos e sementes) tem sido uma questão em discussão (HARBORNE, 1988). Em folhas, por exemplo, geralmente, são associados com a proteção contra radiação UV. Já existem relatos que extratos contendo polifenólicos atuam como “sequestrantes” de radicais livres, bem como antilipoperoxidantes além de auxiliar na proteção do colágeno da degradação causada pelo radical ânion superóxido (CHEN & HO, 2003). Outros constituintes fenólicos possuem uma variedade de inibidores da lipoxigenase, potencialmente benéficos, além de propriedades antioxidantes. Com o advento de tais achados, os extratos têm sido usados para o tratamento de doenças anti-inflamatórias (TROUILLAS et al., 2003). Alguns membros do gênero Ouratea têm sido usados na medicina tradicional no Brasil e em muitos países africanos, incluindo Camarões, Nigéria, Congo e Gabão (BOUQUET, 1969). A medicina popular a usa principalmente para o tratamento de doenças inflamatórias e infecciosas. Estas plantas apresentam geralmente similaridades em sua composição química, contendo uma variedade de compostos ativos como fitosteróis, fitoestrogênios, triterpenos (livres ou esterificados a ácidos graxos), lecitinas, lignanas e flavonoides. Estas substâncias possuem atividade anti-androgênica, anti-inflamatória, inibem a proliferação celular, sendo que o efeito destes extratos possivelmente não esteja relacionado a um único componente ativo e sim ao efeito sinergético de seus componentes (BACH et al., 1996; CRISTONI et al., 2000). Em trabalho anterior com a espécie O. fieldingiana, as sementes e folhas foram extraídas com etanol em aparelho Soxhlet e por maceração, respectivamente. Ambos os extratos foram submetidos a cromatografia em coluna de sílica gel para isolamento dos constituintes principais, seguida de purificação em sephadex. As estruturas dos compostos foram estabelecidas por espectroscopia 1H e 13C-NMR e identificadas por comparação com dados da literatura como amentoflavona e kaempferol-3-O-rutinosídeo, respectivamente. Em geral, os extratos com maior atividade antioxidante corresponderam aqueles com maior teor de compostos fenólicos e flavonóides. Os extratos etanólicos e dois compostos isolados apresentaram atividade antifúngica relevante contra várias cepas de Candida (Nascimento et al., 2018). Nesse contexto, o presente trabalho objetivou identificar os compostos químicos do extrato etanólico das folhas da O. fieldingiana e avaliar seu potencial inibidor da enzima acetilcolinesterase.
Material e métodos
Para a realização deste estudo, foram utilizadas folhas da planta O. fieldingiana, coletadas no mês de março, no município de Trairi, Ceará – Brasil. Um exemplar desse espécime encontra-se no Herbário Prisco Bezerra (EAC) da Universidade Federal do Ceará (UFC), com a identificação botânica de Ouratea fieldingiana (Gardner) Engl depositada sob o número 62392 e identificada por Luiz Wilson Lima-Verde em 03/04/2019. Para a obtenção do Extrato Etanólico das folhas de O. fieldingiana (E.E.E.O.F.), as folhas (1 Kg) secas, moídas e submetidas ao método de maceração (MORAIS; VIEIRA, 2018). O líquido extrator foi filtrado para um balão de fundo redondo (previamente tarado) e concentrado em evaporador rotativo a vácuo na temperatura de 65ºC. Após esse processo, filtrou-se o concentrado em funil de Buchner acoplado a um kitassato e a uma bomba de vácuo, para remoção do material graxoso contendo a clorofila, pigmento esverdeado, obtendo-se uma solução de cor castanho avelã, a qual foi submetida à liofilização, para remoção de água presente na amostra. O E.E.F.O.F foi submetido à cromatografia liquida de alta eficiência (HPLC- DAD), para identificação dos compostos fenólicos. Para tanto, os padrões analíticos rutina, isoquercitrina, kaempferol-3-O- rutinosídeo, quercetina, apigenina e amentoflavona foram adquiridos da Sigma Chemical Co. (St. Louis, MO, EUA). Os solventes utilizados para extração foram de grau analítico (Vetec®), e em HPLC foram utilizados solventes de grau de HPLC (J.T. BAKER®). A água foi purificada com um sistema Milli-Q (UV Direct3). Todas as amostras e soluções preparadas para análises por HPLC foram filtradas através de uma membrana de nylon de 0,45 µm e filtro de membrana de 0,22 µm (Millipore), respectivamente, antes da utilização. Todas as análises foram realizadas em triplicado. Posteriormente, o E.E.F.O.F foi submetido ao teste de inibição da enzima acetilcolinesterase. Para tanto, utilizou-se como reagentes (por poço): 25 µL de iodeto de acetiltiocolina (15 mM), 125 µL de 5,5’–ditiobis-[2- nitrobenzóico] na solução Tris/HCL com 0,1 M de NaCL e 0,02 M de MgCL2 .6H2O, 50 µL da solução Tris/HCLcom 0,1% de albumina sérica bovina, 25 µL da amostra de extrato dissolvida em Metanol ou de um padrão de Fisostigmina (Eserina) (Curva de diluição a partir de 2 mg/mL). A atividade inibitória da enzima acetilcolinesterase (AChE) foi aferida em placas de 96 poços de fundo chato utilizando leitor Elisa BIOTEK, modelo ELX 800, software “Gen5 V2.04.11”. baseando-se na metodologia descrita por ELLMAN et al. (1961). Após normalização dos dados foi realizado teste de curva de regressão não linear pelo programa estatístico GraphPad Prism v5.01 para obter resultados preliminares devendo ser feito o teste de variância com comparação múltipla entre pares pelo teste de Tukey, considerando significativos valores de P<0,05.
Resultado e discussão
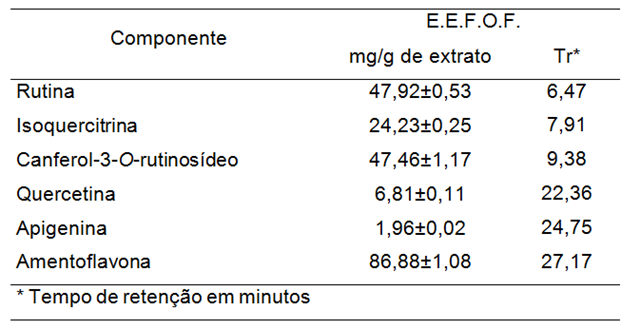
Os compostos fenólicos identificados e quantificados no extrato etanólico das
folhas de O. fieldingiana, através da análise no HPLC-DAD, estão apresentados
na Tabela 01:
*Tabela 01*
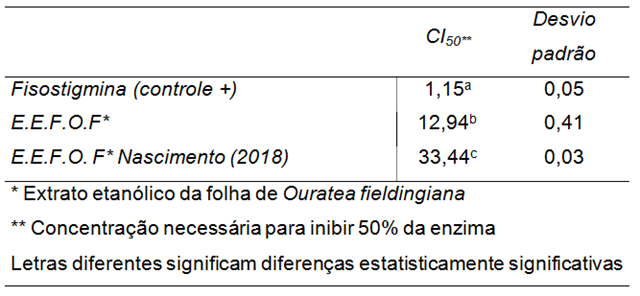
O extrato etanólico das folhas de O. fieldingiana apresentou boa atividade
inibitória da enzima acetilcolinesterase com CI50 (concentração inibitória
média) = 12,94 (Tabela 02). O resultado obtido neste trabalho, foi superior ao
observado por NASCIMENTO (2018) para um extrato etanólico obtido com onde as
folhas de O. fieldingiana foram coletadas no mês de dezembro. A diferença pode
ter sido devida a forma de obtenção do extrato analisado que no caso deste
trabalho o extrato etanólico sofreu a retirada da clorofila, então o
percentual relativo aumenta.
*Tabela 02*
Quantificação de compostos fenólicos do Extrato etanólico das folhas de Ouratea fieldingiana (E.E.F.O.F) analisados por HPLC-DAD.
Atividade de inibição da enzima acetilcolinesterase.
Conclusões
O extrato etanólico das folhas de Ouratea fieldingiana apresentou componentes fenólicos em sua composição, sendo majoritários a Amentoflavona, Canferol-3-O- rutinosideo e Rutina, compostos que apresentam diversas propriedades biológicas. Além disso, esse extrato mostrou uma boa capacidade inibidora da enzima acetilcolinesterase. Esses resultados indicam o potencial biológico das folhas de O. fieldingiana, e estimulam a realização do isolamento das suas moléculas bioativas, bem como a investigação do seu desempenho frente à diversas bioatividades.
Agradecimentos
Gostaria de agradecer primeiramente a minha mãe e a minha noiva, aos meus amigos e a minha orientadora Selene Maia de Morais pela oportunidade e conhecimento transmitido, a UECE e FUNCAP pelo suporte.
Referências
AMARAL, MCE. Phylogenetische systematik der Ochnaceae. Robô. Jahrb. Syst. 1991. p.113, 105-196.
BACH, D.; SCHMITT, M.; EBELING, L. Phytopharmaceutical and synthetic agents in the treatment of benign prostatic hyperplasia (BPH). Phytomedicine, v. 3, n. 4, p. 309-313,1996.
BOUQUET, A. Féticheurs et Médecines Traditionnelles du Congo Brazzaville. Paris: ORSTOM. 1969.
CARVALHO, MG; CARVALHO, GJA; BRAZ-FILHO, R. Constituintes químicos de Ouratea floribunda: atribuições completas de RMN de 1H e 13C de atranorina e seu novo derivado acetilado. J. Braz. Chem. Soc. 11, 2000. p.143-147.
CHACON, RG. Ochnaceae nos estados de Goiás e Tocantins, Brasil. Brasília. Dissertação de mestrado, Universidade de Brasília. 2011. p.122
CHEN, J.H; HO, C.T. Antioxidant activities of caffeic acid and its related hydroxycinnamic acid compounds. Journal of Agricultural and Food chemistry, v.45, p.2374-2378, 1997.
CRISTONI, A.; PIERRO, F.; BOMBARDELLI, E. Botanical derivatives for the prostate. Fitoterapia, v.71, p.21-28, 2000.
DAHLGREN, RMT. Um sistema revisado de classificação das angiospermas. Robô. J. Line Soc. 80, 1980. p.91-124.
ELLMAN G. L., COURTNEY K. D., ANDRES V. JR., AND FEATHERSTONE R. M. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem. Pharmacol. 7, p.88-95, 1961.
HARBORNE, J. B. The flavonoids: Advances in research since 1980. Chapman and Hall Press, London. 1988.
HEYWOOD, VH. Plantas de floração do mundo. Londres: Oxford University Press. 1978.
MORAIS, S. M; VIEIRA, I. G. P. Introdução à prospecção de produtos naturais. 1ª Edição. Ed. UECE. 2018.
NASCIMENTO, J. E. T. Caracterização química e avaliação de atividades biológicas de extratos e constituintes de Ouratea fieldingiana (gardner) engl. Tese de Doutorado em Biotecnologia – Universidade Estadual do Ceará. 2018.
SALVADOR, GS, CERVI, CA, BROTTO, ML, SANTOS, EP. A família Ochnaceae DC. no estado do Paraná, Brasil. Acta. Robô. Bras. 24, 2010. p.423-434.
SALVADOR, GS; SANTOS, PE; CERVI, AC. Uma nova espécie de Ouratea Aubl. (Ochnaceae) da América do Sul. Fontqueria 55, 2006. p.293-296.
SASTRE, C. Deux nouvelles espèces d´Ouratea (Ochnaceae) des Guyanes. Adansonia sér. 3, 28, 2006. p.119-127.
SASTRE, C. Estudos sobre a Flora das Guianas 34. Sinopse genérica Ouratea Aubl. (Ochnaceae) Boletim Mus. Natl. Hist. Nat. Paris sér. 4, seita. B, Adansonia 1, 1998. p.47-67.
SASTRE, C. Novas espécies de Ouratea (Ochnaceae) da Venezuela e países adjacentes. Novon 11, 2001. p.105-118.
SASTRE, C. Novidades no gênero Neotropical Ouratea Aublet (Ochnaceae). Novon 5, 1995. p.193-200.
SASTRE, C. Seis nouvelles espèces d´Ouratea (Ochnaceae) des Guyanes. Adansonia ser. 3, 27, 2007. p.85-88.
SASTRE, C. Uma nova espécie de Sauvagesia L. (Ochnaceae) do campo rupestre do Estado de Goiás. Boletim de Botânica da Universidade de São Paulo 16, 1997. p.71-73.
SASTRE, C. Une nouvelle espèce d'Ouratea (Ochnaceae) da Venezuela. Adansonia ser. 3, 29, 2004. p.77-91.
SUZART, L. R.; DANIEL, J. F. de S.; CARVALHO, M. G. Biodiversidade Flavonoídica e Aspectos Farmacológicos em Espécies dos Gêneros Ouratea e Luxemburgia (Ochnaceae). Quim. Nova, v. 30, n. 4, p. 984-987, 2007.
TROUILLAS, P. et al., Antioxidant, anti-inflamatory and antiproliferative properties of sixteen water plant extracts used in the Limousin countryside as herbal teas. Food Chemistry, v.80, p.399-407, 2003.
YAMAMOTO, K. Ouratea hatschbachii (Ochnaceae): Uma nova espécie de Grão-Mogol, Estado de Minas Gerais. Bol. Robô. da USP, 1995. 14: 33-37.









