APLICAÇÃO DE EMULSÕES DE CANELA (Cinnamomum verum) NO COMBATE A FUNGOS NA GERMINAÇÃO DE SEMENTES DE BARU (Dipteryx alata)
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Barbosa, J.C.J. (UNIVERSIDADE FEDERAL DE GOIÁS - REGIONAL JATAÍ) ; Barroso, M.H.S. (UNIVERSIDADE FEDERAL DE GOIÁS - REGIONAL JATAÍ) ; Malaquias, K.S. (UNIVERSIDADE FEDERAL DE GOIÁS - REGIONAL JATAÍ) ; Dias, D.P. (UNIVERSIDADE FEDERAL DE GOIÁS - REGIONAL JATAÍ) ; Nebo, L. (UNIVERSIDADE FEDERAL DE GOIÁS - REGIONAL JATAÍ)
Resumo
O presente trabalho visou analisar o potencial antifúngico de emulsões de quitosana com óleos essenciais de canela (Cinnamomum verum) na assepsia de sementes de baru e seu efeito na germinação. As emulsões utilizadas neste trabalho foram preparadas via adição controlada de uma fase aquosa contendo quitosana e ácido acético em uma fase orgânica contendo o óleo essencial de canela (OEC). As sementes de baru (Dipteryx alata) foram acondicionadas em placas de Petri e submetidas a quatro tratamentos distintos. As emulsões de canela aumentaram a porcentagem de germinação e reduziram a infestação de fungos em sementes de baru, assim como o hipoclorito de sódio, porém sem efeito fitotóxico, contribuindo para a diminuição do impacto ambiental no tratamento de sementes.
Palavras chaves
POTENCIAL ANTIFÚNGICO; CANELA; BARU
Introdução
O baru (Dipteryx alata Vog., Fabaceae) é uma espécie arbórea frutífera nativa do Cerrado que possui diversas utilizações, como: sombreamento, forragem, madeira, reciclagem de nutrientes, por meio da decomposição da serapilheira, e alimentação humana. É considerada uma cultura promissora para cultivo com fins de produção de frutos e recuperação de áreas degradadas (Sano et al, 2016). Em estudo realizado por Santos et al. (2007), com sementes de baru aparentemente sadias, foram detectados diferentes fungos (Aspergillus niger, Aspergillus flavus, Aspegillus sp., Phomopsis sp., Chaetomium sp., Fusarium oxysporum, Fusarium sp., Rhizopus sp., Pestalotia sp. e Trichoderma sp.). Estes fungos podem inviabilizar o uso alimentício e afetam diretamente o processo de germinação, o que pode desencadear sua inviabilidade, bem com a formação de mudas da espécie. Nos testes de germinação, geralmente, as sementes são imersas em produtos químicos para promover a eliminação de patógenos. O tratamento químico é feito principalmente com hipoclorito de sódio e ácido sulfúrico, contudo estes são tóxicos, nocivos ao meio ambiente e podem contribuir para o surgimento de patógenos resistentes. Com isso, a busca por produtos naturais é viável, onde destacam-se os óleos essenciais de plantas, uma vez que, tais produtos apresentam metabólitos secundários que podem controlar o crescimento micelial de fitopatógenos, são pouco ou até atóxicos ao homem, podendo assim, substituir o controle químico no tratamento de sementes (Laviola et al., 2006; Venturoso et al., 2011). Desta forma, o objetivo do presente estudo foi avaliar o potencial da aplicação de emulsões de óleos essenciais de canela (Cinnamomum verum) no combate à fungos na germinação de sementes de baru (Dipteryx alata).
Material e métodos
Os frutos de D. alata foram colhidos em três árvores matrizes localizadas na Universidade Federal de Goiás - Regional Jataí (UFG/REJ), em setembro de 2018. As sementes foram selecionadas e suas dormências foram superadas a partir da escarificação mecânica. Posteriormente, as sementes foram lavadas em água corrente para eliminação de todos os resíduos do processo de escarificação. As sementes de foram submetidas a quatro tratamentos (25 sementes/tratamento): T1: água destilada; T2: hiperclorato de sódio 13 %; T3: emulsão de OEC em ácido acético 20%; T4: emulsão de OEC em ácido acético 30%. As emulsões utilizadas foram preparadas através da adição em conjunto controlada de uma fase aquosa e uma fase orgânica. A fase aquosa contendo quitosana em solução de ácido acético 20% e 30% e 500 μL do tensoativo Tween 80 e a fase orgânica contendo 1000 μL de óleo essencial de canela juntamente com Tripolifosfato de sódio (TPP) e 500 μL do tensoativo Span 80. O tempo de preparo das emulsões foi estimado em 6 horas de adição das fases e constante agitação. O teste de germinação foi conduzido no Laboratório de Sementes Florestais da UFG/REJ em germinador com demanda bioquímica de oxigênio (DBO) à 25ºC e fotoperíodo de oito horas. As sementes foram distribuídas em 2 folhas de papel filtro umedecidas com quantidade de água equivalente a 2,5 vezes o peso do substrato seco (BRASIL, 2009). A germinação das sementes foi analisada periodicamente durante 24 dias. Com os dados obtidos foi possível calcular a porcentagem de germinação das sementes e o índice de contaminação destas. Os dados foram submetidos à análise de variância e regressão, e as médias comparadas pelo teste Skott-knott, ao nível de 5% de probabilidade. Para a análise estatística foi utilizado o software Rbio.
Resultado e discussão
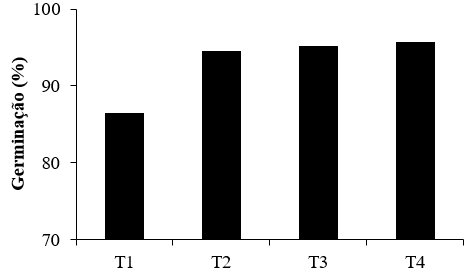
A germinação das sementes de D. alata variou em função dos tratamentos
testados, de 86,5 a 95,75%, respectivamente, para os tratamentos 1 e 4,
conforme mostrado na Figura 1. No estudo conduzido por Botezelli et al.
(2000), a porcentagem de germinação de sementes desta espécie, obtidas em
diferentes localidades, foi de 88,0 a 93%, valores similares aos
encontrados. Houve variação significativa da germinação entre os tratamentos
(p < 0,01), sobretudo devido a menor percentagem de germinação no T1 (Figura
1). T2, T3 e T4 apresentaram porcentagem de germinação similares. Nos quatro
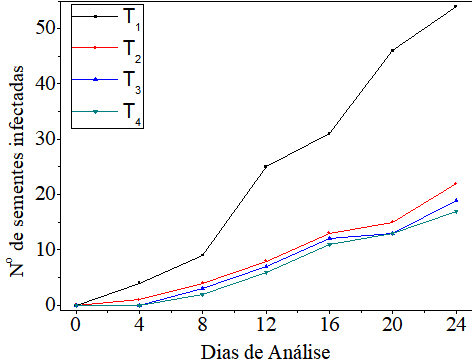
tratamentos foram observadas sementes infestadas com fungos (Figura 2). Isto
era esperado, visto que a detecção de diferentes fungos, como Aspergillus
niger, Aspergillus flavus, Aspegillus sp., Phomopsis sp., Chaetomium sp.,
Fusarium oxysporum, Fusarium sp., Rhizopus sp., Pestalotia sp. e Trichoderma
sp., foram observadas em sementes de baru por Santos et al. (2007). O número
de sementes com fungos foi superior no T1, seguido dos outros tratamentos
(Figura 2). T2, T3 e T4 apresentaram redução no número de sementes
infestadas com fungos. O principal constituinte do OEC é o cinamaldeído que
têm poderosa atividade antimicrobiana contra uma variedade de patógenos,
incluindo fungos, bactérias Gram-positivas e Gramnegativas (Shen, et al.,
2014; Chen, et al., 2015). O mecanismo de ação deste composto pode estar
relacionado ao dano causado à integridade da membrana dos microrganismos. A
estrutura do cinamaldeído contém uma parte terpenóide hidrofóbica de
considerável permeabilidade celular. Ao atravessar a membrana, o composto
desencadeia uma série de alterações que acarretam a destruição da membrana
celular dos microrganismos (Utchariyakiat, et al, 2016).
T1: água destilada; T2: hiperclorato de sódio 13 %; T3: emulsão de OEC em ácido acético 20%; T4: emulsão de OEC em ácido acético 30%.
T1: água destilada; T2: hiperclorato de sódio 13 %; T3: emulsão de OEC em ácido acético 20%; T4: emulsão de OEC em ácido acético 30%.
Conclusões
O óleo essencial de canela aplicado em sementes de D. alata reduz e posterga a infestação por fungos, assim como ocorre nas sementes tratadas com hipoclorito. A porcentagem de germinação das sementes desta espécie aumenta cerca de 10% quando estas passam por tratamento com hipoclorito e com óleo essencial de canela. A ação antimicrobiana do tratamento químico foi comparável à aqueles contendo o óleo essencial, o que evidencia uma potencial aplicação do OEC na manutenção da qualidade sanitária de sementes.
Agradecimentos
Referências
Botezelli, L.; Davide, A. C.; Malavasi, M. M. Características dos Frutos e Sementes de Quatro Procedências de Dipteryx alata Volgel (Baru). Universidade Federal de Lavras, Lavras, Brasil, Vol. 6, Nº 1, 9-18, 2000.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Regras para análise de sementes. MAPA/ACS, 399p., 2009.
Chen, W.; Golden, D. A.; Critzer, F. J.; Davidson, P. M. Antimicrobial activity of cinnamaldehyde, carvacrol, and lauric arginate against Salmonella Tennessee in a glycerol-sucrose model and peanut paste at different fat concentrations. J. Food Prot. 78, 1488–1495, 2015.
Farias, L. A.; Fávaro, D. I. T. Vinte Anos de Química Verde: Conquistas e Desafios. Química Nova, Vol. 34, Nº 6, 1089-1093, 2011.
Laviola, B. G.; Lima, P. A.; Júnior, A. W.; Mauri, A. L.; Viana, R. S.; Lopes, J. C. Efeito de Diferentes Substratos na Germinação e no Desenvolvimento Inicial de Jiloeiro (Solanum gilo RADDI), Cultivar Verde Claro. Ciênc. Agrotec., Lavras, Vol. 30, Nº 3, 415-421, 2006.
Lima, I. de O.; Oliveira, R. de A. G.; Lima, E. de O.; Farias, N. M. P.; Souza, E. L. de. Atividade antifúngica de óleos essenciais sobre espécies de Candida. Revista Brasileira de Farmacologia, Vol. 16, Nº 2, 197-201, 2006.
Prado, A. G. S. Química Verde, Os Desafios Da Química Do Novo Milênio. Química Nova, Vol. 26, Nº 5, 738-744, 2003.
SANTOS, M. de F.; RIBEIRO, W. R. C.; FAIAD, M. G. R.; SANO, S. M. Fungos associados as sementes de baru (Dipteryx alata Vog.). Revista Brasileira de Sementes, Brasilia, v.19, n.1, p.135-139, 1997.
Shen, S.; Zhang, T.; Yuan, Y.; Lin, S.; Xu, J.; Ye, H. Effects of cinnamaldehyde on Escherichia coli and Staphylococcus aureus membrane. Food Control. 47, 196–202, 2015.
Venturoso, L. dos R.; Bacchi, L. M. A.; Gavassoni, W. L.; Conus, L. A.; Pontim, B. C. A.; Bergamin, A. C. Atividade antifúngica de extratos vegetais sobre o desenvolvimento de fitopatógenos. Summa Phytopathol., Botucatu, Vol. 37, Nº 1, 18-23, 2011.
Utchariyakiat, I.; Surassmo, S.; Jaturanpinyo, M.; Khuntayaporn, P.; and Chomnawang, M. T. Efficacy of cinnamon bark oil and cinnamaldehyde on anti-multidrug resistant Pseudomonas aeruginosa and the synergistic effects in combination with other antimicrobial agents. BMC Complement. Altern. Med. 16:158. 2016.









