INFLUÊNCIA DO TEMPO DE FERMENTAÇÃO EM CULTIVO ESTÁTICO NAS PROPRIEDADES DA CELULOSE BACTERIANA
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Barros, M.O. (UFC) ; Almeida, N.T. (UFC) ; Almeida, J.S. (UFC) ; Rosa, M.F. (EMBRAPA AGROINDÚSTRIA TROPICAL) ; Brígida, A.I.S. (EMBRAPA AGROINDÚSTRIA TROPICAL)
Resumo
A influência do tempo de fermentação nas propriedades morfológicas e térmicas da celulose bacteriana foi estudada. Foram utilizados diferentes tempos de fermentação (4, 6, 8 e 10 dias) em cultivo estático com bactéria Komagataeibacter xylinus ATCC 53582 e meio de cultura sintético HS. As películas obtidas foram caracterizadas quanto a produção, rendimento, produtividade, análise termogravimétrica (TGA) e difração de raios-X (DRX). As amostras obtidas apresentaram boa estabilidade térmica e elevado índice de cristalinidade (93- 97%), apresentando características típicas de celulose bacteriana. O tempo de fermentação de 6 dias bem como o de 4 dias apresentaram os melhores resultados, em relação a produtividade e cristalinidade, o que mostra a viabilidade da obtenção de películas de celulose b
Palavras chaves
Biocelulose; Índice de Ccristalinidade; Fermentação Submersa
Introdução
O crescente interesse por polímeros biodegradáveis vem estimulando a busca por fontes renováveis como matéria-prima para a síntese destes materiais, visando o desenvolvimento de produtos eficientes e que causem o menor impacto ambiental possível. Dentre esses polímeros está a celulose (NASCIMENTO, et al., 2016). A Celulose é um dos polímeros mais abundantes da natureza, tendo em vista que é um dos principais componentes da parede celular de plantas. É um homopolímero linear formado por consecutivas moléculas de anidroglucose, dímero formado por ligações glicosídicas β(14) (KUMAR GUPTA et al., 2019; LAMPUGNANI et al., 2019). Apesar das plantas serem uma das principais fontes de celulose algumas bactérias são capazes de sintetizar esse polímero como Aerobacter, Agrobacterium, Rhizobium, Gluconacetobacter (atualmente Komagataeibacter), Acetobacter, Sarcina e Pseudomonas (ZHAO et al., 2018), a essa variedade de celulose sintetizada por microrganismos dá-se o nome celulose bacteriana (CB). A CB possui uma composição química bastante semelhante a celulose vegetal, porém esse polímero se destaca por suas propriedades físicas, químicas e mecânicas, que muitas vezes, quando comparadas a celulose vegetal, se mostram superiores como elevado índice de cristalinidade, organização tridimensional naturalmente nanométrica em largura (1 – 5nm), elevado grau de pureza (uma vez que a CB é obtida livre de coprodutos como lignina e hemicelulose), elevada capacidade de absorção e retenção de água, alta resistência a tensão, além de sua biocompatibilidade (UL-ISLAM et al., 2012; WANG et al., 2019). Essas propriedades garantem à CB um amplo leque de aplicações como na indústria de alimentos, indústria têxtil, biomedicina, produção de membranas acústicas entre outras (CAI ZHIJIANG, 2011; CHEN et al., 2010; KESHK e SAMESHIMA, 2006). Dependendo da aplicação desejada para a CB diferentes propriedades são consideradas úteis e/ou desejáveis para que o produto final apresente a maior qualidade possível. Essas propriedades podem ser modificadas de maneira química (através de uma funcionalização da membrana de CB) (FARIA et al., 2019), biológica (através de ação enzimática) (KAFLE et al., 2015), físicas (nanofibrilação) (NASCIMENTO et al., 2019) ou ainda através das mudanças de tempo e forma de cultivo durante a fermentação. CBs obtidas com diferentes formas de cultivos apresentam variações em suas características que podem ser benéficas ou não dependendo da aplicação final do material (WANG et al., 2019). Este trabalho tem como objetivo avaliar as propriedades termogravimétricas e de cristalinidade de películas obtidas em cultivo estático com a cepa Komagataeibacter xylinus ATCC 53582 em diferentes tempos de cultivo.
Material e métodos
A produção de CB se deu através de cultivo estático utilizando a cepa Komagataeibacter xylinus ATCC 53582 em inóculo fermentado com meio HS (HESTRIN e SCHRAMM, 1954) (30°C , 48 h), sendo 10 mL desse inóculo adicionado a frascos contendo 100 mL de meio HS e incubados a 30°C. Os períodos de incubação foram selecionados partindo do momento onde se obteve uma película de CB manuseável (4 dias) até o tempo considerado padrão para a produção de CB (10 dias), com intervalos equidistantes. As películas foram lavadas duas vezes em água (100°C, 1h) e repetidas vezes em solução NaOH 0,5 mol/L (80°C, 1h) até completa remoção de meio residual seguida por lavagem com água corrente até pH neutro e lavagem com água destilada para eliminação de sais. As membranas foram secas em balança de infravermelho à 170ºC. Assim, obteve-se o valor de produção e produtividade, equação 1 e 2, respectivamente: P(g/L) = (mCBs / Vm) * 1000 (1) Produtividade (g/L.dia) = (mCBs/Vm*t) *1000 (2) Em que mCBs corresponde à massa de CB seca, Vm equivale ao volume de meio utilizado e t o tempo de fermentação. Foram coletados os extratos fermentados de cada dia do intervalo estabelecido, a fim de quantificar os açúcares após a fermentação, obtendo-se, assim, o rendimento. Para tal, utilizou-se o método DNS (MILLER, 1959). O rendimento foi obtido por meio da equação 3 e o açúcar consumido através da equação 4: YCB/S = (mCB / Si - Sf) * 100 (3) Açúcar consumido (%) = (∆S / Si) * 100 (4) Em que mCB é a massa seca de CB produzida, Si é a quantidade inicial de açúcar, Sf é a quantidade final e ∆S é a quantidade de açúcares consumidos durante o processo fermentativo. Para as análises termogravimétricas, utilizou-se um analisador termogravimétrico Shimadzu modelo TGA-50, no qual as amostras, de aproximadamente 4,0 mg, foram submetidas a temperaturas entre 50 e 500°C, com taxa de aquecimento de 10°C/min, sob atmosfera de nitrogênio com fluxo de 40 mL/min. As análises de DRX foram conduzidas em um difratômetro para amostras policristalinas modelo XPert Pro MPD – Panalytical, com tubo de Co em 40 kV e 40 mA na escala de 2θ foi utilizado na obtenção dos gráficos de difração de Raios-X. Aplicou-se um intervalo angular de 3° a 50°, com uma velocidade de varredura de 0,5°/min. O índice de cristalinidade (IC) foi obtido pelo método descrito por Segal et al. (1957), na equação 5 e o tamanho do cristalito (CS) foi e obtido através da equação 6: IC (%) = [(I002- Iam) / I002] * 100 (4) CS (nm) = K*λ/FWHM*Cosθ (6) Em que I002 é a intensidade máxima do pico de difração para o plano 002 (celulose tipo I) localizada em 2θ ~26° , Iam é a intensidade da parte amorfa da amostra localizada em 2θ ~22°, K é um fator adimensional dependente do método usado para calcular a amplitude (K = 0,94 nesse trabalho), λ é o comprimento de onda do raio-x incidente (λ=0,178897 nm), FWHM é a largura do pico de difração à meia altura (radianos) e θ é o ângulo de difração do pico da fase cristalina.
Resultado e discussão
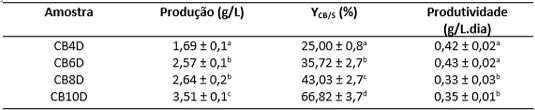
Na figura 1 é possível observar os resultados das análises de produção,
produtividade e rendimento (YCB/S) das amostras estudadas, nomeadas CB4D, CB5D,
CB6D E CB10D de acordo com os dias de fermentação utilizados em sua produção.
Figura 1 – Produção (g/L), YCB/S (%) e Produtividade (g/L.dia) para as amostras
CB4D, CB5D, CB6D E CB10D.
Os valores da produção obtidos apresentaram um crescimento com o aumento do tempo
de fermentação e diferem estatisticamente entre si, com exceção das amostras CB6D
e CB8D, que, segundo teste Tukey, apresentaram valores de produção
estatisticamente iguais. A maior produção (3,51 g/L) foi obtida com 10 dias de
fermentação (CB10D) o que indica que este tempo de fermentação foi o mais eficaz
quando se trata de quantidade de massa seca de celulose obtida apresentando
também o maior rendimento (66,82%) dentre as amostras estudadas. Pensando em uma
escala de produção industrial, os valores de produtividade são tão importantes
quanto os valores de produção, tendo em vista que a produtividade nos revela a
quantidade (em massa seca) de CB obtida por litro de meio utilizado por dia. Para
uma visão industrial, este dado contribui para maior análise/controle de gastos.
As amostras CB6D e CB4D apresentaram as maiores produtividades, 0,42 g/L.dia e
0,43 g/L.dia, respectivamente, então nesse aspecto esses tempos de fermentação
mostram maior eficiência que o 10 dias apesar de possuírem menor produção e
rendimento já que a quantidade de CB produzida por dia é maior. Os valores de
produção obtidos neste trabalho são coerentes com a literatura para este micro-
organismo (CAMPANO et al., 2016; GAO et al., 2019; SINGHSA et al., 2018).
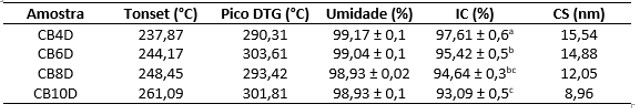
A figura 2 mostra os valores de Tonset, temperatura máxima de degradação (pico
DTG), umidade percentual (U), índice de cristalinidade (IC) e tamanho do
cristalito (CS) para as amostras estudadas.
Figura 2 – Tonset, Pico DTG, U (%), IC (%) e CS (nm) para as amostras CB4D,
CB6D, CB8D e CB10D.
Todas as amostras estudadas apresentaram propriedades termogravimétricas
semelhantes, com dois eventos de degradação. O primeiro, em torno de 100°C,
referente a perda de umidade inerente a amostra e o segundo, em torno de 300°C,
relacionado ao processo de degradação de cadeias glicosídicas que compõe a CB, o
evento ocorreu dentro da faixa citada pela literatura (entre 200°C e 400°C)
(NASCIMENTO et al., 2016; VAZQUEZ et al., 2013). A literatura aponta eventos
entre 150° e 250°C como referentes a proteínas residuais do meio de cultura e do
microrganismo utilizado na fermentação, a ausência desses eventos de degradação
não comuns a CB indicam que a amostras não apresentavam traços de meio de cultura
nem restos de células provenientes do processo fermentativo (GEA et al., 2011). A
temperatura inicial de degradação (Tonset) aumentou com o aumento do tempo de
fermentação, porém todas as temperaturas máximas de degradação foram muito
próximas o que indica que todas as amostras analisadas são termicamente estáveis
e possuem comportamentos térmico semelhantes. A umidade obtida em todas as
amostras foi de, aproximadamente, 99% o que caracteriza a CB como um polímero de
alta umidade e condiz com a faixa característica para celulose bacteriana
reportada na literatura (95-99%) (PECORARO et al., 2008). Em todos os
difratogramas de raios-X foi possível observar um comportamento característico de
CB apresentando três picos em, aproximadamente, 16°, 19° e 26°, picos
característicos de celulose tipo I (forma predominante em celulose excretada por
bactérias) e referentes aos planos cristalográficos (101), (10ī) e (002),
respectivamente. (MAEDA et al., 2006; TSOUKO et al., 2015) O uso do tubo de Co,
ao invés do tubo de Cu, nas análises realizadas causam um deslocamento dos picos
referentes a celulose tipo I, que originalmente se encontrariam em 14°, 16° e
22°. As amostras apresentaram tamanhos de cristalito variando de 8,9 a 15,5 nm,
esses valores justificam a utilização do método proposto por Seagal e
colaboradores para o cálculo do índice de cristalinidade, uma vez que para
amostras com cristalito superior a nm a utilização deste método se torna
igualmente eficiente ao método que utiliza a deconvolução dos picos cristalinos
(FRENCH e SANTIAGO CINTRÓN, 2013). As amostras apresentaram índices de
cristalinidade que variaram de 93 a 97% (figura 2), esses valores estão dentro da
faixa característica para CB reportada na literatura (TROVATTI et al., 2011;
TSOUKO et al., 2015). É possível observar que o índice de cristalinidade e o
tamanho do cristalito diminuem com o aumento do tempo de fermentação. Isto indica
que, mesmo com uma maior produção, o nível de organização estrutural da película
de CB diminui com o aumento do tempo de fermentação.
Produção (g/L), YCB/S (%) e Produtividade (g/L.dia) para as amostras CB4D, CB5D, CB6D E CB10D.
Tonset, Pico DTG, U (%), IC (%) e CS (nm) para as amostras CB4D, CB6D, CB8D e CB10D
Conclusões
Foi possível observar que o tempo de fermentação em cultivo estático utilizando a cepa Komagataeibacter xylinus ATCC 53582 e meio de cultura sintético HS influencia diretamente nas propriedades da celulose bacteriana, como cristalinidade, e não apresenta efeitos negativos em outras propriedades como a estabilidade térmica. O tempo de fermentação de 6 dias bem como o de 4 dias apresentaram os melhores resultados, em relação a produtividade e cristalinidade, o que mostra a viabilidade da obtenção de películas de celulose bacteriana produzidas em menos tempo sem perder em propriedades estruturais e estabilidade térmica. Com estes resultados conclui-se que é possível alterar as propriedades da celulose bacteriana durante o processo fermentativo variando apenas o tempo de fermentação e, de acordo com a diferença entre as propriedades, as aplicações para a CB podem ser definidas.
Agradecimentos
Os autores agradecem a Embrapa Agroindústria Tropical, a CAPES e o CNPq pelo apoio financeiro bem como o programa PRONEX FUNCAP/CNPq (Nº PR2-0101-00023.01.00/15).
Referências
CAI ZHIJIANG, Yang Guang. Bacterial Cellulose/Collagen Composite: Characterization and First Evaluation of Cytocompatibility. Journal of Applied Polymer Science, v. 120, n. 5, p. 2938–2944, 2011.
CAMPANO, Cristina et al. Enhancement of the fermentation process and properties of bacterial cellulose: a review. Cellulose, v. 23, n. 1, p. 57–91, 2016.
CHEN, Peng e CHO, Se Youn e JIN, Hyoung Joon. Modification and applications of bacterial celluloses in polymer science. Polymer Science Macromolecular Research, v. 18, n. 4, p. 309–320, 2010.
DO NASCIMENTO, Eligenes Sampaio et al. TEMPO oxidation and high-speed blending as a combined approach to disassemble bacterial cellulose. Cellulose, v. 26, n. 4, p. 2291–2302, 2019. Disponível em: <https://doi.org/10.1007/s10570-018-2208-2>. Acesso em: 12 aug. 2019.
FARIA, Marisa et al. Poly(glycidyl methacrylate)/bacterial cellulose nanocomposites: preparation, characterization and post-modification Marisa. International Journal of Biological Macromolecules, p. #pagerange#, 2019. Disponível em: <https://doi.org/10.1016/j.ijbiomac.2019.01.133>.
FRENCH, Alfred D. e SANTIAGO CINTRÓN, Michael. Cellulose polymorphy, crystallite size, and the Segal Crystallinity Index. Cellulose, v. 20, n. 1, p. 583–588, 2013.
GAO, Minghong et al. A natural in situ fabrication method of functional bacterial cellulose using a microorganism. Nature Communications, v. 10, n. 1, 2019. Disponível em: <https://doi.org/10.1038/s41467-018-07879-3>. Acesso em: 12 aug. 2019.
GEA, Saharman et al. Investigation into the structural, morphological, mechanical and thermal behaviour of bacterial cellulose after a two-step purification process. Bioresource Technology, v. 102, n. 19, p. 9105–9110, 2011. Disponível em: <http://dx.doi.org/10.1016/j.biortech.2011.04.077>.
HESTRIN, S. e SCHRAMM, M. Synthesis of cellulose by Acetobacter xylinum. 2. Preparation of freeze-dried cells capable of polymerizing glucose to cellulose*. Biochemical Journal, v. 58, n. 2, p. 345–352, 1954. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/13208601%5Cnhttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=PMC1269899>.
KAFLE, Kabindra et al. Progressive structural changes of Avicel, bleached softwood, and bacterial cellulose during enzymatic hydrolysis. 2015. Disponível em: <www.nature.com/scientificreports>. Acesso em: 12 aug. 2019.
KESHK, S. e SAMESHIMA, K. Influence of lignosulfonate on crystal structure and productivity of bacterial cellulose in a static culture. Enzyme and Microbial Technology, v. 40, n. 1, p. 4–8, 2006.
KUMAR GUPTA, Praveen et al. An Update on Overview of Cellulose, Its Structure and Applications. Cellulose [Working Title], 2019.
LAMPUGNANI, Edwin R et al. Cellulose Synthesis-Central Components and Their Evolutionary Relationships. 2019. Disponível em: <https://doi.org/10.1016/j.tplants.2019.02.011>. Acesso em: 12 aug. 2019.
MAEDA, Hideaki et al. Bacterial cellulose/silica hybrid fabricated by mimicking biocomposites. Journal of Materials Science, v. 41, n. 17, p. 5646–5656, Sep. 2006.
MILLER, Gail Lorenz. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Analytical Chemistry, v. 31, n. 3, p. 426–428, Mar. 1959. Disponível em: <http://pubs.acs.org/doi/abs/10.1021/ac60147a030>.
NASCIMENTO, Elígenes Sampaio et al. Mesquite (Prosopis juliflora (Sw.)) Extract is an Alternative Nutrient Source for Bacterial Cellulose Production. Journal of Biobased Materials and Bioenergy, v. 10, n. 8, p. 63–70, 2016.
PECORARO, Édison et al. Bacterial Cellulose from Glucanacetobacter xylinus : Preparation, Properties and Applications. . [S.l: s.n.], 2008. Disponível em: <https://pdf.sciencedirectassets.com/277293/3-s2.0-B9780080453163X00014/3-s2.0-B978008045316300017X/main.pdf?X-Amz-Security-Token=AgoJb3JpZ2luX2VjEGIaCXVzLWVhc3QtMSJHMEUCIHBUDrqltdRYOidhk8sjSzeL1i5IMpw8dy25w5pDqer1AiEAo4AvlAeCDSsv3%2BVdaz%2Bz0rt7orWS98fzv4>. Acesso em: 2 aug. 2019.
SINGHSA, Pratyawadee e NARAIN, Ravin e MANUSPIYA, Hathaikarn. Physical structure variations of bacterial cellulose produced by different Komagataeibacter xylinus strains and carbon sources in static and agitated conditions. Cellulose, v. 25, n. 3, p. 1571–1581, 2018. Disponível em: <https://doi.org/10.1007/s10570-018-1699-1>.
TROVATTI, Eliane et al. Biocellulose membranes as supports for dermal release of lidocaine. Biomacromolecules, v. 12, n. 11, p. 4162–4168, 2011.
TSOUKO, Erminda et al. Bacterial cellulose production from industrial waste and by-product streams. International Journal of Molecular Sciences, v. 16, n. 7, p. 14832–14849, 2015.
UL-ISLAM, Mazhar e KHAN, Taous e KON PARK, Joong. Water holding and release properties of bacterial cellulose obtained by in situ and ex situ modification. Carbohydrate Polymers, METODOLOGIA DE CAPACIDADE DE RETENÇÃO DE ÁGUA, v. 88, p. 596–603, 2012. Disponível em: <https://pdf.sciencedirectassets.com/271345/1-s2.0-S0144861712X00031/1-s2.0-S0144861712000082/main.pdf?x-amz-security-token=AgoJb3JpZ2luX2VjEND%2F%2F%2F%2F%2F%2F%2F%2F%2F%2FwEaCXVzLWVhc3QtMSJIMEYCIQCKL5o%2Blpipxpsn6UBJOE9DP1Zmg9qGU8UM4pahxGTp8QIhANySkSbN0B>. Acesso em: 24 may 2019.
VAZQUEZ, Analía et al. Bacterial Cellulose from Simple and Low Cost Production Media by Gluconacetobacter xylinus. Journal of Polymers and the Environment, v. 21, n. 2, p. 545–554, 2013.
WANG, Jing e TAVAKOLI, Javad e TANG, Youhong. Bacterial cellulose production, properties and applications with different culture methods-A review. Carbohydrate Polymers, v. 219, p. 63–76, 2019. Disponível em: <https://doi.org/10.1016/j.carbpol.2019.05.008>. Acesso em: 12 aug. 2019.
ZHAO, Hongwei et al. Production of bacterial cellulose using polysaccharide fermentation wastewater as inexpensive nutrient sources. Biotechnology and Biotechnological Equipment, v. 32, n. 2, p. 350–356, 2018. Disponível em: <https://doi.org/10.1080/13102818.2017.1418673>.









