Síntese de derivado metálico bioativo do ácido anacárdico extraído do LCC de Anacardium occidentale.
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Barros, A.S. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Santos, L.M.B. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Freitas, L.S. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Montes, R.A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Rodrigues, A.L.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Pinto, C.C.C. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Morais, S.M. (UNIVERSIDADE ESTADUAL DO CEARÁ)
Resumo
Lipídeos fenólicos bioativos, como o ácido anacárdico (AA) podem forma derivados metálicos com grande seletividade, podendo originar compostos mais ativos que o AA. Dessa forma o objetivo do trabalho foi sintetizar e caracterizar o derivado metálico do Estanho com o AA obtido do LCC e avaliar sua toxicidade em Artemia salina, como indicativo de com ação antitumoral. A pureza do AA foi analisada por HPLC. O derivado foi sintetizado em meio básico com Sn2+ e caracterizado por FT-IR e UV-Visível. A toxicidade do complexo em Artemia salina foi determinada. Os espectros confirmam a formação do complexo Sn(AAs)2 que apresentou-se mais tóxico à Artemia salina que o AA. Assim, a síntese de derivados metálicos do AA pode representar uma potencial rota de obtenção de compostos bioativos.
Palavras chaves
ácido anacárdico; Composto bioativo; Estanho
Introdução
A espécie Anacardium occidentale L. conhecida como cajueiro é pertencente à família Anacardiaceae e ao gênero Anacardium, que abrange outras 20 espécies. O cajueiro é cultivado comercialmente e possui as seguintes variedades: anão-precoce e comum. São nativas do Nordeste do Brasil, adaptadas às condições climáticas do semiárido e possuem uma grande importância no cenário socioeconômico, destacando-se nos estados do Ceará, Rio Grande do Norte e Piauí (ARAÚJO, 2015; SUASSUNA et al., 2016). A partir do cajueiro é obtido caju, composto pela castanha e pedúnculo. A castanha, que é o verdadeiro fruto, é composta por uma casca de consistência firme que envolve a amêndoa da castanha do caju (ACC). O líquido da castanha de caju (LCC) obtido da casca dessa castanha é um líquido viscoso escuro e oleoso que forma uma das principais fontes de lipídeos fenólicos não-isoprenóides, dentre eles o ácido anacárdico. O ácido anacárdico são classificados como não-isoprênicos devido apresentarem o acetato como precursor biossintético. Esses componentes apresentam cadeia aromática contendo grupos funcionais como hidroxila (OH) e ácido carboxílico (COOH), e também apresentam cadeia lateral alifática contendo até 3 insaturações, (monoeno, dieno e trieno) (Figura 1), que é responsável pelo seu caráter anfipático e que potencializa suas atividades biollógicas. O LCC apresenta diversas aplicações industriais e devido as propriedades biológicas dos seus constituintes tem despertado grande interesse de pesquisa, sejam elas de natureza química (síntese de derivados) ou de natureza biológica (ação antioxidante, anti-inflamatória, anticolinesterásica e até mesmo anticâncer) (SOARES et al., 2012; MUIANGA et al, 2016; VIEIRA, 2007) Figura 1. Representação da estrutura química dos ácidos anacárdicos do LCC. Do arsenal quimioterápico existente contra o câncer, a maioria (60%) dos fármacos introduzidos nas últimas décadas tem sua origem nos produtos naturais (COSTA- LOTUFO et al., 2010). O avanço da tecnologia, o isolamento de compostos biologicamente ativos de plantas vem fornecendo a base molecular para o desenvolvimento de muitas drogas atualmente em uso clínico, especialmente contra o câncer e doenças infecciosas (MESQUITA et al., 2009). Portanto, metabólitos secundários de plantas e seus derivados sintéticos são importantes fontes de drogas antitumorais. As pesquisas envolvendo compostos fenólicos e saúde tem se destacado nas últimas décadas devido às diversificadas atividades biológicas dessa classe de compostos. A casca da castanha de caju, rica em ácido anacárdico é uma importante fonte desse componente natural tornando assim o LCC um importante recurso precursor de compostos com prováveis atividades biológicas. O ácido anacardico forma derivados de metal lipofilico com um grau de selectividade excepcionalmente elevado. Derivados metálicos do AA nas razões de 1:1 e 2:1 já foram preparados e caracterizados, onde foi determinada a ordem de seletividade entre a primeira linha de metais de transição que foi Fe2+> Cu2+> Zn2+> Ni2+ = Co2+ = Mn2+ para os derivados 2: 1. A síntese de derivados metálicos lineares lipofílicos com alto grau de seletividade (particularmente para os importantes íons de metais de transição, Fe2+ e Cu2+ e, em menor extensão, Zn2+) podem explicar o amplo espectro de atividade biológica para AA como inibidor de enzimas metal dependentes (NAGABHUSHANA et al., 1995; HAMAD e MUBOFU, 2015). Dessa forma o presente trabalho tem como objetivo sintetizar e caracterizar por meio de técnicas espectroscópicas, o derivado metálico do Estanho (Sn) com o ácido anacárdico obtido do líquido da castanha de caju (LCC) de Anacardium occidentale e avaliar sua toxicidade frente ao microcrustáceo Artemia salinacomo indicativo de composto com ação citotóxica.
Material e métodos
Preparação do LCC 3000g da casca da amêndoa do caju foram percoladas com 5L de hexano PA durante sete dias à temperatura ambiente com agitação ocasional e concentrado em evaporador rotativo a sob pressão reduzida Isolamento do ácido anacárdico do LCC Ao LCC extraído foi adicionado Ca(OH)2 em uma mistura de metanol e água com agitação por 3 horas. Em seguida, a mistura foi resfriada e filtrada. O sólido obtido foi lavado com metanol. Os filtrado foi tratado com solução de HCl 50% até pH 1,0 e a mistura de ácidos anacárdicos foi extraída com acetato de etila que foi removido em evaporador rotativo (PARAMASHIVAPPA, 2001). Determinação da pureza da mistura dos ácidos anacardicos por HPLC A pureza e a identificação da mistura de ácidos anacárdicos foi realizada por meio de análises de HPLC equipado com coluna Shim-pack (CLC) ODS GOLD 25 cm, com tempo de corrida de 30 minutos, comprimento de onda do detector de 280 nm, vazão de 1,8 mL/min. A fase móvel foi: 80% acetonitrila e 20% tampão acido acético 1%. Foram injetados 20 μL da amostra e do padrão preparada pela dissolução de 10 mg da mistura de ácidos anacárdicos e do LCC em 10 mL de acetonitrila. Os experimentos foram realizados em triplicata e o LCC foi utilizado como padrão de comparação para as análises. Síntese e caracterização do derivado metálico do ácido anacárdico com Estanho. As sínteses dos complexos inorgânicos foram realizadas conforme Mendes et al. (1990), com a reação do sal SnCl2.2H2O e o ligante (mistura dos ácidos anacárdicos - AAs) em uma proporção estequiométrica de 1:2 (metal:ligante) em etanol, sob agitação constante durante 1 hora, onde o pH da mistura foi alcalinizado para 12 - 13 pela adição de solução aquosa de NaOH 20%. Após, a mistura reacional foi mantida em repouso sob refrigeração por overnight, em seguida filtrada e o precipitado obtido foi lavado com etanol gelado. O composto sintetizado foi analisado por meio de espectroscopia UV-VIS e infravermelho (FT-IR). Toxicidade em Artemia salina Inicialmente foi realizado o preparo da água salina com os sais: NaCl 15,153 g/L; MgCl2 1,398 g/L; Mg(SO4)2 1,888 g/L; CaCl2 0,652 g/L; KCl 0,414 g/L; e NaHCO3 0,116 g/L, de acordo com o procedimento descrito por McLaughlin (1991). Ovos de Artemia salina foram incubados em pequeno tanque particionado contendo a água salina. A iluminação foi fornecida de um lado. Quatro concentrações (1.000, 100, 10 e 1 ppm) das amostras com dimetilsulfóxido 2% foram adicionados à frascos e a cada frasco foram adicionados 10 náuplios. O controle negativo foi preparado com água salina contendo os náuplios e dimetilsulfóxido 2%. Após 24 h de incubação, os sobreviventes foram contados. O experimento foi realizado em triplicata e a CL50 foi determinada conforme metodologia descrita por Minho et al., 2017.
Resultado e discussão
Na extração do Líquido da Castanha de Cajú foram obtidas cerca de 170 g de LCC equivalendo a um rendimento de 5,6%. Valores mais eficientes de extração do LCC foram obtidos por De Matos et al. (2008) em seu trabalho, o que pode ter relação com a forma de extração utilizada, neste caso com Soxhlet.
Na obtenção da mistura dos ácidos anacárdicos foram realizadas sucessivas reprecipitações onde a massa da mistura de ácido anacárdico obtida foi de 25 g. A análise de HPLC é mostrada na figura 2. É possível observar os três principais picos relativos ao ácido anacádico – trieno (pico 1) no tempo de retenção (Rt) de 8.07 min., ao ácido anacádico – dieno (pico 2) no Rt de 11.27 min e ao ácido anacádico – monoeno ( pico 3) no Rt de 17,14 min.
Figura 2. Cromatograma de HPLC da mistura de ácidos anacárdicos extraídos do LCC. Onde: 1-AA trieno, 2-AA dieno e 3-AA monoeno.
O percentual relativo dos ácidos anacárdicos obtido a partir da área dos picos no cromatograma foi de 94,61 ± 0,47%, similar ao percentual obtido por Paramashivappa (2001) que foi de 95%. A proporção entre os ácido anacárdicos foi de 2,9:1,0:1,1 para trieno:dieno e monoeno, conforme observado por Morais et al. (2017) na qual a proporção entre os picos foi de 3:1:1. Dessa forma o principal componente na mistura dos ácidos anacardicos é o AA trieno. A pureza relativa do ácido anacárdico demonstra a eficiência do método de isolamento, bem como a importância das reprecipitações para o processo, sendo determinante ainda para a utilização do ácido anacárdico como ligante na reação de síntese do complexo com o metal.
A partir da reação de síntese do complexo Sn-AAs (1:2) foi obtido um sólido de coloração marrom-escuro com características cristalinas, diferente do ligante (ácido anacádico) que apresenta características graxosas quando sólido, o que representa um indício da efetividade da reação. O rendimento da reação de síntese do complexo foi de 29,32%. Foi observado diferenças na banda de absorção máxima (λmáx) no espectro UV-Visível do complexo em relação ao ligante, como mostrado na tabela 1.
Tabela 1. Absorções máximas no espectro UV-Visível do ligante e do complexo
Composto λmáx.
Ác. Anacárdicos (AAs) 325 nm
Sn-AAs (1:2) 302 nm
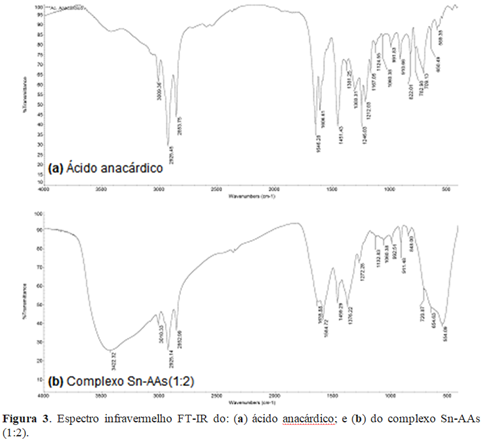
Da mesma forma, foram observadas diferenças nas bandas de infravermelho do complexo em relação ao ligante nos espectros de FT-IR, como mostrado na figura 3. As diferenças nas bandas de estiramento da hidroxila (O-H, 3422 cm-1) e do grupo carboxila (C=O, 1635 cm-1; C-O, 1459 e 1356 cm-1) no complexo, bem como a presença da banda do metal (554 cm-1) comprovam a formação do complexo.
Figura 3. Espectro infravermelho FT-IR do: (a) ácido anacárdico; e (b) do complexo Sn-AAs (1:2).
Hamad e Mubofu (2015) relatam a possibilidade da formação de complexos com metais e ácido anacárdico com diferentes estruturas, em função das proporções estequiométricas entre metal e ligante. Dessa forma a associação do que foi reportado pelos autores anteriormente citados com os resultados observados nos espectros de infravermelho sugerem a formação do complexo Sn(AAs)2, no qual a sua provável estrutura é mostrada na figura 4.
Figura 4. Representação estrutural do complexo Sn(AAs)2
O teste de toxicidade em microcrustáceo Artemia salina é mostrado na tabela 2. É possível observar que a toxicidade do complexo foi pouco superior à do ácido anacárdico. O que pode está relacionado tanto à presença do centro metálico como com a quantidade estequiométrica de ácido anacárdico presente no complexo. Por meio da análise é possível determinar que o complexo formado apresentou bioatividade frente ao microcrustáceo. Morais et al. (2017) relataram a toxicidade de cada ácido anacárdico separadamente em seu trabalho, e o AA trieno foi o mais ativo frente A. salina, apresentando melhores atividades como a inibidora da enzima acetilcolinesterase AChE e a antioxidante. Assim, a toxicidade do composto sintetizado neste trabalho pode está relacionada á presença majoritária do AA trieno no complexo, e pode apontar para a investigação da ação citotóxica do complexo, tornando-o candidato a composto com ação antitumoral, uma vez que o ácido anacárdico é relatado como detentor de ação antitumoral (HAMAD e MUBOFU, 2015)
Tabela 2. Toxicidade em Artemia salina do complexo Sn-AAs(1:2) e do ligante.
Amostra CL50 (µg/mL) CI95% (µg/mL)
Ác. Anacárdicos (AAs) 49,39 28,15 - 84,56
Sn-AAs (1:2) 31,62 14,50 - 68,97
Espectro infravermelho FT-IR do: (a) ácido anacárdico; e (b) do complexo Sn-AAs (1:2).
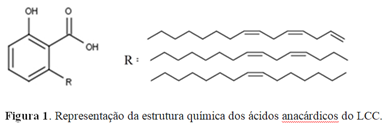
Figura 1. Representação da estrutura química dos ácidos anacárdicos do LCC.
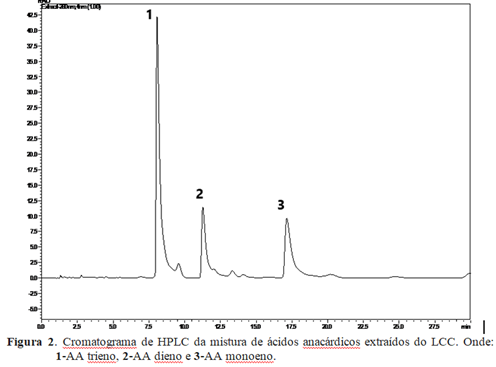
Figura 2. Cromatograma de HPLC da mistura de ácidos anacárdicos extraídos do LCC. Onde: 1-AA trieno, 2-AA dieno e 3-AA monoeno.

Tabela 1. Absorções máximas no espectro UV-Visível do ligante e do complexo
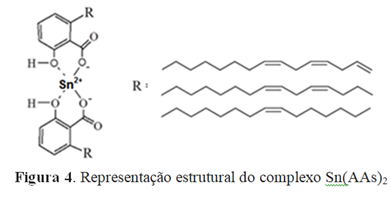
Figura 4. Representação estrutural do complexo Sn(AAs)2
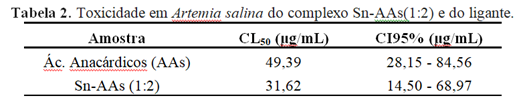
Tabela 2. Toxicidade em Artemia salina do complexo Sn-AAs(1:2) e do ligante.
Conclusões
Dessa forma é possível concluir que o complexo formado entre o estanho (Sn2+) e o ácido anacárdico na proporção 1:2 (metal:ligante) foi sintetizado com sucesso. E que os espectros UV-Visível e de FT-IR confirmam a formação do complexo por meio de quelação formada entre o metal, e a carboxila e hidroxila fenólica de duas moléculas de ácido anacárdico. Formando assim o complexo Sn(AAs)2 que apresentou-se ligeiramente mais tóxico à Artemia salina que o ácido anacárdico, demonstrando assim que a síntese de derivados do ácido anacárdico complexados com metais podem representar uma importante rota de obtenção de compostos bioativos com possível ação citotóxica.
Agradecimentos
À Secretaria de Educação do Governo do Estado do Ceará (SEDUC – CE), à CNPQ e à FUNCAP pelo incentivo à formação e pelas bolsas concedidas.
Referências
ARAÚJO, J. P. P. (E.). Caju: o produtor pergunta, a Embrapa responde. 2. ed. Brasília, DF: Embrapa, 2015. 250 p.
COSTA-LOTUFO, L. V.,MONTENEGRO, R. C., ALVES, A.P.N.N., MADEIRA, S.V.F., PESSOA, C., MORAES, M.E. A., MORAES, M.O. A. Contribuição dos Produtos Naturais como Fonte de Novos Fármacos Anticâncer: Estudos no Laboratório Nacional de Oncologia Experimental da Universidade Federal do Ceará. Revista Virtual de Química, v.1, n.2, p.47-58, 2010.
DE MATOS, J. E. X.; DA SILVA, F. J. A.; VIEIRA, P. B. Solventes para extração do líquido da castanha de caju (LCC) e compatibilidade ambiental. Revista Tecnologia, v. 29, n. 1, 2008.
HAMAD, F.; MUBOFU, E. Potential biological applications of bio-based anacardic acids and their derivatives. International Journal of Molecular Sciences, v. 16, n. 4, p. 8569-8590, 2015.
MCLAUGHLIN, J.L. Crown gall tumors on potato discs and brine shrimp lethality: two simple bioassays for higher plant screening and ractionation. In: Hostettmann, K., Ed. Methods in Plant Biochemistry. London: Academic Press, vol. 6, p.1-36, 1991.









