COMPOSIÇÃO QUÍMICA E ATIVIDADE ANTIFÚNGICA DE EXTRATOS ALCOÓLICOS DE PRÓPOLIS VERDE DA CAATINGA DO NORTE DO CEARÁ.
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Frota, V.M. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; Luz, L.R. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Costa, M.F. (INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA) ; Mendonça, L.S. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; Gomes, L.C.S. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; Fernandes, J.A.B. (INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA) ; Fontenelle, R.O.S. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; dos Santos, H.S. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; Zocolo, G.J. (EMBRAPA AGROINDÚSTRIA TROPICAL) ; Rodrigues, T.H.S. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ)
Resumo
A própolis é uma mistura complexa de substâncias, sendo sua composição química variável de acordo com as características edafoclimáticas da região onde é produzida. O objetivo deste trabalho foi realizar pela primeira vez o estudo sobre a determinação da composição química, rendimentos dos extratos e atividade antifúngica contra cepas de Candida albicans dos extratos de própolis verde do norte do Ceará obtidos com etanol e1 etanol/água (7:3). A variação da composição do solvente influenciou nos rendimentos dos extratos, contudo ambos apresentaram composição química semelhante com predominância de flavonóides. Além disso, os extratos apresentaram importantes resultados de atividade antifúngica frente a C. albicans, o que agrega valor econômico a um novo produto apícola no mercado local.
Palavras chaves
Própolis verde; Flavonóides; Candida albicans
Introdução
A própolis é uma mistura complexa de substâncias de caráter resinoso produzidas pelas abelhas a partir dos exsudatos de plantas para selar frestas na colméia e como barreira contra insetos invasores (AGÜERO et al., 2011). A composição de cada tipo diferente de própolis é dependente de alguns fatores como localização geográfica, biodiversidade local, e condições edafoclimáticas de determinada região (SILVA et al., 2015). A própolis verde brasileira está entre as mais importantes do mundo, sendo exportada para a China, Japão e Alemanha (FERREIRA et al., 2017). Além disso, a própolis é considerada responsável pela baixa incidência de bactérias e fungos na colmeia, atribuído as suas propriedades antimicrobianas, sendo uma das mais investigadas. São relatados alto potencial antibacteriano, antifúngico e antiviral; além de outras atividades biológicas benéficas, como antioxidante, antiinflamatória, antitumoral, hepatoprotetor, imunoestimulante, antimutagênico, dentre outras. Por estas razões ganhou ampla aceitação, e atualmente também é aplicada como constituinte de biocosméticos e produção de alimentos funcionais (ORYAN et al., 2018; ZABAIOU et al., 2017). A composição química da própolis difere significativamente de acordo com sua origem geográfica e botânica, principalmente porque as abelhas coletam as resinas e exsudados das plantas e fontes disponíveis, que variam de região para região de acordo com o clima, o terreno, a disponibilidade de água e outros fatores ambientais (AGÜERO et al., 2011). A heterogeneidade química da própolis é assim facilmente compreensível, pois é uma mistura complexa de compostos derivados de várias plantas e que são processados por enzimas salivares de abelhas. Esta diversidade química traz uma questão crucial de padronização, mesmo que as abelhas, por si só, não mudem seu produto químico e composição (ZABAIOU et al., 2017). Em geral, as inúmeras propriedades da própolis são associadas aos flavonoides, ácidos fenólicos, terpenos e ésteres presentes nessa matriz; sendo atribuída aos flavonoides a maioria das atividades biológicas. A literatura sugere um mecanismo de ação baseado na inibição da síntese do DNA. Embora existam poucos estudos em relação aos mecanismos de ação antimicrobiana dos flavonoides, esses compostos também podem atuar na inibição de diferentes componentes e funções das células microbianas (ORYAN et al., 2018). Muitos trabalhos relatam atividade antimicrobiana, especialmente atividade antifúngica para a própolis, frente às leveduras do gênero Candida spp., e aos dermatófitos do gênero Trichophyton spp. (FREIRES et al. 2016). Nesse sentido, a presença de compostos da classe dos flavonoides na composição de várias amostras de própolis, podem explicar suas promissoras propriedades antifúngicas. Além disso, a toxicidade de determinadas substâncias antifúngicas convencionais e o aumento da resistência microbiana a essas drogas têm incentivado na busca de novas moléculas químicas, especialmente no ambiente farmacológico (FREIRES et al. 2016). Nessa perspectiva, o presente trabalho busca a determinação do rendimento e composição química polifenólica via LC-MS dos extratos alcoólicos da própolis verde da Caatinga proveniente da região norte do Ceará, além da avaliação do potencial antifúngico contra cepas de Candida albicans.
Material e métodos
Coleta da própolis: A própolis verde da Caatinga produzida por abelhas Apis mellifera é proveniente do apiário instalado na Fazenda São Vicente, distrito Caioca (Sobral-CE). As amostras foram coletadas entre 7 a 15 dias depois da exposição dos coletores no período chuvoso da região. Obtenção dos extratos: Uma massa de 3 g de própolis moída foi submetida à extração com etanol (100%) e etanol (70%) na proporção de 1:10 por maceração a frio, em triplicata. Após a obtenção dos extratos, a eliminação do solvente (etanol) ocorreu por evaporação a 40°C, sendo a água residual eliminada por liofilização dos extratos. Os rendimentos dos extratos nos diferentes solventes foram calculados segundo a equação a abaixo: Rendimento (%)=(massa extrato (g))/(massa inicial de própolis (g))×100 Após a obtenção dos extratos secos, os mesmos foram estocados sob refrigeração e ao abrigo da luz para as posteriores análises de determinação da composição química e ensaios biológicos. Composição química via LC-MS: Inicialmente, os extratos foram submetidos a um procedimento de limpeza utilizando o cartucho SPE (C-18) e eluição com metanol, seguida da filtração em filtro de PTFE de 0,22 um. O perfil cromatográfico foi obtido em sistema de cromatografia LC-MS de alta resolução UPLC-ESI-QTof-MS/MS (Waters, Milford, MA, EUA). Para separação dos constituintes químicos dos extratos, foi utilizada uma coluna cromatográfica analítica de fase estacionária C-18 (1,7 μm; 250 × 2,1 mm) operando na temperatura de 40 °C. Como fase móvel, utilizou-se uma combinação de 0,1% de solução aquosa de ácido fórmico e metanol a 0,1% de ácido fórmico no fluxo de 0,4 mL/min. As corridas cromatográficas foram conduzidas em modo gradiente com variação de 5 à 95% do metanol, e volume de injeção de 5 μL. O analisador de massas foi operado no modo de ionização negativo na faixa de massas de 50 e 1180 Da (SOUSA et al., 2016). Atividade antifúngica: Para os ensaios biológicos, as amostras foram preparadas por diluição em óleo mineral a 10% de DMSO na concentração de 10 mg/mL. Para a determinação da Concentração Inibitória Mínima (CIM) e Concentração Fungicida Mínima (CFM) empregou-se o método de microdiluição em caldo em placas de poliestireno de 96 poços, contendo 100 μL do meio RPMI, mais 100 μL de suspensão microbiana, e o extrato etanólico de própolis em um intervalo de concentração de 2,5 a 0,004 mg/mL (CLSI M27-A3, 2008). Foram conduzidos o controle negativo se adição de extratos de própolis, o positivo pelo uso de anfotericina e o controle de contaminação do meio. As culturas foram incubadas a 37°C/48h, e em seguida realizou-se a leitura dos resultados e determinação da (CIM) e (CFM).
Resultado e discussão
Os resultados dos rendimentos dos extratos etanólicos (100% de
etanol) e hidroalcoólicos (70% de etanol) foram determinados em termos de
porcentagem da massa original da própolis in natura, sendo o maior
rendimento (70,59 ± 8,96%) obtido no extrato etanólico, seguido do
hidroalcoólico (36,08 ± 3,03%). Além disso, verifica-se que os valores
obtidos estão de acordo com os valores de referência da legislação nacional
vigente que estabelece valor mínimo de 35% (BRASIL et al,. 2001). Em
amostras de própolis também de Apis mellifera do Sul e do Nordeste, foram
obtidos 58,46% e 42,62% de rendimento para extratos hidroalcoólicos (FREIRES
et al., 2016), resultados pouco superiores aos obtidos neste trabalho.
A investigação do potencial da própolis verde da região norte do
Ceará foi conduzida inicialmente pela determinação da composição química
polifenólica (ácidos fenólicos e flavonóides) pela análise dos extratos em
sistema UPLC-MS/MS (Tabelas 1 e 2) que tem sido extensivamente caracterizado
por vários estudos recentes (UZEL et al., 2005; XAVIER et al., 2015).
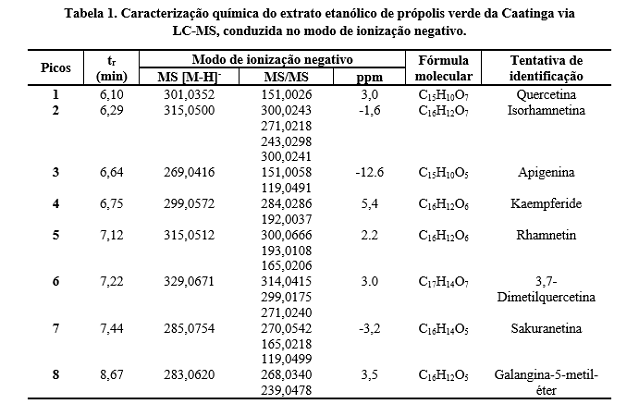
Na Tabela 1, constam os resultados da composição química do extrato
etanólico de própolis verde da Caatinga. Observa-se uma composição rica em
flavonóides como quercetina, isorhamnetina (quercetina metilada), 3,7-
dimetilquercetina, e galangina-5-metil-éter. Também foram identificados
flavonóis metilados, kaempferide e rhamnetin, flavona (apigenina) e uma
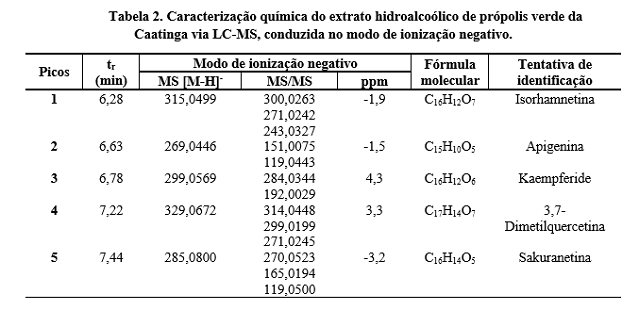
flavanona, sakuranetina. Na Tabela 2, observa-se composição química bastante
similar à Tabela 1, sendo o quantitativo de flavonóides identificados no
extrato hidroalcoólico pouco inferior aos etanólico.
Evidências químicas sugerem que Baccharis dracunculifolia é a
principal fonte de resina para própolis verde do sudeste, no entanto, fortes
indícios com base em observações e na literatura, indicam que a própolis
verde da Caatinga, pode ter origem botânica de Mimosa hostilis, popularmente
conhecida como jurema-preta (FERREIRA et al., 2017).
Embora seja comum a detecção de ácidos fenólicos, flavonóides e
fenilpropanóides em extratos de própolis (ORYAN et al., 2018), somente os
flavonóides foram detectados na própolis verde da Caatinga (Tabelas 1 e 2).
De uma maneira geral, na própolis do Brasil já foram relatados a presença de
quercetina e apigenina glicosiladas e/ou metiladas e isorhamnetina, em
amostras do nordeste (Piauí e Bahia), centro-oeste (Goiás) e sudeste (Minas
Gerais) (RIGHI et al., 2013).
Em estudos recentes de própolis do nordeste (Rio Grande do Norte) do
Brasil (FERREIRA et al., 2017), foram detectados flavonoides metilados
derivados de quercetina, kaempferol e isorhaminetina, resultado similar ao
deste estudo. Além isso, na própolis verde (Minas Gerais) foram detectados
os seguintes flavonoides, isorhamnetina, kaempferide e sakuranetina,
compostos também identificados na própolis verde da Caatinga no norte do
Ceará (SZLISZKA et al., 2013).
Os flavonóides são antioxidantes, depuradores de radicais livres, e
quelantes de metais, com capacidade de inibir a peroxidação lipídica. Por
esta razão, são frequentemente utilizados como os principais índices na
avaliação pureza e composição da própolis. São os principais marcadores
químicos encontrados na própolis e a literatura já relata sua relação com
diversas atividades biológicas, em especial as antimicrobianas (ORYAN et
al., 2018). Mais de 90% das infecções invasivas por Candida podem ser
atribuídas a cinco espécies: C. albicans, C. glabrata, C. parapsilosis, C.
tropicalis, C. krusei. e C. albicans, sendo esta, a espécie a mais
investigada (UZEL, et al., 2005). Nesse sentido, avaliou-se o potencial
antifúngico dos extratos etanólicos e hidroalcoólicos de própolis verde da
Caatinga frente a cepas de C. albicans (LABMIC 0101 e LABMIC 0102).
Os resultados mostraram que as leveduras testadas foram igualmente
inibidas por ambos os extratos de própolis com valores de CIM de 0,039 ug/mL
e CFM de 0,078 ug/mL para os dois extratos alcoólicos. Isso demonstra que
possivelmente o solvente não influenciou nas propriedades antifúngicas da
própolis embora a composição tenha sido pouco influenciada. Nos estudos de
FREIRES et al. (2016), os autores testaram duas própolis do Brasil (sudeste
e nordeste) e obtiveram valores de CIM na faixa de 2,0 – 4,0 ug/mL e CFM
entre 250 – 500 ug/mL contra C. albicans CBS 562, resultados bem superiores
ao deste trabalho.
Os flavonóides são responsáveis pela maioria das atividades
biológicas dessa matriz. Essas moléculas apresentam um mecanismo de ação
antimicrobiana atribuído ao anel B dos flavonóides que é capaz de ligar-se
via pontes de hidrogênio com as bases nitrogenadas dos ácidos nucléicos
impedindo sua replicação (ORYAN et al., 2018). Além disso, existem trabalhos
(PIPPI et al., 2015; ORYAN et al., 2018) que sugerem possíveis efeitos
sinérgicos entre flavonóides e algumas drogas (antibióticos, antifúngicos,
anti-inflamatórios) potencializando o efeito do medicamento, e ampliando as
possibilidades de uso da própolis.
Conclusões
Os resultados obtidos neste trabalho permitiram a determinação da composição química e propriedades biológicas da própolis verde da Caatinga no norte do Ceará. Ao se variar a composição do solvente de extração, verificou-se uma diferença expressiva valores de rendimentos obtidos. Por outro lado, a variação do solvente pouco influenciou na composição química dos extratos de própolis obtidos. Os flavonoides kaempferide, quercetin, e seus derivados metilados identificados em ambos os extratos de própolis verde da Caatinga atuam como fortes responsáveis para a maioria das atividades biológicas. Levando-se em consideração os resultados da atividade antifúngica, percebe-se que os extratos alcoólicos de própolis verde apresentaram resultados satisfatórios de CIM e CFM frente às cepas de C. albicans testadas. Por fim, este estudo além de agregar valor adicional à própolis potencializa um produto local com perspectivas promissoras de aplicações terapêuticas.
Agradecimentos
FUNCAP, FINEP, CNPQ e Embrapa Agroindústria Tropical (Laboratório Multiusuário de Química de Produtos Naturais - LMQPN).
Referências
AGÜERO, M. B.; SVETAZ, L.; SÁNCHEZ, M.; LUNA, L.; LIMA, B.; LÓPEZ, M. L.; ZACCHINO, S.; PALERMO, J.; WUNDERLIN, D.; FERESIN, G. E.; TAPIA, A. Argentinean Andean propolis associated with the medicinal plant Larrea nitida Cav.(Zygophyllaceae). HPLC–MS and GC–MS characterization and antifungal activity. Food and chemical toxicology, v. 49, n. 9, p. 1970-1978, 2011.
BRASIL. Ministério da Agricultura. Secretaria de Defesa Agropecuária. Departamento de Inspeção de Produtos de Origem Animal – DIPOA. Instrução Normativa Nº 3, de 19 de Janeiro de 2001. Anexo VI - Regulamento técnico para fixação de identidade e qualidade de própolis. Brasília: Ministério da Agricultura; 2001. D.O.U. de 23/01/2001. Seção I, p. 18-23.
CLINICAL AND LABORATORY STANDARDS INSTITUTE (CLSI). Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts (Approved Standard. Document M27-A3. CLSI). Clinical and Laboratory Standards Institute. v. 28, n. 14, 3ª ed., Wayne, 2008.
FERREIRA, J.M.; FERNANDES-SILVA, C.C.; SALATINO, A.; NEGRI, G.; MENSAGEM, D. New propolis type from north‐east Brazil: chemical composition, antioxidant activity and botanical origin. Journal of the Science of Food and Agriculture, v. 97, n. 11, p. 3552-3558, 2017.
FREIRES, I. A.; QUEIROZ, V. C. P. P.; FURLETTI, V. F.; IKEGAKI, M.; DE ALENCAR, S. M.; DUARTE, M. C. T.; ROSALEN, P. L. Chemical composition and antifungal potential of Brazilian propolis against Candida spp. Journal de mycologie medicale, v. 26, n. 2, p. 122-132, 2016.
ORYAN A.; ALEMZADEH E.; MOSHIRI A. Potential role of propolis in wound healing: Biological properties and therapeutic activities. Biomedicine & Pharmacotherapy. v. 98, p. 469 – 483, 2018.
PIPPI B.; LANA A.; MORAES R.; GÜEZ C.; MACHADO M.; OLIVEIRA L.; LINO VON POSER G.; FUENTEFRIA A. M. In vitro evaluation of the acquisition of resistance, antifungal activity and synergism of Brazilian red propolis with antifungal drugs on Candida spp. J Appl Microbiol. v. 118, n. 4, p. 839 – 850, 2015.
RIGHI, A. A.; NEGRI, G.; SALATINO, A. Comparative chemistry of propolis from eight brazilian localities. Evidence-Based Complementary and Alternative Medicine, v. 2013, 2013.
SILVA R. O.; ANDRADE V. M.; BULLE REGO E. S.; DORIA G. A. A.; LIMA B. S.; SILVA F. A.; ARAÚJO A. A. S. Acute and sub-acute oral toxicity of Brazilian red propolis in rats. J Ethnopharmacol. v. 170, p. 66 – 71, 2015.
SOUSA A. D; MAIA A. I. V.; RODRIGUES T. H. S.; CANUTO K. M.; RIBEIRO P. R.; PEREIRA R. C. A.;VIEIRA R. F; BRITO E. S. Ultrasound-assisted and pressurized liquid extraction of phenoliccompounds from Phyllanthus amarus and its composition evaluation by UPLC-QTOF. Industrial Crops and Products. v. 79, p. 91–103, 2016.
SZLISZKA, E.; KUCHARSKA, A. Z.; SOKÓŁ-ŁĘTOWSKA, A.; MERTAS, A.; CZUBA, Z. P.; KRÓL, W. Chemical composition and anti-inflammatory effect of ethanolic extract of Brazilian green propolis on activated J774A. 1 macrophages. Evidence-Based Complementary and Alternative Medicine, v. 2013, 2013.
TORRES, A. R.; DOS SANTOS, A. R. S. Caracterização química e avaliação das atividades antimicrobiana, antinociceptiva e anti-inflamatória do própolis da Melipona quadrifasciata quadrifasciata. 2018.
UZEL, A.; ÖNÇAĞ, Ö.; ÇOĞULU, D.; GENÇAY, Ö. Chemical compositions and antimicrobial activities of four different Anatolian propolis samples. Microbiological research, v. 160, n. 2, p. 189-195, 2005.
XAVIER, J. DE A. GOULART, M. O. F.; VALENTIM, I. B. Avaliação da capacidade antioxidante e perfil químico de própolis do nordeste da Bahia. 2015.
ZABAIOU, N.; FOUACHE, A.; TROUSSON, A.; BARON, S.; ZELLAGUI, A.; LAHOUEL, M.; LOBACCAROA, J. A. Biological properties of propolis extracts: Something new from an ancient product. Chemistry and physics of lipids, v. 207, p. 214-222, 2017.









