Efeito de extratos de própolis apícola amazônica em Ralstonia solanacearum no estado do Pará, Brasil
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Pereira, D.S. (EMBRAPA AMAZONIA ORIENTAL) ; Oliveira, M.S. (UNIVERSIDADE FEDERAL DO PARÁ) ; Pereira, N.S. (IFCE) ; Coelho, W.A.C. (UNIVERSIDADE FEDERAL RURAL DO SEMIÁRIDO) ; Maracajá, P.B. (UNIVERSIDADE FEDERAL DE CAMPINA GRANDE) ; Modesto, S.C. (UNIVERSIDADE FEDERAL DO PARA) ; Freitas, C.I.A. (UNIVERSIDADE FEDERAL RURAL DO SEMIÁRIDO) ; Freitas, M.O. (UNIVERSIDADE FEDERAL RURAL DO SEMIÁRIDO) ; Souza-filho, A.P.S. (EMBRAPA AMAZONIA ORIENTAL) ; Ishida, A.K. (EMBRAPA AMAZONIA ORIENTAL)
Resumo
A murcha bacteriana causada por Ralstonia solanacearum tem sido um problema sério para a cultura do tomateiro na Amazônia brasileira, especialmente no estado do Pará. Uma vez estabelecida no hospedeiro, a bactéria multiplica-se rapidamente nos tecidos da planta, causando desorganização do tecido vascular, resultando em perdas de turgescência e morte. A própolis de Apis mellifera L. tem-se mostrado um importante antibiótico natural de uso no controle de patógenos de plantas e animais. O presente estudo verificou a atividade antibiótica de extratos da própolis de A. mellifera obtidas de diferentes solventes, oriundas de três apiários distribuídos na região nordeste do estado do Pará, sobre Ralstonia solanacearum.
Palavras chaves
Apicultura; Tomaticultura; Murcha bacteriana
Introdução
Na Amazônia, as pesquisas envolvendo substâncias naturais de origem animal e vegetal para o controle de fitopatógenos encontram-se em sua grande maioria, em fase de prospecção, com poucos estudos conduzidos em condições de casa-de- vegetação e de campo (BENCHIMOL, SILVA, VERZIGNASSI, 2008). Buriol et al. (2009) afirmaram que a própolis apresenta atividade antibiótica independente da sua origem, devido aos efeitos bactericida e fungicida imprescindíveis para preservar a vida na colmeia. A atividade biológica da própolis é atribuída às substâncias derivadas das plantas coletadas para a sua produção. O extrato de própolis possui atividade antibacteriana especialmente contra bactérias Gram-positivas (MIRZOEVA et al., 1997). Esta atividade é relacionada à presença de flavonoides, ácidos aromáticos e ésteres presentes na resina (BURDOCK, 1998). Trabalhos realizados com amostras de própolis vermelha proveniente do litoral norte do estado de Sergipe apresentaram ação antibacteriana (SIQUEIRA, 2008__a). R. solanacearum é o agente causal da murcha bacteriana, doença responsável por grandes prejuízos em solanáceas e recentemente também na eucaliptocultura, onde no período de abril a setembro de 2005, os danos causados por R. solanacearum em viveiros nos estados do Espírito Santo, Bahia, Maranhão, Minas Gerais e Pará resultaram no descarte de 11 milhões de mudas, com prejuízo estimado em aproximadamente seis milhões de reais (ALFENAS et al., 2006). O presente trabalho tem como objetivo avaliar a atividade antibiótica de extratos da própolis de A. mellifera obtidas de diferentes solventes, oriundas de três apiários distribuídos na região nordeste do estado do Pará, sobre Ralstonia solanacearum.
Material e métodos
Foram coletadas própolis de abelhas Apis mellifera (africanizadas) no estado do Pará, Brasil. Os apiários de onde as própolis foram coletadas estavam localizados nos municípios de Santa Izabel-PA, e Curuçá-PA . Foram coletadas 300 gramas de própolis em cada apiário. Foi realizada extração sequencial com solventes em ordem crescente de polaridade: hexano; acetado de etila; álcool etílico. A análise da atividade antibacteriana foi realizada por meio da determinação da Concentração Inibitória Mínima (CIM) em placa. Para avaliar o efeito in vitro dos extratos de própolis sobre crescimento bacteriano, os extratos foram incorporados ao meio de cultura 523 (KADO; HESKETT, 1970) na concentração de 0,5%. Foram utilizadas cinco repetições para cada tratamento, onde cada placa representou uma repetição. Os extratos foram adicionados ao meio de cultura fundente, homogeneizando-se cuidadosamente sob movimentos rotatórios, distribuindo-se em placas de Petri, em volume de 20 ml. Após a solidificação do meio, foram depositadas alíquotas de 100 μL da suspensão bacteriana na concentração de 109Unidade Formadora de Colônias (UFC) e espalhadas com alça de Drigalski, previamente esterilizada por flambagem. Como testemunha utilizou-se o meio de cultura sem adição de nenhum extrato. As culturas foram incubadas em uma temperatura de 28 ± 2 ºC. O crescimento da bactéria foi avaliado 24 h após o cultivo através da contagem de UFC das placas. Os dados foram analisados através da analise da variância (ANOVA), com comparação de médias a posteriori pelo teste Tukey (P<0,05). O delineamento experimental foi inteiramente casualizado (DIC) e as análises de variância para as características avaliadas foram realizadas através do aplicativo software SISVAR 3.01 (FERREIRA, 2000).
Resultado e discussão
A própolis foi extraída sequencialmente com três solventes de polaridade
crescente: Hexano; Acetato de Etila e Álcool Etílico 80%. O solvente foi
removido em evaporador rotativo sob pressão reduzida obtendo-se os extratos de
própolis, no ponto de pasta, referente a cada um dos solventes que foram pesados
para verificação do rendimento individual do método de extração.
Foram obtidos os extratos hexânicos, acetato de etila e etanólico 80% para cada
uma das amostras de própolis. Os testes foram realizados em três concentrações
crescentes de 0,2; 0,3; e 0,4% (p/v) dos respectivos extratos.
Identificou-se o comportamento do poder inibitório dos extratos de própolis
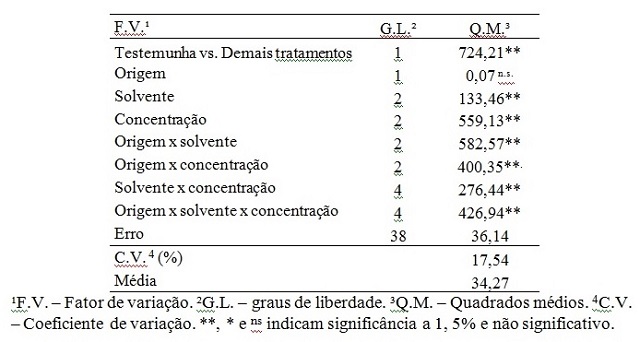
sobre a R. solanacearum (TABELA 2). Verificou-se efeito significativo ao nível
de 1% de probabilidade para a variável UFC. Houve diferença entre os efeitos do
poder inibitório para pelo menos um dos tratamentos em cada uma das bactérias
estudadas (TABELA 1 e 2).
Para avaliar a eficiência de cada um dos tratamentos, realizou-se o teste de
médias de Tukey ao nível de 1% de probabilidade para a variável UFC, para
identificar a média do tratamento, ou o grupo de médias dos tratamentos,
distintas e/ou similares estatisticamente (TABELA 2). A análise de variância
mostrou efeito significativo para o contraste entre a testemunha e os
tratamentos aplicados (TABELA 1).
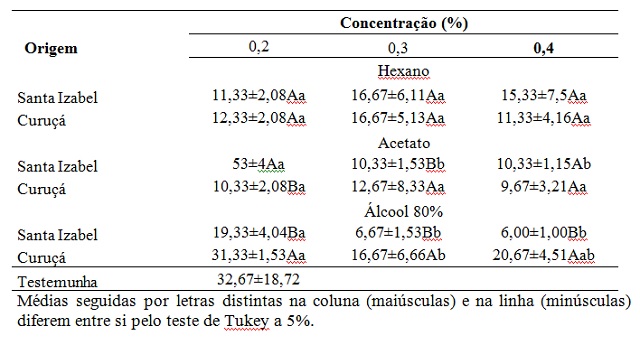
Para o hexano não houve diferença entre as concentrações utilizadas, enquanto
que para acetato e o álcool 80% as concentrações de 0,3 e 0,4% proporcionaram
menor número de UFC. Quanto a origem das própolis, para o álcool 80% a própolis
proveniente de Santa Iazabel proporcionou menor crescimento do patógeno (TABELA
2).
ANOVA para Unidade Formadora de Colônias (UFC) de Ralstonia solanacearum sob efeito de extratos de própolis apícola em Belém-PA.
Crescimento de Ralstonia solanacearum (UFC) (média ± desvio padrão) sob efeito de extratos de própolis apícola no Pará.
Conclusões
Verificou-se que a própolis oriunda do apiário em Curuçá-PA apresentou a taxa percentual inibitória estatisticamente superiores. - Os resultados apontaram efeito inibitório em todas as polaridades de obtenção dos bioativos, no entanto, opta-se por indicar o uso do solvente álcool etílico, por ser mais barato e mais acessível ao produtor.
Agradecimentos
Ao projeto fundo Amazônia pelo financiamento de minha pesquisa, agradecer ao meu professor orientador Daniel Santiago, por todo apoio e paciência ao longo da elaboração do meu projeto e também a Embrapa Amazônia Oriental.
Referências
ALFENAS, A. C.; MAFIA, R. G.; SARTÓRIO, R. C.; BINOTI, D. H. B.; SILVA, R. R.; LAU, D. & VANETTI, A. Ralstonia solanacearum em viveiros clonais de eucalipto no Brasil. Fitopatologia Brasileira, v. 31, n. 4, p. 357-366, 2006.
BENCHIMOL, R.L.; SILVA, C.M.; VERZIGNASSI, J.R.. Utilização de Substâncias Naturais para o Controle de Doenças de Plantas na Região Amazônica. Belém, PA: Embrapa Amazônia Oriental, 27p., 2008.
BURDOCK, G. A.. Review of the biological properties and toxicity of bee propolis (propolis). Food and Chemical Toxicology. 36, 347-363. 1998.
BURIOL, L.; FINGER, D.; SCHMIDT, E.M.; SANTOS, M.T.; ROSA, M.R.; QUINÁIA, S.P.; TORRES, Y.R.; SANTA, H.S.D.; PESSOA,C.; MORAES,M.O.; COSTA-LOTUFO, L.V.; FERREIRA, P.M.P.; SAWAYA, A.C.H.F.; EBERLIN, M.N. Composição química e atividade biológica de extrato oleoso de própolis: uma alternativa ao extrato etanólico. Quimica Nova. 32(2), 296-302. 2009.
FERREIRA, D. F. Análise estatística por meio do SISVAR (Sistema para Análise de variância) para Windows versão 4.0. In: Reunião Anual da Região Brasileira da Sociedade Internacional de Biometria, 45, 2000, Anais. São Carlos: UFSCar, p.255-258, 2000.
KADO, C. I.; HESKETT, M. G. Selective media for isolation of Agrobacterium, Corynebacterium, Erwinia, Pseudomonas and Xanthomonas. Phytopathology, St. Paul, v. 60, n. 6, p. 969-976, 1970.
MIRZOEVA, O.K.; GRISHANIN, R.N.; CALDER, P.C. Antimicrobial action of propolis and some of its components: the effects on growth, membrane potencial and motility of bacteria. Microbiology Research, v.152, n.3, p.239-246, 1997.
SIQUEIRA, A.L. Estudo da ação antibacteriana do extrato hidroalcoólico de própolis vermelha sobre Enterococcus faecalis– Dissertação de mestrado, Universidade Tiradentes, Aracaju, SE, Brasil, 2008.









