AVALIAÇÃO DO POTENCIAL DO PERMEADO DE CAJU COMO MEIO DE CULTIVO ALTERNATIVO PARA A PRODUÇÃO DE CELULOSE BACTERIANA
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Barros, M.O. (UFC) ; Nascimento, E.S. (UFC) ; Lima, H.L.S. (UFC) ; Andrade, F.K. (UFC) ; Almeida, J.S. (UFC) ; Abreu, F.A.P. (EMBRAPA AGROINDÚSTRIA TROPICAL) ; Borges, M.F. (EMBRAPA AGROINDÚSTRIA TROPICAL) ; Brígida, A.I.S. (EMBRAPA AGROINDÚSTRIA TROPICAL) ; Rosa, M.F. (EMBRAPA AGROINDÚSTRIA TROPICAL)
Resumo
O permeado de caju (PC) foi avaliado como meio de cultura alternativo para síntese de celulose bacteriana (CB). A produção de CB por K. xylinus ATCC 53582 em permeado de caju foi avaliada em três concentrações (40, 50 e 100%(v/v)) e o meio sintético HS foi utilizado como meio padrão. As CBs de PC e HS foram caracterizadas por TGA, DRX, FTIR. O PC se mostrou um meio de cultura promissor com boa produção (2,4-3,5 g/L) e cristalinidade (74-85%), apresentando propriedades típicas de CB.
Palavras chaves
celulose bacteriana; caju; biopolímero
Introdução
O aumento do interesse por polímeros biodegradáveis vem estimulando estudos que busquem fontes renováveis como matéria-prima para a produção destes materiais, almejando o desenvolvimento de produtos com um máximo de eficiência e evitando ao máximo o impacto ambiental causado pelo processo. Dentre esses polímeros com alto potencial está a celulose (NASCIMENTO et al., 2016). Apesar de plantas serem mundialmente conhecidas como os principais produtores de celulose, polímero mais abundante na natureza, algumas bactérias também são capazes de produzi-la através da fermentação de meios ricos em sacarídeos, sendo denominada celulose bacteriana (CB) (CASTRO et al., 2011). CB é um polímero natural nanoestruturado produzido por diversas espécies de bactérias pertencentes aos gêneros a Aerobacter, Agrobacterium, Rhizobium, Gluconacetobacter (atualmente Komagataeibacter), Acetobacter, Sarcina and Pseudomonas (ZHAO et al., 2018). Assim como a celulose vegetal, a composição química da CB é formada por moléculas de glicose unidas por ligações glicosídicas entre os carbonos C1 e C4. Entretanto, as propriedades físico-químicas e mecânicas da CB se mostram superiores a celulose vegetal devido a sua estrutura altamente organizada composta por fibras nanométricas em largura (1 – 5nm). CB se caracteriza por apresentar maior cristalinidade, maior capacidade absorção de água e maior resistência a tensão quando comparada a celulose vegetal, além de biocompatibilidade (UL-ISLAM et al., 2012). Essas propriedades conferem a esse material um grande leque de aplicações em diversas áreas (biomedicina, indústria têxtil, indústria de papel, indústria alimentícia, membranas acústicas etc.) (CAI ZHIJIANG, 2011; CHEN et al., 2010; KESHK, CAI et al., 2014). Porém, um fator que reduz a viabilidade da aplicação desse material na indústria é o elevado custo dos meios de cultura que são utilizados para produzir esse material. Os componentes nutricionais em sua forma pura utilizados na produção de CB com meios sintéticos apresentam um custo elevado. Uma alternativa para diminuir esse custo é o desenvolvimento de meios de cultura alternativos com fontes de carbono e outros nutrientes capazes de apresentar uma produção similar ou superior aos meios sintéticos (TSOUKO et al., 2015). A utilização de vários tipos de fontes agroindustriais na síntese de CB tem sido estudada como, por exemplo, sucos de frutas, água de coco, líquido do sisal, extrato de algaroba, entre outros (KUROSUMI et al., 2009; LIMA et al., 2017; LIN et al., 2014; NASCIMENTO et al., 2016). O permeado de caju (PC) é um resíduo obtido no processo de extração do corante amarelo de caju e atualmente não tem indicação de uso. Análises preliminares mostraram que este apresenta razoável teor de açúcar, além de outros nutrientes. Neste cenário, o presente trabalho teve como objetivo investigar o potencial de bioconversão do permeado de caju em celulose bacteriana por meio de fermentação em cultivo estático da bactéria Komagateibacter xylinus ATCC 53582.
Material e métodos
O PC foi caracterizado quanto a concentração de açúcares redutores e totais, teor de nitrogênio, pH e acidez total titulável. Os açúcares redutores e totais foram quantificados pelo método do ácido dinitrossalicílico (MILLER, 1959) e qualificados por meio de cromatografia líquida de alta eficiência (HPLC). O teor de nitrogênio foi determinado em analisador de carbono orgânico total elementar (Shimadzu, TOC). A acidez foi determinada pelo método de acidez total titulável do manual de métodos de análises de bebidas e vinagres (MAPA, 1985). A produção de CB por K. xylinus ATCC 53582 em permeado de caju foi avaliada em três concentrações (40, 50 e 100%(v/v)) e o meio sintético HS (SCHRAMM e HESTRIN, 1954) foi utilizado como meio padrão. As películas de CB foram produzidas pela bactéria K. xylinus ATCC 53582 a partir de inóculo fermentado por cultivo estático em caldo HS estéril (48 h /30 °C). Para a produção das películas de CB, 3% (v/v) do inóculo foi adicionado a 70 mL de cada meio e fermentado por 10 dias a 30 °C. Após a fermentação, as CB’s foram lavadas por 1 hora com água a 100 °C, seguidas de sucessivas lavagens com solução de NaOH 2% (m/v) a 80 °C até completa remoção do meio de cultura. Em seguida, as películas de CB foram submetidas a lavagens em água corrente até pH neutro, finalizando com uma lavagem em água destilada. As análises de produção e umidade foram realizadas, em triplicata, seguindo as equações 1 e 2. P(g/L) = (ms/vm)*1000 (1) U(%) = ((mu-ms)/mu)*100 (2) Onde, ms é a massa de CB seca, obtida por secagem em balança de infravermelho à 170 °C, mu é a massa de CB úmida e vm é a quantidade de meio de cultura utilizado (70 mL). As películas restantes foram congeladas (-80 °C), liofilizadas, moídas e submetidas as caracterizações. As análises de DRX foram realizadas com tubo de Cu em 40 kV e 40 mA na escala 2θ, intervalo angular de 3° a 50° e velocidade de varredura de 0,5°/min. O índice de cristalinidade (IC) foi estimado pelo método descrito por Segal et al. (1957) utilizando a equação 3:
Resultado e discussão
Inicialmente, realizou-se uma caracterização do permeado de caju, visando
identificar os tipos de açúcares presentes, a quantidade de nitrogênio total e o
teor de ácido cítrico. O PC apresentou uma concentração de açúcares totais
(glicose e frutose) igual a 57,8 g/L, que são monossacarídeos facilmente
metabolizados pelas bactérias e facilitam o processo fermentativo. O teor de
nitrogênio foi de 1,9 g/L, considerado alto quando comparado ao teor obtido com
sucos de frutas, como o suco do próprio caju. Isso se deve ao fato do PC ser
obtido a partir das fibras do caju que possuem maior quantidade de compostos
nitrogenados que o suco (KUROSUMI et al., 2009; LIMA et al., 2017). A
concentração de ácido cítrico presente no PC é igual a 1,1 g/L, quantidade
inferior ao meio HS e o pH do PC encontra-se dentro da faixa de pH (4,5 – 5)
ótima para esse tipo de fermentação (CARREIRA et al., 2011; HESTRIN e SCHRAMM,
1954). A figura 1 contém os resultados de produção de CB (g/L), rendimento,
índice de cristalinidade (IC), umidade, tamanho do cristalito e razão de celulose
Iα e Iβ para todos os meios utilizados na fermentação.
Figura 1 – Produção (g/L), Rendimento (YCB/S), Umidade (%), Índice de
Cristalinidade (%), tamanho do cristalito (nm) e razão de celulose α e β das
películas de celulose bacteriana obtidas.
Observa-se um aumento linear na produção de CB com o aumento da concentração de
açúcares. A quantidade de CB (g/L) foi maior com o PC100 (3,5 g/L), valor que
corresponde a, aproximadamente, 63% da produção obtida com o meio sintético HS
(5,5 g/L). A quantidade de CB obtida com o meio PC 100 foi superior a valores
obtidos na literatura para glicerol bruto e meio a base de glicose (ADNAN et al.,
2015; SON et al., 2003). A produção elevada em HS comparada ao PC100, que possui
mais açúcares e nitrogênio, leva a crer que a fermentação é mais eficiente quando
utilizado apenas glicose ao invés de uma blenda de açúcares. A relação C:N, o
tipo de nitrogênio disponível, bem como resíduos de impurezas do fruto de caju
que resistiram à sanitização e esterilização também podem ser fatores que
inibiram a fermentação. Entretanto, a menor produção obtida (PC40, 2,36 g/L)
ainda se mostrou maior que resultados citados na literatura para sucos de frutas,
melaço de cana e xarope de ácer (ÇAKAR et al., 2014; KUROSUMI et al., 2009; ZENG
et al., 2011). Visando manter o custo mínimo, optou-se neste estudo por não
utilizar suplementação no PC. O decréscimo da produção nas menores concentrações
de PC se explica pela diluição dos nutrientes juntamente com os açúcares na
formulação deles. A análise dos extratos fermentados teve como objetivo
quantificar o consumo de açúcar e calcular o rendimento da fermentação em relação
a quantidade de açúcar consumido. O HS e o PC100 apresentaram os maiores
rendimentos, 83,5% e 36%, respectivamente.
As características das membranas de CB também foram avaliadas. As CBs produzidas
em PC apresentaram valores de umidade semelhantes ao obtido com a CB de HS (~99%)
(figura 1). Nascimento e colaboradores (2016) obtiveram umidade de 98% para CB
produzida com extrato de algaroba, o que a caracteriza como um polímero de
elevada umidade. Esses valores estão dentro da faixa reportada na literatura para
CB (95-99%) (PECORARO et al., 2008). Todos os diagramas de DRX apresentaram
comportamento característico de CB, exibindo três picos, em aproximadamente 14°,
16° e 22° indicando a presença de celulose tipo I (forma predominante em celulose
excretada por bactéria), e são atribuídos aos planos cristalográficos (101),
(10ī) e (002), respectivamente. (MAEDA et al., 2006; TSOUKO et al., 2015; VAZQUEZ
et al., 2013). A estabilidade da celulose tipo I é comprovada após a purificação
onde não há conversão em celulose tipo II, que é mais frágil e pode influenciar
de maneira direta nas propriedades mecânicas do material. O índice de
cristalinidade (IC) das amostras variou de 74 a 85% (tabela 3). Esses valores
estão dentro da faixa característica reportada na literatura para CB (TROVATTI et
al., 2011; TSOUKO et al., 2015) e apresentam maior IC que o reportado para
celulose vegetal (CV) (40-70%) (NECHYPORCHUK et al., 2016). A maior resistência
mecânica da CB quando comparada à CV resulta de uma rede organizada
tridimensional e nanoestruturada formada por microfibras que também reflete
diretamente no IC superior da CB. É valido mencionar que quão maior a
concentração do PC maior foi o IC da CB produzida. Em todos os espectros de FTIR
obtidos foi possível observar bandas típicas de CB: ~3500cm-1 (estriamento de
grupos OH), 2980 cm-1 (estriamento de CH2 e CH em alcanos), 1635-1645 cm-1
(vibração de OH correspondente a água retida), 1425-1435 cm-1 (deformação
assimétrica de CH) 1146-1160 (estriamento C-O-C e deformação de CH). As bandas
observadas em 1111 cm-1 e 1059-1035 cm-1 correspondem a vibrações das ligações C-
C de unidades glicosídicas e deformação C-OH e C-O de carboidratos,
respectivamente (GEA et al., 2011; LIMA et al., 2017). A ausência de bandas
referentes a compostos nitrogenados indica que a purificação foi eficiente.
Celulose possui vários polimorfos, entretanto, na natureza é encontrada em sua
forma cristalina (celulose tipo I). As proporções de celulose tipo Iα
(triclínica) e Iβ (monoclínica) variam de acordo com a fonte de celulose.
Geralmente, plantas apresentam celulose tipo Iβ em abundância, enquanto celulose
produzidas por bactérias e algas apresentam celulose tipo Iα (DUFRESNE, 2017). No
caso da CB a razão Iα/Iβ pode ser modificada dependendo de condições de cultivo
como agitação, temperatura, fonte de carbono e nitrogênio e suplementos (KESHK,
S. M. A. S. e SAMESHIMA, 2005; MOLINA-RAMÍREZ et al., 2018; MOON et al., 2011).
OS resultados obtidos nesse trabalho indicam que a razão Iα/Iβ é aproximadamente
a mesma para todas as amostras (figura 1) e que esses valores são similares aos
reportados na literatura.
Todas as curvas termogravimétricas (TGA e DTG) das amostras estudadas apresentam
dois eventos. O primeiro (~100°C) está relacionado com perda de umidade, o que
indica a quantidade de água retida na amostra. O segundo evento (~350ºC) é
atribuído ao processo de degradação das cadeias glicosídicas que compõe a CB, o
que tende a ocorrer entre 200 e 400 °C (NASCIMENTO et al., 2016; VAZQUEZ et al.,
2013). A ausência de outros eventos não comuns à celulose, indica a completa
remoção de meio de cultura. Também, a figura 2 mostra os valores iniciais
(Tonset) e máximos (pico DTG) dos eventos de degradação. De maneira geral todas
as amostras apresentaram comportamento térmico semelhante e ótima estabilidade
térmica.
Figura 2 – Tonset, Pico DTG e resíduo de queima das películas de CB estudadas.
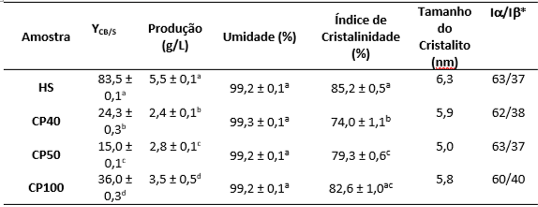
Produção (g/L), Rendimento (YCB/S), Umidade (%), Índice de Cristalinidade (%), tamanho do cristalito (nm) e razão de celulose α e β das películas de c
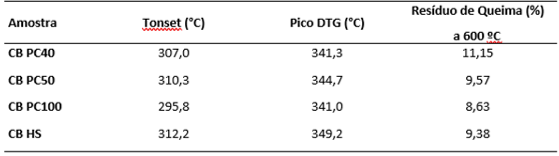
Tonset, Pico DTG e resíduo de queima das películas de CB estudadas
Conclusões
Foi possível produzir celulose bacteriana com todas as concentrações de permeado de caju propostas, utilizando a cepa Komagataeibacter xylinus ATCC 53583 em cultivo estático por 10 dias à 30ºC. A massa de celulose bacteriana produzida utilizando permeado de caju mostrou ser bastante satisfatória, quando comparadas a outros meios alternativos reportados na literatura, sendo o permeado de caju puro o que apresentou o maior valor de produção de celulose bacteriana. As películas obtidas com as diferentes concentrações de permeado de caju apresentaram características típicas de celulose bacteriana, como elevada estabilidade térmica, alta umidade e elevada cristalinidade semelhantes ao meio padrão e foram obtidas livres de impurezas. E a concentração de permeado interferiu no índice de cristalinidade da CB produzida. Com base em todos os resultados obtidos neste trabalho, pode-se afirmar que o permeado de caju apresenta potencial para uso como meio de cultivo visando a produção de celulose bacteriana por cultivo estático.
Agradecimentos
Os autores agradecem a Embrapa Agroindústria Tropical, a CAPES e o CNPq pelo apoio financeiro bem como o programa PRONEX FUNCAP/CNPq (Nº PR2-0101-00023.01.00/15).
Referências
AZILA ADNAN, GIRIDHAR R. NAIR, MARK C. LAY, JANIS E. SWAN, Roslan Umar. Glycerol As a Cheaper Carbon Source in Bacterial Cellulose ( Bc ) Production By Gluconacetobacter Xylinus Dsm46604 in Batch Fermentation System. Malaysian Journal of Analytical Sciences, v. 19, n. 5, p. 1131–1136, 2015.
CAI ZHIJIANG, Yang Guang. Bacterial Cellulose/Collagen Composite: Characterization and First Evaluation of Cytocompatibility. Journal of Applied Polymer Science, v. 120, n. 5, p. 2938–2944, 2011.
ÇAKAR, Fatih et al. Improvement production of bacterial cellulose by semi-continuous process in molasses medium. Carbohydrate Polymers, v. 106, n. 1, p. 1–13, 2014.
CARREIRA, Pedro et al. Utilization of residues from agro-forest industries in the production of high value bacterial cellulose. Bioresource Technology, v. 102, n. 15, p. 7354–7360, 2011. Disponível em: <http://dx.doi.org/10.1016/j.biortech.2011.04.081>.
CASTRO, Cristina et al. Structural characterization of bacterial cellulose produced by Gluconacetobacter swingsii sp . from Colombian agroindustrial wastes. Carbohydrate Polymers journal, v. 84, p. 96–102, 2011.
CHEN, Peng e CHO, Se Youn e JIN, Hyoung Joon. Modification and applications of bacterial celluloses in polymer science. Polymer Science Macromolecular Research, v. 18, n. 4, p. 309–320, 2010.
DUFRESNE, Alain. Nanocellulose : from nature to high performance tailored materials. [S.l: s.n.], 2017. Disponível em: <https://books.google.com.br/books?hl=pt-BR&lr=&id=vElADwAAQBAJ&oi=fnd&pg=PR7&dq=A.+Dufresne,+Nanocellulose:+From+Nature+to+High+Performance+Tailored+Materials,+1st+ed.,+De+Gruyter,+Berlin,+2012&ots=E7uvmC7wvr&sig=N8jfcSFAwienZia_b_qPYGS4iCE#v=onepage&q&f=>. Acesso em: 2 aug. 2019.
GEA, Saharman et al. Investigation into the structural, morphological, mechanical and thermal behaviour of bacterial cellulose after a two-step purification process. Bioresource Technology, v. 102, n. 19, p. 9105–9110, 2011. Disponível em: <http://dx.doi.org/10.1016/j.biortech.2011.04.077>.
HESTRIN, S. e SCHRAMM, M. Synthesis of cellulose by Acetobacter xylinum. 2. Preparation of freeze-dried cells capable of polymerizing glucose to cellulose*. Biochemical Journal, v. 58, n. 2, p. 345–352, 1954. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/13208601%5Cnhttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=PMC1269899>.
KESHK, S. M. a. S. e SAMESHIMA, Kazuhiko. Evaluation of different carbon sources for bacterial cellulose production. African Journal of Biotechnology, v. 4, n. 6, p. 478–482, 2005.
KESHK, Sherif MAS. Bacterial Cellulose Production and its Industrial Applications. Journal of Bioprocessing & Biotechniques, v. 04, n. 02, 2014. Disponível em: <https://www.omicsonline.org/open-access/bacterial-cellulose-production-and-its-industrial-applications-2155-9821.1000150.php?aid=22705>.
KUROSUMI, Akihiro et al. Utilization of various fruit juices as carbon source for production of bacterial cellulose by Acetobacter xylinum NBRC 13693. Carbohydrate Polymers, v. 76, n. 2, p. 333–335, 2009. Disponível em: <http://dx.doi.org/10.1016/j.carbpol.2008.11.009>.
LIMA, H. L.S. et al. Bacterial cellulose production by Komagataeibacter hansenii ATCC 23769 using sisal juice - An agroindustry waste. Brazilian Journal of Chemical Engineering, v. 34, n. 3, p. 671–680, 2017.
LIN, Dehui et al. Production of bacterial cellulose by Gluconacetobacter hansenii CGMCC 3917 using only waste beer yeast as nutrient source. Bioresource Technology, v. 151, p. 113–119, 2014. Disponível em: <http://dx.doi.org/10.1016/j.biortech.2013.10.052>.
MAEDA, Hideaki et al. Bacterial cellulose/silica hybrid fabricated by mimicking biocomposites. Journal of Materials Science, v. 41, n. 17, p. 5646–5656, Sep. 2006.
MILLER, Gail Lorenz. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Analytical Chemistry, v. 31, n. 3, p. 426–428, Mar. 1959. Disponível em: <http://pubs.acs.org/doi/abs/10.1021/ac60147a030>.
MOLINA-RAMÍREZ, Carlos et al. Physical Characterization of Bacterial Cellulose Produced by Komagataeibacter medellinensis Using Food Supply Chain Waste and Agricultural By-Products as Alternative Low-Cost Feedstocks economics and environmental concerns for producing BC with multiple p. J Polym Environ, v. 26, p. 830–837, 2018. Disponível em: <https://link-springer-com.ez11.periodicos.capes.gov.br/content/pdf/10.1007%2Fs10924-017-0993-6.pdf>. Acesso em: 2 aug. 2019.
MOON, Robert J et al. Cellulose nanomaterials review: structure, properties and nanocomposites. Chem. Soc. Rev, v. 40, p. 3941–3994, 2011. Disponível em: <www.rsc.org/csr>. Acesso em: 2 aug. 2019.
NASCIMENTO, Elígenes Sampaio et al. Mesquite (Prosopis juliflora (Sw.)) Extract is an Alternative Nutrient Source for Bacterial Cellulose Production. Journal of Biobased Materials and Bioenergy, v. 10, n. 8, p. 63–70, 2016.
NECHYPORCHUK, Oleksandr e BELGACEM, Mohamed Naceur e BRAS, Julien. Production of cellulose nanofibrils: A review of recent advances. Industrial Crops and Products, v. 93, p. 2–25, 2016. Disponível em: <http://dx.doi.org/10.1016/j.indcrop.2016.02.016>. Acesso em: 2 aug. 2019.
PECORARO, Édison et al. Bacterial Cellulose from Glucanacetobacter xylinus : Preparation, Properties and Applications. . [S.l: s.n.], 2008. Disponível em: <https://pdf.sciencedirectassets.com/277293/3-s2.0-B9780080453163X00014/3-s2.0-B978008045316300017X/main.pdf?X-Amz-Security-Token=AgoJb3JpZ2luX2VjEGIaCXVzLWVhc3QtMSJHMEUCIHBUDrqltdRYOidhk8sjSzeL1i5IMpw8dy25w5pDqer1AiEAo4AvlAeCDSsv3%2BVdaz%2Bz0rt7orWS98fzv4>. Acesso em: 2 aug. 2019.
SCHRAMM, M. e HESTRIN, S. Factors affecting Production of Cellulose at the Air/ Liquid Interface of a Culture of Acetobacter xylinum. Journal of General Microbiology, v. 11, n. 1, p. 123–129, 1954.
SON, Hong Joo et al. Increased production of bacterial cellulose by Acetobacter sp. V6 in synthetic media under shaking culture conditions. Bioresource Technology, v. 86, n. 3, p. 215–219, 2003.
TROVATTI, Eliane et al. Biocellulose membranes as supports for dermal release of lidocaine. Biomacromolecules, v. 12, n. 11, p. 4162–4168, 2011.
TSOUKO, Erminda et al. Bacterial cellulose production from industrial waste and by-product streams. International Journal of Molecular Sciences, v. 16, n. 7, p. 14832–14849, 2015.
UL-ISLAM, Mazhar e KHAN, Taous e KON PARK, Joong. Water holding and release properties of bacterial cellulose obtained by in situ and ex situ modification. Carbohydrate Polymers, METODOLOGIA DE CAPACIDADE DE RETENÇÃO DE ÁGUA, v. 88, p. 596–603, 2012. Disponível em: <https://pdf.sciencedirectassets.com/271345/1-s2.0-S0144861712X00031/1-s2.0-S0144861712000082/main.pdf?x-amz-security-token=AgoJb3JpZ2luX2VjEND%2F%2F%2F%2F%2F%2F%2F%2F%2F%2FwEaCXVzLWVhc3QtMSJIMEYCIQCKL5o%2Blpipxpsn6UBJOE9DP1Zmg9qGU8UM4pahxGTp8QIhANySkSbN0B>. Acesso em: 24 may 2019.
VAZQUEZ, Analía et al. Bacterial Cellulose from Simple and Low Cost Production Media by Gluconacetobacter xylinus. Journal of Polymers and the Environment, v. 21, n. 2, p. 545–554, 2013.
ZENG, Xiaobo e SMALL, Darcy P. e WAN, Wankei. Statistical optimization of culture conditions for bacterial cellulose production by Acetobacter xylinum BPR 2001 from maple syrup. Carbohydrate Polymers, v. 85, n. 3, p. 506–513, 2011. Disponível em: <http://dx.doi.org/10.1016/j.carbpol.2011.02.034>.
ZHAO, Hongwei et al. Production of bacterial cellulose using polysaccharide fermentation wastewater as inexpensive nutrient sources. Biotechnology and Biotechnological Equipment, v. 32, n. 2, p. 350–356, 2018. Disponível em: <https://doi.org/10.1080/13102818.2017.1418673>.









