Ácido Tereftálico a partir de PET: Estudo de metodologias de menor impacto ambiental na reciclagem química de garrafas pós consumo e obtenção de intermediário sintético versátil de alto valor agregado.
ISBN 978-85-85905-25-5
Área
Química Verde
Autores
Melo, I.C. (IFRJ) ; Cavalcante, S.F.A. (IDQBRN/CTEX) ; Vieira, D.P.P. (IFRJ)
Resumo
Visando reduzir o descarte de garrafas PET e instigar o interesse industrial buscou-se encontrar uma rota mais limpa tecnologicamente possível de despolimerizar o PET obtendo produto com interesse tecnológico e alto valor agregado, o ácido tereftálico (TPA). A utilização de sais e óxido de zinco em água como solvente assim como bases inorgânicas álcoois como solventes, incluindo o glicerol, que é um subproduto da indústria do Biodiesel. Reações utilizando refluxo e micro-ondas como aquecimento foram testadas. Os produtos foram caracterizados por métodos físicos de análise como infravermelho (FTIR da Bruker), UPLC-ESI/MS (Agilent Technologies), onde se observou um melhor desempenho quando empregado ZnSO4 como catalisador em água e KOH como catalisador em pentan-1-ol.
Palavras chaves
química verde; polímeros; sustentabilidade
Introdução
O politereftalato de etileno (PET) é um poliéster largamente utilizado industrialmente, principalmente nas indústrias alimentícias como embalagem, pois possui como propriedades: resistência mecânica, resistência química, difícil permeabilidade de gases e odores, transparência, brilho e fácil reciclabilidade. Esse polímero pode ser obtido a partir de três rotas comerciais: pela reação de esterificação do ácido tereftálico com o etileno glicol, pela reação de transesterificação do tereftalato de dimetila com o etileno glicol e pela reação do cloreto de tereftaloila com o etileno glicol (MATAR e HATCH, 2000). O etileno glicol e o ácido tereftálico, assim como os derivados do ácido tereftálico citados acima nos esquemas 2 e 3, são oriundos de produtos de primeira geração da indústria petroquímica: o etileno (ou eteno) e o para- xileno, respectivamente. Além da problemática em se utilizar uma fonte não renovável de matéria-prima, o PET é altamente resistente à degradação, podendo permanecer no meio ambiente por mais de 500 anos (GRIPPI, 2001). Uma solução a longo prazo foi recém-descoberta no Japão, onde um grupo de cientistas descobriu uma bactéria capaz de utilizar o PET como fonte de carbono e energia. Essa espécie, Ideonella sakaiensis 201-F6, possui duas enzimas (PETase e MHETase) que são capazes de degradar e processar as moléculas de PET e de seu intermediário de reação, o ácido mono(2-hidroxietil) tereftálico (MHET) (YOSHIDA et al, 2016). Em vista das grandes quantidades de resíduos de PET já encontradas no meio ambiente e as que são indevidamente descartadas diariamente, a alternativa encontrada na bactéria 201-F6 é vista apenas como uma solução para tempos futuros, onde possivelmente a própria raça humana já estaria extinta. Portanto, faz-se necessário manter a reciclagem como uma das alternativas para esse impacto ambiental causado, além de manter a divulgação da prática de descarte correto. A reciclagem de materiais poliméricos é dividida em três tipos: física, térmica e química. • A reciclagem física é quando o formato e tamanho do material são modificados, a térmica envolve a quebra da molécula via aquecimento e a química consiste na quebra da molécula polimérica via reações químicas (HARPER e PETRIE, 2003). Dentre as garrafas PET pós-consumo que são recicladas industrialmente, a maior parte é feita via reciclagem física, onde o material é submetido à lavagem, secagem, aquecimento e reprocessamento, transformando-o em pellets para posteriormente serem utilizados para a obtenção de variados produtos, tais como: roupas, embalagens de produtos de limpeza e alimentos, vasos de jardim, cordas de varal, réguas, relógios, caixas d’água, tubos e conexões, piscinas, telhas, tintas e vernizes, para-choques de carros, bancos de ônibus e muitos outros produtos. • A reciclagem térmica é utilizada principalmente para fins de ganhos energéticos, onde o material é levado à combustão e a energia liberada em forma de calor é aproveitada. • A reciclagem química consiste em submeter o material a reações químicas, obtendo-se outros produtos. Reciclar o PET quimicamente é bastante vantajoso, tanto na questão ambiental quanto na econômica, como pode ser observado na tabela 1, pois a partir da reação de despolimerização do mesmo, podem-se obter oligômeros, que são macromoléculas de massa molecular inferior à de um polímero, e também o seu monômero, o ácido tereftálico, com altos rendimentos. O ácido tereftálico é principalmente utilizado para a produção de PET, porém, é possível obter uma variedade de moléculas a partir dele, tais como: cloreto de acila, hidrocarbonetos aromáticos, ésteres, redes metalorgânicas e outros polímeros. No conceito de Química Verde, uma das categorias que classifica uma indústria como “quimicamente verde” ou tecnologicamente limpa é a partir do uso de fontes de matéria-prima recicladas. Este conceito vem sendo disseminado desde os anos 90, com o intuito de promover alternativas menos poluentes ou não- poluentes quando utilizados processos químicos tanto no meio industrial quanto no acadêmico (LENARDÃO, E. J. et al, 2003). Este trabalho teve como objetivo desenvolver uma rota de obtenção de ácido tereftálico via despolimerização de garrafas PET pós-consumo, obedecendo ao máximo de princípios da Química Verde, evitando-se a produção de subprodutos e a utilização de reagentes tóxicos ao meio ambiente.
Material e métodos
3.6.1. Despolimerização via refluxo A metodologia utilizada na reação via refluxo foi a mesma adotada em VIEIRA, D. P. P. et al, 2018. As garrafas PET foram coletadas em lixeiras, os rótulos e tampas foram removidos e as garrafas foram limpas e secas. Após isso, foram trituradas em pedaços de aproximadamente 1x1cm. O material triturado foi pesado e transferido para um balão de reação junto ao etileno glicol e o hidróxido de potássio, onde foram mantidos em aquecimento com refluxo por uma hora e meia. Em seguida, o produto obtido foi acidificado com ácido sulfúrico a 5mol/L e o precipitado foi filtrado à vácuo. O material filtrado foi seco em estufa e caracterizado por Espectroscopia de Infravermelho por Transformada de Fourrier (FTIR). O produto foi reagido com cloreto de tionila sob refluxo com o intuito de se obter o cloreto de tereftaloíla, por ser altamente reativo e mais facilmente empregado na produção de outras moléculas. Porém, essa metodologia foi descartada por desviar dos princípios da Química Verde, pois se utiliza de solventes perigosos e gera bastante resíduo. 3.6.2. Despolimerização via micro-ondas As metodologias utilizadas foram adaptações das metodologias da literatura (TANG 2011 e NIKJE 2007), onde a primeira utiliza sais de zinco como catalisadores da despolimerização e água como solvente e a segunda utiliza hidróxido de potássio como catalisar e pentan-1-ol como solventes. As condições utilizadas em cada experimento foram: 2 gramas de PET previamente triturados, 20 mililitros de água destilada, 150°C de temperatura, 300W de potência, 0,41% molar de zinco nos catalisadores sulfato de zinco, acetato de zinco, óxido de zinco e cloreto de zinco, por 30 minutos no reator de micro- ondas, adaptando-se a metodologia de Tang; 1 grama de PET previamente triturado, 0,69 gramas de hidróxido de potássio, 150°C de temperatura, 300W de potência, 8 mililitros do solvente alcoólico (petan-1-ol, propano-1-ol e propano-2-ol), por 30 minutos no reator de micro-ondas, adaptando-se à metodologia de Nikje. Terminadas as reações, os produtos foram caracterizados por Cromatografia Líquida com Espectrômetro de Massas com Ionização por Eletrospray (HPLC- ESI/MS) do laboratório do Instituto de Defesa Química, Biológica, Radiológica e Nuclear do Centro de Tecnologia do Exército (IDQBRN-CTEx). Adaptando-se a metodologia de Nikje, 2007, uma mistura glicerol:água foi utilizada como solvente substituindo o pentan-1-ol. Antes da adaptação do solvente, estudaram-se as condições ideais de temperatura, pressão e potência, variando-se as proporções entre glicerol e água: 25% glicerol e 75% água, 50% glicerol e 50% água, 75% glicerol e 25% água e também somente o glicerol (100%).
Resultado e discussão
A caracterização do produto obtido via refluxo foi realizada por
Espectroscopia no Infravermelho por Transformada de Fourrier (FTIR), onde o
produto é condicionado a radiações do infravermelho e são observadas as
características das ligações da molécula pelas vibrações em faixas conhecidas.
O espectro do produto obtido teve bastante similaridade ao espectro esperado,
como pode ser observado na figura 1, embora não se possa afirmar que o ácido
tereftálico fora obtido.
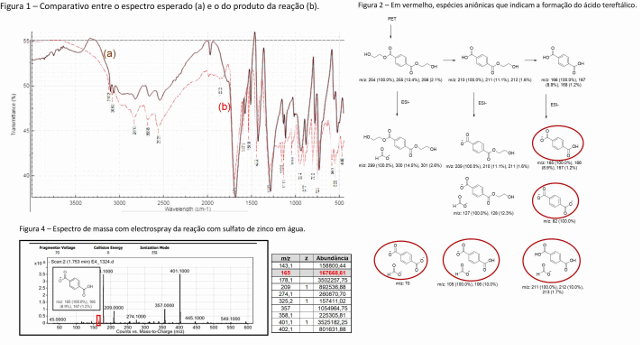
Figura 1 – Comparativo entre o espectro esperado (a) e o do produto da reação
(b).
Já a caracterização dos produtos obtidos via micro-ondas se deu por
Cromatografia Líquida de Ultraperformance (UPLC) acoplada ao Espectrômetro de
Massas por Ionização em Electrospray (ESI-MS), onde esperava-se observar os
picos referentes à relação massa e carga das espécies aniônicas representadas
abaixo, indicando a formação do produto desejado.
Figura 2 – Em vermelho, espécies aniônicas que indicam a formação do ácido
tereftálico.
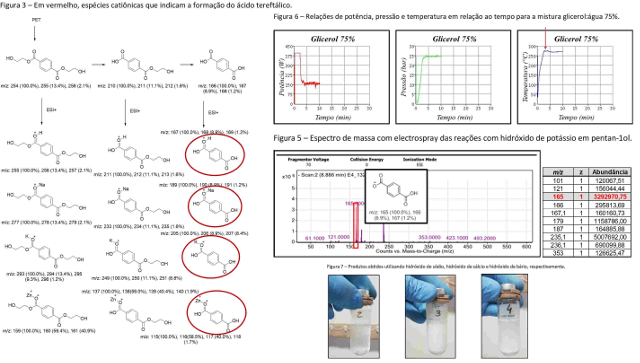
Figura 3 – Em vermelho, espécies catiônicas que indicam a formação do ácido
tereftálico.
Somente nas reações utilizando sulfato de zinco em água e utilizando hidróxido
de potássio em pentan-1-ol foi possível observar a formação do produto
esperado, como pode ser observado nas figuras 4 e 5. Levando-nos a pensar na
possibilidade de se utilizar uma mescla de solventes, a mistura glicerol:água,
buscando assim uma metodologia verde, pois se utiliza de um subproduto da
Indústria do Biodiesel como solvente.
Figura 4 – Espectro de massa com electrospray da reação com sulfato de zinco
em água.
Figura 5 – Espectro de massa com electrospray das reações com hidróxido de
potássio em pentan-1-ol.
Para tanto, estudaram-se as condições de temperatura máxima e pressão para que
as análises fossem feitas. Na proporção de 75% de glicerol em água foi
possível obter-se as temperaturas mais altas, sem ultrapassar a pressão máxima
suportada pelo equipamento (figura 6).
Figura 6 – Relações de potência, pressão e temperatura em relação ao tempo
para a mistura glicerol:água 75%.
Em combinação à mistura de solventes mais verde, buscou-se encontrar um
catalisador que não fosse tóxico ao meio ambiente, testando-se assim bases
inorgânicas de metais alcalinos e alcalinos terrosos. Apesar da caracterização
dos produtos obtidos ainda não ter sido concluída, supõem-se que foi possível
obter o ácido tereftálico desta forma, pois é observada a precipitação de um
sólido branco quando utilizado hidróxido de cálcio e hidróxido de bário como
catalisador (figura 7), indicando que o cátion bivalente seria o real
catalisador na metodologia de Nikje.
Figura 7 – Produtos obtidos utilizando hidróxido de sódio, hidróxido de cálcio
e hidróxido de bário, respectivamente.
Compilado de figuras e esquemas do resumo(1/2).
Compilado de figuras e esquemas do resumo(2/2).
Conclusões
Com base nos resultados obtidos, uma rota via micro-ondas para a despolimerização do ácido tereftálico atende a todos os doze princípios da Química Verde, quando utilizadas bases inorgânicas atóxicas. O que não desclassifica as adaptações das metodologias de Tang e Nikje como quimicamente verdes, pois as mesmas se utilizam de fonte reciclável de matéria-prima também. Porém, necessitam do uso de solventes perigosos ou possuem baixa conversão, concluindo-se que a metodologia mais viável e quimicamente verde seria utilizando a mistura de glicerol. Propõe-se como scale-up uma planta hifenada entre uma indústria de biodiesel e uma de ácido tereftálico da despolimerização do PET, utilizando-se da logística reversa como alternativa à fonte fóssil.
Agradecimentos
Agradecimentos especiais ao IDQBRN-CTEx, que possibilitou realizar as reações em micro-ondas e as análises em CG-EM, HPLC-EM e UPLC-EM.
Referências
ABIPET. 9º Censo da Reciclagem de PET – Brasil, 2012. Disponível em: <http://www.abipet.org.br/index.html?method=mostrarInstitucional&id=7> Acesso em: 02/04/2018.
ABRE. Estudo Macroeconômico da Embalagem, 2014. Disponível em: <http://www.abre.org.br/setor/dados-de-mercado/> Acesso em: 02/04/2018.
GRIPPI, S. , LIXO, RECICLAGEM E SUA HISTÓRIA: Guia para as prefeituras brasileiras, 2ª edição, Interciência, 2006.
HARPER, C. A., PETRIE, E. M., Plastics and materials processes, a concise encyclopedia. Wiley-Interscience, 2003. 477-478.
IPEA. Diagnóstico dos Resíduos Sólidos Urbanos - Relatório de Pesquisa, 2012. 44-46.
LENARDÃO, E. J. et al, “GREEN CHEMISTRY” – Os 12 princípios da química verde e sua inserção nas atividades de ensino e pesquisa. Química Nova, vol. 26, 2003. 123-129.
MATAR, S., HATCH, L. F., Chemistry of Petroquemical Processes, Second Edition, Gulf Publishing Company, 2000.
MINISTÉRIO DO MEIO AMBIENTE. Pesquisa mostra crescimento da consciência ambiental no Brasil, 2006. Disponível em:<http://www.mma.gov.br/informma/item/3318-pesquisa-mostra-crescimento-da-consciencia-ambiental-no-brasil> Acesso em: 02/04/2018.
NIKJE, M. M. A. e NAZARI, F. Microwave-assisted depolymerization of poly(ethylene terephthalate) [PET] at atmospheric pressure. Wiley-Interscience, 2007. 242-246.
TANG, Q., MA, Y. e ZHANG, D. Effects of temperature on catalytic hydrolysis of PET by Zinc Sulfate under microwave irradiation. Advanced Materials Research, 2011. 1628-1631.
VIEIRA, D. P. P. et al, MOF a partir de PET e glicerol, Febrace, 2018. 1-7.
YOSHIDA, S., HIRAGA, K., TAKEHANA, T., TANIGUCHI, I., YAMAJI, H., MAEDA, Y., TOYOHARA, K., MIYANMOTO, K., KIMURA, Y., ODA, K., A bacterium that degrades and assimilates poly(ethylene terephthalate). Science, 2016. 1196 – 1199.









