Equilíbrio de fases de sistemas aquosos bifásicos composto por polietilenoglicol (2000, 6000) g.mol-1, sulfato de sódio e fosfato de sódio sob temperaturas em pH 2
ISBN 978-85-85905-25-5
Área
Química Verde
Autores
Barbosa, A.A. (UFPE) ; Bonomo, R.C.F. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Aquino, R.V.S. (UFPE) ; Pimentel, J.G. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Santos, D.M. (UFPE) ; Silva, M.G.N. (UFPE)
Resumo
Neste estudo, foram determinados 4 diagramas de fases para sistemas aquosos bifásicos (SAB) compostos por polímero de polietileno glicol (PEG), sal inorgânico e água. Os dados de equilíbrio foram formados para os sistemas formados por PEG 2000+sulfato de sódio+água, PEG 6000+sulfato de sódio+água, PEG 2000+fosfato de sódio+ água, PEG 6000+fosfato de sódio+água nas temperaturas de 20°C e 30 °C, em pH 2. O efeito da temperatura promoveu o aumento da inclinação da linha de amarração, em razão da transferência de moléculas de água da fase superior para a inferior. Com relação ao efeito da massa molar do polímero, observou-se que seu aumento levou a uma maior região bifásica do diagrama de fases.
Palavras chaves
Extração líquido-líquido; Sistema aquoso bifásico; Dados de equilíbrio
Introdução
O sistema aquoso bifásico (SAB) têm sido uma importante ferramenta como um método de separação e purificação de biomateriais, tais como proteínas, enzimas, células animais ou vegetais, microorganismos e cloroplastos, com várias vantagens em comparação com métodos convencionais, tais como redução de custos, minimização das etapas de separação, obtenção de produtos de elevada pureza e alta recuperação dos materiais. Beijerinck em 1896 reportou separação da fase liquida, que foi usado pela primeira vez para fins de extração e purificação por Albertsson (ALBERTSSON, 1960). A extração líquido-líquido (ELL) com sistemas aquosos bifásicos têm sido utilizada com grande sucesso em processos de separação, concentração e purificação. A utilização dos SAB permite isolar e concentrar biomoléculas com atividade biológica de misturas complexas, como proteína e corante, pois as fases constituídas majoritariamente por água, entre 70% a 90%, oferecem um ambiente adequado e com condições favoráveis à distribuição das mesmas nesses sistemas (BARBOSA et al., 2016; PESSOA-JÚNIOR, 2005). Os SAB’s são formados por misturas de espécies quimicamente distintas em concentrações além das definidas pela zona de transição de fases, também, em certas concentrações de composição e temperaturas. Os sistemas podem ser compostos basicamente por polímeros/polímeros (LI; CAO, 2010); polímero/sal (ZAFARANI-MOATTAR; HOSSEINPOUR-HASHEMI, 2012); líquidos iônicos/sal (HAN et al., 2012) e micromoléculas orgânicas hidrofílicas/sal (ZAFARANI-MOATTAR; TOLOUIEI, 2012). Os diagramas de fases são utilizados como dados de equilíbrio, já que são feitos em temperatura e pressão definidos. A representação das informações termodinâmicas é de extrema importância para o estudo da separação de biomoléculas, pois é usada como ferramenta de ponto de partida para um processo de extração (BARBOSA et al., 2016). Assim, o presente trabalho determinou dados de equilíbrio para sistemas aquosos bifásicos formados por polietileno glicol (PEG) 2000 g.mol-1 e 6000 g.mol-1, sais (sulfato de sódio e fosfato de sódio) e água, em pH 2 em duas temperaturas, analisando termodinamicamente os efeitos da temperatura, da natureza do eletrólito e da massa molar do polímero no equilíbrio de fases.
Material e métodos
Para a montagem os sistemas aquosos bifásicos, compostos de PEG-sal-água, foram preparados soluções estoque PEG em água e sal em água. A concentração da solução de PEG foi de 50 % (m/m), já a solução salina de sulfato de sódio e fosfato de 25% (m/m). Os valores de pH das soluções salinas, próximos a 2, foram ajustados com o ácido conjugado, ácido sulfúrico para sulfato de sódio e ácido fosfórico para fosfato de sódio, e conferido em pHmetro até se obterem os valores desejados. Os sistemas aquosos bifásicos foram formados adicionando quantidade adequada de solução estoque PEG, sal e água para uma massa total do sistema de 50 g. A mistura resultante foi agitada em agitador vortex por aproximadamente por 3 minutos e centrifugada a 3000 rpm por 20 minutos para acelerar a formação das duas fases e, em seguida, foi mantida em repouso durante 24 horas em incubadora (Quimis) na temperatura de 30°C. A titulação turbidimétrica foi a técnica usada preliminarmente para definir as quantidades necessárias de PEG, sal e água, para os diagramas de PEG 2000 g.mol-1, fosfato de sódio, 30°C; PEG 2000 g.mol-1, sulfato de sódio, 30°C; PEG 6000 g.mol-1, fosfato de sódio, 30°C e PEG 6000 g.mol-1, sulfato de sódio, 30°C, para que ocorresse a separação de fases. As quantidades necessárias dos três componentes para os outros diagramas foram determinadas com base nestas duas titulações. Todas as soluções e diluições foram preparadas cuidadosamente e usado a balança analítica na pesagem para que o balanço de massa foi feito corretamente. As curvas binodais experimentais foram determinadas e ajustadas à equação empírica (Equação 1) sugerida por MERCHUK et al. (1998): y=a.exp(b.x^0,5-c.x^3) (1) Em que y e x são as composições em fração mássica do polímero e sal, respectivamente, a, b e c são parâmetros de ajuste da equação.
Resultado e discussão
Na Figura 1 estão apresentados os diagramas de fases dos sistemas PEG
2000+sulfato de sódio+água, PEG 6000+sulfato de sódio+água, PEG 2000+fosfato
de sódio+água, PEG 6000+fosfato de sódio+água em função das temperaturas de
20°C e 30°C. Os dados experimentais obtidos por turbidimetria para obtenção
das curvas binodais dos sistemas foram correlacionados pela equação não
linear (Equação 1) desenvolvida por MERCHUK et al. (1998).
Estes diagramas delineiam o comportamento dos sistemas aquosos bifásicos e é
único para cada sistema em condições de temperatura, concentração de sal e
concentração de polímero, sendo que a formação das duas fases aquosas
depende da concentração do sistema. Abaixo das concentrações críticas do
polímero e de sal, mistura destes componentes são completamente miscíveis
formando uma fase homogênea, e acima da concentrações crítica de sal e PEG
ocorre um sistema com duas fases. Sendo assim, o diagrama de fases separa a
região monofásica (abaixo da curva) da bifásica (acima da curva) de acordo
com a concentração de cada componentes expressa em % (m/m); essa curva é
chamada de curva binodal ou curva de equilíbrio.
Nos diagramas de fases nas Figura 1 pode ser observada influência das
temperaturas estudas nos sistemas, devido uma expansão da região bifásica
quando se aumenta a temperatura. A partir da análise dos dados binodais
verificou-se que a solubilidade do PEG diminui á medida que a temperatura
aumenta isto, provavelmente, deve-se a solvatação das moléculas de água para
a fase inferior. Esse efeito é conhecido como “salting out”, e torna-se mais
forte com o aumento da temperatura, sendo o mesmo comportamento observado
por (FERREIRA e TEIXEIRA, 2011).
Uma tendência semelhante tem sido relatada por vários autores estudado em
diferentes temperaturas, A literatura reporta que o aumento da temperatura
pode provocar um aumento da região bifásica em diagramas do tipo polímero +
sal (MURUGESAN E PERUMALSAMY, 2005; JAYAPAL et al., 2007; AMARESH et al.,
2008; REGUPATHI et al., 2009). A relação entre o aumento da temperatura e
aumento da região bifásica está associada ao fato de que o processo de
separação é endotérmico. Entretanto, vários artigos mostram que temperatura
pode ter um efeito tão pequeno, que do ponto de vista estatístico não há
diferença entre as curvas binodais (MARTINS et al., 2008). O efeito da
temperatura sobre o equilíbrio de fases também é analisado quanto às
propriedades termodinâmicas entalpia e entropia (CARVALHO et al., 2007).
Pode ser observado na Figura 1, que as curvas binodais tornam-se mais
assimétricas e deslocam-se para concentrações menores de PEG e sal com o
aumento da massa molar do polímero. Esse comportamento é atribuído a
diminuição de solubilidade do PEG em água, que aumenta com a elevação da sua
massa molar, por isso, menores concentrações são requeridas para separação
de fases. A fase rica em PEG satura-se em concentrações relativamente baixas
com o aumento da massa molar do polímero. Essa tendência está de acordo com
resultados experimentais encontrados na literatura (BARBOSA et al., 2016;
ZAFARANI-MOATTAR et al., 2004; OLIVEIRA et al., 2009).
As curvas binodais experimentais apresentada na Figura 1 foram ajustadas a
equação empírica sugerida MERCHUK descrita na Equação 1. Na Tabela 1
apresentam os parâmetros e o coeficiente de determinação obtido para os
sistemas PEG + sulfato de sódio e PEG + Fosfato de sódio nas temperaturas de
20 e 30 °C.
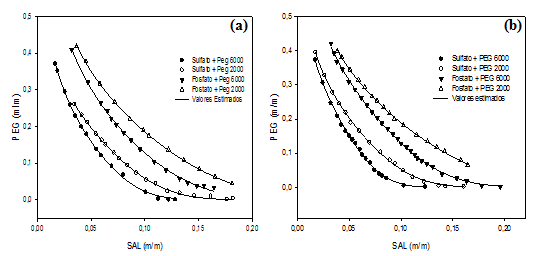
Diagrama de fases para sistemas PEG 2000 + Fosfato e PEG 6000 + Fosfato, nas temperaturas de a) 20 °C e b) 30 °C.
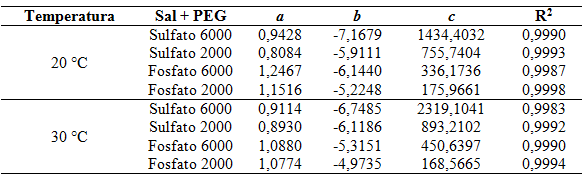
Parâmetros a, be c e coeficiente de determinação obtidos para os sistemas PEG e Sulfato, PEG e Fosfato a 20°C e 30°C pela equação de Merchuk.
Conclusões
Foram construídos diagramas compostos por PEG 2000 + sulfato de sódio + água, PEG 6000 + sulfato de sódio+ água, PEG 2000 + fosfato de sódio + água, PEG 6000 + fosfato de sódio + água, nas temperaturas de 20°C e 30°C no pH 2. Constatou-se que o efeito da temperatura sobre os sistemas não apresentou grandes variações na região bifásica. Porém, houve um aumento na inclinação da linha de amarração à medida que a temperatura ia aumentando, podendo-se concluir que ocorreu transferência das moléculas de água da fase superior para a fase inferior. Pôde-se também constatar que o aumento da massa molar ocasionou um aumento da região bifásica em todas as temperaturas de estudo.
Agradecimentos
Referências
ALBERTSSON, P-Ä. Partition of Cell Particles and Macromolecules. International Publishers Printers and Booksellers, 231 p., Estocolmo, 1960.
AMARESH, S. P.; SHREELA, M.; REGUPATHI, I.; MURUGESAN, T. Liquid- Liquid Equilibrium of Poly(ethylene glycol) 4000 + diAmmonium Hydrogen Phosphate + Water at different temperatures. Journal of Chemical Engineering Data, v. 53, p. 1574–1578, 2008.
BARBOSA, A. A.; BONOMO, R. C. F.; MARTINS, C. V.; FONTAN, R. C. I. ; SOUZA JÚNIOR, E. C.; MINIM, L. A.; PIGNATA, M. C. Equilibrium Data and Physical Properties of Aqueous Two Phase Systems Formed by PEG (1500 and 4000) g·mol -1 + Sodium Sulfate + Water at Different Temperatures and pH 2. Journal of Chemical and Engineering Data, v. 61, p. 3-11, 2016.
CARVALHO, C. C.; COIMBRA, J. S. R.; COSTA, I. A. F.; MINIM, L. H.; MAFFIA, M. C. Equilibrium Data for PEG 4000 + Salt + Water Systems from (278.15 to 318.15) Journal of Chemical Engineering Data, v. 52, p. 351-356, 2007.
FERRREIRA, L. A.; TEIXEIRA, J. A. Salt effect on the aqueous two-phase system PEG 8000 – Sodium Sulfate. Journal of Chemical Engineering Data, v. 56, p. 133-137, 2011.
HAN, J.; WANG, Y.; YU, C. L.; LI, Y. Y.; KANG, W. B.; YAN, Y. S. Liquid–liquid equilibrium of imidazolium ionic liquids + organic salts aqueous two-phase systems at 298.15 K and the influence of salts and ionic liquids on the phase separation. The Journal of Chemical Thermodynamics, v. 45, p. 59-67, 2012.
JAYAPAL, M.; REGUPATHI, I; MURUGESAN, T. Liquid-Liquid Equilibrium of Poly(ethylene glycol) 2000 + Potassium Citrate + Water at (25, 35, and 45) °C. Journal of Chemical Engineering Data, v. 52, p. 56-59, 2007.
LI, Y.J., CAO, X.J., Prediction of phase diagrams for new pH-thermo sensitive recycling aqueous two-phase systems, Fluid Phase Equilibria, v. 298, p. 206–211, 2010.
MARTINS, J. P.; DE OLIVEIRA, F. C.; COIMBRA, J. S. R.; DA SILVA, L. H. M; DA SILVA, M. C. H.; DO NASCIMENTO, I. S. B. Equilibrium phase behavior for ternary mixtures of poly(ethylene) glycol 6000 + water + sulfate salts at different temperatures. Journal of Chemical Engineering Data, v. 53, p. 2441-2443, 2008.
MERCHUK, J. C.; ANDREWS, B. A.; ASENJO, J. A. Aqueous two-phase systems for protein separation. Studies on phase inversion. Journal of Chromatography B, v. 711, p. 285–293, 1998.
MICHEL, B.; NEVES, M. T.; de SOUZA, R. C. S.; das CHAGAS, M. M.; COIMBRA, J.S.R. Partição de proteínas de soro de leite em sistemas aquosos bifásicos baseados em líquidos iônicos. Química nova, v. 38, n. 9, p. 1148-1152, 2015.
MURUGESAN, T.; PERUMALSAMY, M. Liquid-liquid equilibria of Poly(ethylene glycol) 2000 + sodium citrate + water at (25, 30, 35, 40, and 45) °C. Journal of Chemical Engineering Data, v. 50, p. 1392-1395, 2005.
OLIVEIRA, F. C.; COIMBRA, J. S. R.; SILVA, L. H. M.; ROJAS, E. E. G.; SILVA, M. C. H. Ovomucoid partitioning in aqueous two-phase systems. Biochemical Engineering Journal. v. 47, p. 55–60, 2009
PESSOA-JÚNIOR, A.; KILIKIAN, B. V. Purificação de Produtos Biotecnológicos. Editora Manole Ltda, São Paulo, 2005.
REGUPATHI, I.; SHREELA, M.; GOVINDARAJAN, R.; AMARESH, S. P.; MURUGESAN, T. Liquid-Liquid Equilibrium of Poly(ethylene glycol) 6000 + Triammonium Citrate + Water Systems at Different Temperatures. Journal of Chemical Engineering Data, v. 54, p. 1094–1097, 2009.
SILVÉRIO, S. C.; MADEIRA, P. P.; RODRÍGUEZ,O.; TEIXEIRA, J. A.; MACEDO, E. A. ΔG (CH2) in PEG-Salt and Ucon-Salt Aqueous Two-Phase Systems. Journal of Chemical Engineering Data, v. 53, p. 1622–1625, 2008.
ZAFARANI-MOATTAR, M. T.; HOSSEINPOUR-HASHEMI, V. Effect of Temperature on the Aqueous Two-Phase System Containing Poly(ethylene glycol) Dimethyl Ether 2000 and Dipotassium Oxalate. Journal of Chemical and Engineering Data, v. 57, n.2, p. 532–540, 2012.
ZAFARANI-MOATTAR, M. T.; NEMATI-KANDE, E.; SOLEIMANI, A. Study of the liquid–liquid equilibrium of 1-propanol + manganese sulphate and 2-propanol + lithium sulphate aqueous two-phase systems at different temperatures: experiment and correlation, Fluid Phase Equilibria, v. 313, p.107–113, 2012.
ZAFARANI-MOATTAR, M. T.; SADEGHI, R.; HAMID, A. A. Liquid–liquid equilibria of an aqueous two-phase system containing polyethylene glycol and sodium citrate experiment and correlation. Fluid Phase Equilibria, v. 219, p. 147-153, 2004.
ZAFARANI-MOATTAR, M. T.; TOLOUEI, S. Liquid–liquid equilibria of aqueous two-phase systems containing polyethylene glycol 4000 and di-potassium tartrate, potassium sodium tartrate, or di-potassium oxalate: Experiment and correlation. Calphad, v. 32, n. 4, p. 655-660, 2008.









