PRODUÇÃO DE BIODIESEL EMPREGANDO O CATALISADOR COMPLEXO METÁLICO DE PIRIDINA ([Sn(Py)2Cl2].2H2O)
ISBN 978-85-85905-25-5
Área
Química Verde
Autores
S.araújo, W. (UFMA) ; M.c.m.santos, A. (IFMA) ; de J. R. Mendonça, S. (UFMA) ; da Cruz, N. (UFMA) ; C. Silva, F. (UFMA) ; M.nascimento, U. (UFMA)
Resumo
Atualmente deve-se minimizar impactos ambientais causados pelos combustíveis fósseis. O biodiesel devido a sua biodegradabilidade torna-o viável como meio alternativo. O objetivo foi estudar o biodiesel por meio reacional com óleo de babaçu e soja, MeOH e EtOH, empregando o LI complexo metálico de piridina ([Sn(Py)2Cl2].2H2O). Sintetizou-se o cloreto de estanho diidratado (27,91 g; 0,12 mol) misturando com piridina (9,49 ml; 0,12 mol) onde foi refluxada e agitada por 10h a 80 °C, após foi purificado com éter de petróleo (25 ml), filtrado e secado a vácuo a 120 °C. na síntese do biodiesel utilizou-se o LI em BMB e BMS com média de esteres de 72% após 16h de reação com 2% de LI razão molar 1:1 a 170°C. Conclui-se que o LI mostrou- se promissora síntese de biodiesel.
Palavras chaves
Biodiesel; Catalisador complexo ; Transesterificação
Introdução
Atualmente, a busca por novos métodos e materiais tem sido bastante empregada para minimizar os impactos ambientais causados pelos combustíveis fósseis, uma das principais fontes de energia. Uma alternativa para diminuir esses problemas tem-se o biodiesel devido a sua biodegradabilidade e baixa toxicidade é uma mistura de ésteres monoalquílicos de cadeia longa produzidos pela reação de transesterificação empregando catalisadores básicos e ácidos. Geralmente a rota mais utilizada na produção o biodiesel é a transesterificação com uso de catalisadores homogêneos alcalinos (KOH ou NaOH), que apresentam grande atividade catalítica. No entanto, esse método gera efluentes industriais. A utilização de catalisadores heterogêneos na produção de biodiesel apresenta algumas vantagens como: maior tolerância à presença de água e ácidos graxos livre, além da possibilidade de reutilização do catalisador (REYERO, ARZAMENDI e GANDÍA, 2014). O CaO puro tem alta propriedade higroscópica (MIRGHIASI et al., 2014), o que dificulta o armazenamento e pode comprometer a atividade catalítica. A combinação de materiais pode melhorar determinada propriedade ou conferir novas características desejadas na catálise. Devido a razões econômicas e ambientais, emergiu na sociedade preocupação a respeito dos impactos causados por transformações químicas no meio ambiente, e esta crescente preocupação, levou à conscientização para o desenvolvimento de processos nos quais obedecem aos critérios de sustentabilidade (ALVIM, 2013), logo metodologias ecologicamente corretas são de grande interesse no cenário mundial; neste sentido o uso de LIs no meio reacional tornou-se uma alternativa atrativa afim de substituir os solventes orgânicos (ACT, 2014), minimizando impactos gerado ao meio ambiente, devido sua baixa toxicidade, por estes serem recicláveis e possuir pressão de vapor desprezível abaixo de sua temperatura de decomposição. Os LIs também têm sido estudados como possíveis fluidos de transferência de calor devido a sua alta capacidade e boa condutividade térmica (FRANÇA et al., 2014) sendo que na “Química Verde” uma das principais estratégias utilizadas consiste na utilização de solventes recicláveis e menos tóxicos em substituição aos convencionais, que geralmente são voláteis e inflamáveis e por isso respondem por grande parte das emissões de efluentes líquidos e gasosos nocivos ao ambiente. (LIMA, 2011). Os catalisadores complexos metálicos são uma classe de catalisadores homogêneos e heterogêneos ainda pouco estudado em alcoólise de óleos vejetais. Compostos de metais tipo M(3-hidroxi-2-metil-4- pirona)2(H2O)2, em que M = Sn, Zn, Pb e Hg, foram ativos sob condições homogêneas para metanólise do óleo de soja e verificou-se ordem decrescente catalítica onde Sn2+ > Zn2+ > Pb2+ ≈ Hg2+. (DA COSTA, 2009). Meneguetti et al. (2011) empregou catalisadores complexos a base de estanho [(C4H9)SnO(OH)-BTA); (C4H9)2SnO – DBTO; (C4H9)2Sn(C12H23O2) – DBTDL] na transesterificação e esterificação de ácidos graxos e do óleo de soja com as seguintes condições, razão molarálcool:óleo 1:1, tempo de retenção, temperatura de 60°C com elevado teor de ésteres. Dentre esses catalisadores sólidos, podemos citar os complexos de coordenação que incluem cpmlexos metálicos de piridina que ainda é incipiente em reação de alcóolise. Esses catalisadores cmplexos metálicos de piridina são empregados em vária reações tipo: clivagem (BABU et al,. 2015), hidrotérmicas (BHALLA et al., 2015), síntese de catalisadores super ácidos (COFFIE et al., 2015), correlações estruturais (PAZDERSKI et al., 2010), hidrogenação (DU et al., 2014), hidroboração (ZHUY et al., 2012) e polimerização (ALLAN et al., 2011). Finashina e colaboradores (2016) empregaram catalisadores complexos de quitosana com diferentes metais (Sn, Zn, Pb, Ca, Co) paraa reação de transesterificação do tributirina e óleo de fritura e os mesmos foram eficientes no processo de conversão a ésteres. Alguns trabalhos publicados relatam a utilização de líquidos iônicos ácidos de Bronsted e Lewis para a síntese de biodiesel a partir de óleos vegetais (GUO et al., 2013; TAO et al., 2010). Neste sentido, os líquidos iônicos e os catalisadores complexos de piridina despontam ser o meio ideal para a realização de reações promovidas para sinteses de biodiesel.
Material e métodos
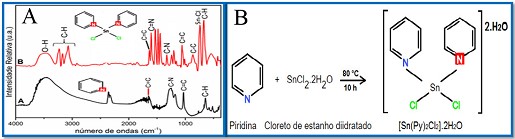
Sintetizou-se o catalisador complexo metálico de piridina clorobis(piridina)estanho(II) diidratado [Sn(Py)2Cl2].2H2O (Figura 1B), caracterizou-se por FT-IR e avaliar a eficiência catalítica deste na reação de transesterificação do óleos vegetais de babaçu e soja com metanol. O catalisador [Sn(Py)2Cl2].2H2O (27,91 g; 0,12 mol) foi sintetizado pela mistura com a piridina (9,49 ml; 0,12 mol), sendo a mistura refluxada sob agitação constante por 10 h à 80 °C, onde este foi purificado com éter de petróleo (25 ml). A secagem do composto foi feita a vácuo a temperatura de 120°C e em seguida foi caracterizado por FT-IR (4000 a 400 cm-1). O biodiesel metílico de babaçu e soja foi sintetizado em um reator Parr modelo 4843 com adição de 50 g do óleo na razão molar (MeOH:óleo) 11:1, quantidade de catalisador 1,5-2,0 %, temperatura de 150-170 °C por 16 h, com agitação de 500 rpm. O teor de ésteres metílicos foi determinado em um Cromatógrafo a gás acoplado com Detector de Ionização em Chamas (CG-DIC) (EN 14103). O catalisador complexo metálico [Sn(Py)2Cl2].2H2O (Figura 1B) foi caracterizado por FT-IR.
Resultado e discussão
Os resultados do FT-IR do catalisador [Sn(Py)2Cl2].2H2O (Figura
1A.B) obteve-se uma banda larga em 3479 cm-1 referente ao estiramento
simétrico da ligação O-H presente na molécula de água coordenada. Observou-
se também os principais modos vibracionais referentes as ligações C-H, C=N,
C-N em 3224 cm-1, 1604 cm-1, 1327 cm-1, respetivamente, de intensidade forte
e moderada. Os modos vibracionais de 1600 e 1500 cm-1 são atribuídos ao
estiramento simétrico do anel piridínio para as ligações C=N e C=C,
respectivamente confirmando a presença do anel aromático nos compostos.
(SILVERSTEIN; WEBSTER; KIEMLE 2010, DUSTAN 2013). Na Figura 1A.A; observou-
se também o aparecimento de modos vibracionais com intensidades média e
forte entre 900–650 cm-1 associados a região de vibração angular fora do
plano dos grupos aromáticos (DUSTAN 2013). Em 547 cm-1, observa-se a ligação
Sn-N do metal estanho com o átomo de nitrogênio no anel aromático com
intensidade fraca.
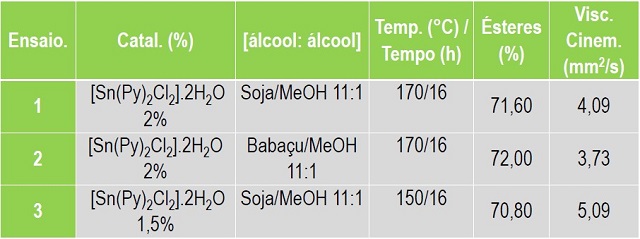
Os resultados utilizando o catalisador clorobis(piridina) estanho
(II) na reação de transesterificação em relação ao rendimento dos ésteres do
Biodiesel Metílico de Babaçu (BMB) e Biodiesel Metílico de Soja (BMS),foi em
média de 72% após 16 h de reação com 2% de catalisador, razão molar
álcool:óleo 11:1 e temperatura de 170 °C; de acordo com a Figura 2.
As medidas de viscosidades cinemática dos biodieseis estão de
acordo com o estabelecido pela ANP (2012), que está na faixa de 3,0-6,0 mm2
s-1. Supõe-se que rendimento encontrado na utilização do catalisador na
reação pode estar relacionado ao ânion hidratado do complexo de estanho e
este poderia hidrolisar e competir com os produtos da reação de transesteri_
ficação. Portanto, o catalisador clorobis(piridina)estanho(II) foi ativo
para a reação de transesterificação do óleo de babaçu e soja.
Conclusões
Conclui-se que o catalisador [Sn(Py)2Cl2].2H2O (Figura 1B)foi sintetizado e caracterizado pelo FT-IR; observou-se que os modos vibracionais demonstram sua estrutura funcional. O clorobis piridina de estanho diidratado mostrou-se ativo para a produção de biodiesel (Figura 2), com teor a ésteres em torno de 72% de conversão e a medida da viscosidade cinemática na faixa de 3,0-5,09 mm2 s-1 estabelecida pela ANP.
Agradecimentos
FAPEMA, IFMA, UFMA, NCCA.
Referências
1 - ACT-AGÊNCIA DE COMERCIALIZAÇÃO DE TECNOLOGIA. Processo de Modificação de Biodiesel ou Outros Substratos de Ácidos Graxos e Seus Derivados por Reações de Epoxidação Através de Catálise Enzimática Suportada em Líquidos Iônicos e Suas Aplicações. REGISTRO Nº PI 1106537-0. Campus Universitário Darcy Ribeiro, Edifício CDT. Brasília – DF. Disponível em: <www.cdt.unb.br/vitrine/files/solucoes/ 120. pdf> Acessado dia:15 jan (2015).
2 - ALLAN et al. Controlled radical polymerization of vinyl acetate mediated by a bis(imino)piridine Vanadium complex. Macromolecules, v. 44, n. 11, p. 4072-4081, 2011.
3 - ALVIM H. G de O.; Efeito de Líquido Iônico Sobre a Reação de Biginelli em Condições de Catálise Homogênea e Heterogênea; Dissertação de Mestrado Apresentada ao Programa de Pós-Graduação em Tecnologias Química e Biológica; Universidade de Brasília Instituto de Química, Brasília; agosto de (2013).
4 - ANP – Res. nº. 14, de 11/05/ 2012. Reg. Técnico n.°04/ 2012. Brasília: Diário Oficial da União, n. 236.
5 - BHALLAR, R et al. Hydrothermal syntesis of Group 13 metal trifçuoride complexes with neutral n-donor ligands. Dalton Trans., v. 44, n. 20, p. 9569-9580, 2015.
6 - COFFIE, S. et al. Lewis Superacidic Ionic Liquids with tricoordinate Borenium Cations. Angewandte Chemie International Edition, v. 54, n. 49, p. 14970-14973, 2015.
7 - DA COSTA, M. M. E. Aplicação de quitosana com íons metálicos impregnados na reação de trasnesterificação de óleo vejetal para a produção de biodiesel. 2009. 56 f. TCC (Graduação) – Curso de Engenharia Química, Universidade Federal do Ceará, Fortaleza, 2009.
8 - DU, W.;WANG. Q.; WANG, L.; YU, Z. Ruthenuim complex catalysts supported by a bis(trifluoromethyl)pyrazolyl-pyridyl-based NNN ligand for transfer hydrogentation of ketones. Organometallics, v. 33, n.4, p. 974-982,2014.
9 – DUSTAN, P. O. Thermochemistryofadductsoftin (IV) chloride with heterocyclic bases Thermochimica Acta, v.398, p. 1-7, 2013.
10 - FRANÇA J. M. P., REIS F., VIEIRA S. I. C., LOURENÇO M. J. V., SANTOS F. J. V., NIETO de CASTRO C. A. e PÁDUA A. A. H.; Thermophysical Properties of Ionic Liquid Dicyanamide (DCA) Nanosystems; J.M.P. França et al. / J. Chem. Thermodynamics 79 (2014) 248–257.
11 - GUO, F. et al. One-step production of biodiesel form jatropha oil with high-acid value in ionic liquids. Bioresource Technology, v. 140, p. 447-450, 2013.
LIMA, P. G.; Micro-ondas na Síntese de Líquidos Iônicos. Revista Virtual de Química, v. 3, n. 4, p. 325-338, out, (2011).
12 - MENEGUETTI, S. M. P.; MENEGUETTI, M. R.; BRITO, Y. C.; DA SILVA, J. P. V.; FERREIRA, D. A. C.; MENDONÇA, R. D. Desenvolvimento de catalisadores de estanho (IV) para a produção de biodiesel. Edição Jun/Julh BiodieselBR, 2011.
13 – SILVERSTAIN, R. WEBSTER, F. X. KIEMLE, D. J. Identificação Espectrofotométrico de Compostos Orgânicos, Rio de Janeiro, LTC, 2010.
14 - TAO, L. et al. Application of Choline Chloride. xZnCl2 Ionic Liquids for preparation of Biodoesel. Chinese Journal of Chemical Engineering, v. 18, n.2, p. 322-327, 2010.
15 - ZHU, Y. et al. Na efficient and recyclable catalytic system comprising nano-iridium (0) and a pyridiniumsalt of nido-Carbonaryldiphosphine for the synthesis of one-dimensional boronate esters via hydrocarboration reaction. Organometallic, v. 31, n. 7, p. 2589-2596, 2012.
16 – WU, Q. et al. Bifunctional temperature-sensitive amphiphilic acidic ionic liquids for preparation of biodiesel. Catalysis Today, v. 200, p. 74-79, 2013.









