APLICAÇÃO DE ÓXIDO DE GRAFENO NO PROCESSO DE HIDROGENAÇÃO ELETROCATALÍTICA DA ISOFORONA.
ISBN 978-85-85905-25-5
Área
Química Verde
Autores
Sales, A. (UFPE) ; Duarte de Menezes, F. (IFPE) ; Vilar, M. (IFPE) ; Freitas de Albuquerque, G. (IFPE) ; Silva Pereira, A.L. (IFPE) ; Oliveira da Silva, A.C. (IFPE)
Resumo
o presente trabalho tem como objetivo demostrar o potencial uso do o óxido de grafeno (OG) como agente catalisador de transferência de fase inversa no processo de HEC da isoforona em água. Para tanto, foram utilizadas diferentes quantidades de OG (2,5, 5,0 7,5 ou 10 mg/L. Os resultados revelaram que a isoforna foi seletivamente hidrogenada gerando como di-hidroisoforona com rendimentos da ordem de 19,5 a 67,5%. O comportamento observado tem relação com o aumento da concentração de isoforona no sistema reacional em decorrência de uma interação entre os sítios anfifílicos do OG com a estrutura da isoforona.
Palavras chaves
óxido de grafeno; hidrogenação; isoforona
Introdução
O grafeno (GF) é definido como um material ordenado, constituído exclusivamente de átomos de carbono com hibridização sp2, cuja expansão se estende em duas dimensões, resultando em uma camada estruturada com morfologia do tipo “favo de mel” (honeycomb) (NOVOSELOV, 2004), com espessura limitada as demissões do átomo de carbono, sendo por isso classificado como um material 2D (HIRSCH, 2010). Devido a sua estrutura singular, o GF apresenta diferenciadas propriedades físicas e químicas, tais como elevada condutividade elétrica e térmica, superiores a vários metais conhecidos, o que justificam o número crescente de publicações relacionadas a diversas aplicações com esse material. Devido as suas propriedades, várias aplicações têm sido desenvolvidas a partir do grafeno, como por exemplo: (1) a utilização do GF na confecção de eletrodos transparentes, sendo este material considerado como um excelente substituto ao óxido de estanho dopado com índio (ITO) (XU; LIU, 2016); (2) desenvolvimentos de compósitos poliméricos reforçados com dispersões de GF, aumentando as propriedades mecânicas dos materiais obtidos (DHAND et al, 2013); (3) transistores do tipo FET, fabricados com GF (SCHWIERZ, 2010); (4) remoção de contaminantes em meio aquoso (SHENG et al, 2016), através de matrizes de suportes contendo GF/óxido de grafeno (GO) (GUO et al, 2016) funcionalizados para aumento de seletividade a contaminantes específicos (VILELA et al, 2016); (5) sensores químicos (LIU et al, 2015) baseados em GF/GO funcionalizados (ZHAO et al, 2016); e (6) produção de nanopartículas (BAK et al, 2016) com efeito de confinamento quântico, ou quantum dots de GF (WANG; ZENG; SUN, 2015), utilizados em uma sucessões de outras aplicações (KE et al, 2016). Desde a redescoberta do grafeno em 2004, diversas metodologias de sínteses têm sido desenvolvidas para a obtenção deste material em diferentes morfologias, homogeneidade ente GF E GO e qualidade no que diz respeito a obtenção de monocamadas isoladas ou agregados de poucas camadas. Dentre as metodologias existentes para a exfoliação em fase líquida do grafite a fim da obtenção do GF e/ou GO, os métodos eletroquímicos aparecem em destaques (YU et al, 2015). Os mecanismos eletroquímicos para a produção do GF e/ou GO podem ser explicados de forma simples (YU et al, 2015): 1) Exfoliação anódica do grafite: este mecanismo baseia-se na intercalação de ânions presentes no eletrólito de suporte, juntamente com outros intercalantes se necessários. Então uma polarização positiva sobre o eletrodo de grafite força a intercalação dos ânions, aumentando a distância entre as camadas de grafeno, facilitando o processo de exfoliação. 2) Exfoliação catódica do grafite: neste caso, a intercalação de cátions é direcionada por uma polarização negativa do eletrodo de grafite, juntamente com outros intercalantes se necessário. Novamente, esta polarização força a intercalação dos íons, favorecendo o processo de exfoliação. Em decorrência de suas características estruturais e de síntese, uma possível aplicação do óxido de grafeno é na área de hidrogenação Eletrocatalítica (HEC). A HEC ocorre mediante as reduções eletroquímicas realizadas em cátodos de metais de transição, envolvendo reações entre substratos insaturados e átomos de hidrogênio adsorvidos na superfície do eletrodo, após serem gerados pela descarga eletrônica de prótons. Uma das vantagens do processo de HEC é a geração de hidrogênio “in situ”, eliminando a necessidade de suprimento de gás hidrogênio, já que o mesmo é produzido sob forma ativa eliminando-se problemas de envenenamento do catalisador (COCHE; MOUTET, 1987), além de apresentar simplicidade experimental, condições mais brandas de realização e produção de hidrogênio controlada através de ajustes da voltagem e densidade de corrente aplicada. Todavia, sabe-se que os rendimentos reacionais da técnica de HEC diminuem com o aumento da hidrofobicidade, pois há uma limitação no transporte de massa entre as fases. Diante do exposto o presente trabalho visa demostrar o potencial uso do o óxido de grafeno como agente catalisador de transferência de fase inversa no processo de HEC da isoforona.
Material e métodos
Os procedimentos eletroquímicos de síntese foram realizados por uma fonte ICEL Manaus PS-1500, utilizando um balão de fundo redondo com 150 ml de capacidade, contendo três entradas: uma para o eletrodo de trabalho, grafite, outra para o contra eletrodo, platina, e uma terceira para retirar alíquotas, sempre que necessário. Os reagentes da síntese correspondem ao ácido cítrico 0,1M e ao citrato de sódio 0,1M em uma solução de 50 ml. Para a síntese do OG foi aplicada uma corrente de 180 mA durante 24h. Ao término das reações, as amostras reacionais foram colocadas na estufa e mantidas a 60ºC até que todo o solvente fosse evaporado. A fim de purificar o OG, retirou-se as amostras da estufa e adicionou-se 5 mL de água destilada, agitou-se e então acrescentou-se 50 mL de isopropanol, mantendo em agitação. Após a separação de duas fases, no qual o sobrenadante apresentava-se turvo e a parte inferior com aspecto oleoso e marrom, a solução permaneceu em repouso por 10 minutos e então se descartou o sobrenadante. Por fim, o óleo formado foi colocado na estufa até secar, e então, realizou-se a raspagem e pesagem do GF e OG purificado. Esse procedimento foi realizado 4 vezes para cada reação. Os procedimentos de HEC foram realizados em um aparelho Autolab PGSTAT101 potenciostato/galvanostato acoplado a um computador através de interface externa USB, utilizando o programa Nova, versão 1.1, usando uma célula eletroquímica de compartimento único de 15 mL de capacidade contendo três entradas: uma para o ânodo de sacrifício de níquel (0,1 dm de diâmetro; 0,078 dm2 área), outra para o eletrodo de trabalho de Ni (0,1 dm de diâmetro e 0,078 dm2 de área) e uma terceira para retirar alíquotas afim de acompanhar o andamento da reação. Antes de iniciar a HEC, um pré-tratamento do material catódico foi feito afim de eliminar qualquer tipo de impureza incrustada na superfície do eletrodo, propiciando uma boa aderência do depósito de níquel oriundo da oxidação do ânodo sacrifício. A preparação da superfície consistiu em lavar o eletrodo de trabalho com álcool 70%, depois utilizar uma lixa para polir o eletrodo, lavando-o novamente, em seguida. Então, montou-se a cela eletroquímica, na qual adicionou-se 10 mL de solução 0,2mol-1 de eletrólito de suporte (NH4Cl), 2,5, 5,0 7,5 ou 10 mg/L de GO e 1,0 mmol da isoforona que ficaram sob agitação durante 1 hora antes de iniciar a reação. Ao iniciar a eletrólise, aplicou-se um gradiente de densidade de corrente de 350, 300, 250, 200 mA dm-2, correspondente a 50, 25, 12,5 e 12,5 % da carga inicialmente necessária, sob agitação. Ao final da reação, os produtos de hidrogenação foram extraídos com éter etílico e analisados por Cromatografia à Gás (Varian 3380 GC), com uma rampa de aquecimento de 60-220ºC (10ºC/min).
Resultado e discussão
A hidrogenação seletiva da ligação C=C das cetonas α,β-insaturadas, deixando intacto
o grupo C=O para a produção de compostos carbonílicos saturados, constitui uma
importante transformação catalítica. A 3,5,5,5-trimetil-2-ciclohexe-1-ona
(Isoforona) é uma cetona -insaturada com um odor semelhante ao da hortelã-
pimenta. A hidrogenação seletiva da ligação C=C no anel da isoforona produz a 3,3,5-
trimetilciclohexanona (di-hidroisoforona), enquanto uma hidrogenação seletiva da
ligação C=O conduz a 3,5,5-trimetil-2-ciclohexen-1-ol (isoforol). A hidrogenação de
ambas as ligações insaturadas leva à formação de 3,3,5-trimetilciclohexanol
(dihidroisoforol). O controle da seletividade através da interrupção da produção de
todos estes subprodutos é uma questão fundamental na catálise. Assim, é muito
importante obter a HEC seletiva da isoforona para produção de di-hidroisoforona, que
é utilizada como solvente em algumas tintas de impressão, resinas vinílicas, tintas,
lacas, vernizes e outros revestimentos.
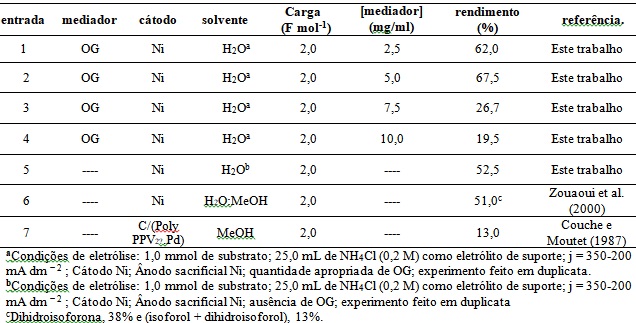
No presente estudo, a isoforna foi seletivamente hidrogenada após o consumo de 2 F
mol-1, gerando como produto apenas di-hidroisoforona com rendimentos
da ordem de 19,5 a 67,5% (Tabela 1, entradas 1-4). Com objetivo de
analisar a influência do OG no processo de HEC da isoforona, foram realizados
estudos com diferentes concentrações do óxido. Neste sentido, foram utilizadas as
concentrações de 2,5, 5,0 7,5 ou 10 mg/L de OG no sistema reacional. De acordo com
a Tabela 1 (entradas 1 e 2), observa-se que o aumento da concentração de OG aumenta
os rendimentos reacionais, sendo este fator mais pronunciado ao se utilizar uma
concentração de 5,0 mg/ml de solução. Este comportamento tem relação com o aumento
da concentração de isoforona no sistema reacional em decorrência de uma interação
entre os sítios anfifílicos do OG com a estrutura da isoforona.
Desta forma, há um aumento da transferência de massa da espécie eletroativa até a
superfície do eletrodo, ou seja, quanto maior a concentração de substrato adsorvido
na superfície do catalisador, maior será a probabilidade de reação entre esta
espécie e o hidrogênio adsorvido levando a uma elevação nos rendimentos reacionais.
Todavia, ao utilizar uma concentração superior a 7,0 mg/ml de OG, observa-se uma
diminuição dos rendimentos reacionais. Este fato pode estar relacionado ao aumento
da conjugação/complexação entre OG e o substrato, diminuindo o transporte de massa
do substrato até superfície do catalisador. Por fim, observa-se que para as
condições experimentais empregadas, o uso de 5,0 mg/ml de OG promove os melhores
rendimentos reacionais quando comparada tanto a reação controle (52,5%, Tabela 1,
entrada 5) quanto a outras reações descritas na literatura (Tabela 1, entradas 6 e
7) sendo este comportamento atribuído ao aumento da concentração de isoforona no
meio reacional corroborando as discussões anteriores.
HEC da isoforona em presença de OG.
Conclusões
Observou-se que a presença de OG no sistema reacional de HEC da isoforona influenciam a taxa de conversão do produto, sendo este efeito mais pronunciado com o uso de uma concentração de 5,0 mg/ml de OG. Nesta concentração, observou-se um aumento de 15% nos rendimentos reacionais quando comparado a reação controle, e de 16,5 a 54,5% em relação ao outros métodos de HEC descritos na literatura. Finalmente, a utilização do OG como carbocatalisador de transferência de fase inversa é uma metodologia promissora para promover a ECH-SA de isoforona e derivados a,b- insaturados em água, uma vez que o OG é uma substância ambientalmente amigável, solúvel em água, não tóxica e mais barata que outros catalisadores de transferência de fase convencionais.
Agradecimentos
ao IFPE, a FACEPE e ao CNPq pelo apoio financeiro.
Referências
BAK, S.; KIM, D.; LEE, H., Current Aplied Physics, vol. 16 (9) (2016), 1192.
COCHE, Liliane; MOUTET, Jean Claude. Electrocatalytic hydrogenation of organic compounds on carbon electrodes modified by precious metal microparticles in redox active polymer films. Journal Of The American Chemical Society, [s.l.], v. 109, n. 22, p.6887-6889, out. 1987. American Chemical Society (ACS). http://dx.doi.org/10.1021/ja00256a072
DHAND, Vivek et al. A Comprehensive Review of Graphene Nanocomposites: Research Status and Trends. Journal Of Nanomaterials, [s.l.], v. 2013, p.1-14, 2013. Hindawi Limited. http://dx.doi.org/10.1155/2013/763953.
GUO, Yongfu et al. Removal of anionic azo dye from water with activated graphene oxide: kinetic, equilibrium and thermodynamic modeling. Rsc Advances, [s.l.], v. 6, n. 46, p.39762-39773, 2016. Royal Society of Chemistry (RSC). http://dx.doi.org/10.1039/c6ra03423c.
HIRSCH, Andreas. The era of carbon allotropes. Nature Materials, [s.l.], v. 9, n. 11, p.868-871, 22 out. 2010. Springer Nature. http://dx.doi.org/10.1038/nmat2885
ILELA, Diana et al. Graphene-Based Microbots for Toxic Heavy Metal Removal and Recovery from Water. Nano Letters, [s.l.], v. 16, n. 4, p.2860-2866, 24 mar. 2016. American Chemical Society (ACS). http://dx.doi.org/10.1021/acs.nanolett.6b00768
KE, C.; YANG, Y.; TSENG, W., Particle & Particle Systems Characterization, vol. 33 (3) (2016), 132.
NOVOSELOV, K. S.. Electric Field Effect in Atomically Thin Carbon Films. Science, [s.l.], v. 306, n. 5696, p.666-669, 22 out. 2004. American Association for the Advancement of Science (AAAS). http://dx.doi.org/10.1126/science.1102896
SCHWIERZ, Frank. Graphene transistors. Nature Nanotechnology, [s.l.], v. 5, n. 7, p.487-496, 30 maio 2010. Springer Science and Business Media LLC. http://dx.doi.org/10.1038/nnano.2010.89.
SHENG, Guanghong et al. Removal of dyes by a novel fly ash–chitosan–graphene oxide composite adsorbent. Rsc Advances, [s.l.], v. 6, n. 22, p.17987-17994, 2016. Royal Society of Chemistry (RSC). http://dx.doi.org/10.1039/c5ra22091b.
WANG, Zhaofeng; ZENG, Huidan; SUN, Luyi. Graphene quantum dots: versatile photoluminescence for energy, biomedical, and environmental applications. Journal Of Materials Chemistry C, [s.l.], v. 3, n. 6, p.1157-1165, 2015. Royal Society of Chemistry (RSC). http://dx.doi.org/10.1039/c4tc02536a
XU, Yuanhong; LIU, Jingquan. Graphene as Transparent Electrodes: Fabrication and New Emerging Applications. Small, [s.l.], v. 12, n. 11, p.1400-1419, 8 fev. 2016. Wiley. http://dx.doi.org/10.1002/smll.201502988
YU, Pei et al. Electrochemical exfoliation of graphite and production of functional graphene. Current Opinion In Colloid & Interface Science, [s.l.], v. 20, n. 5-6, p.329-338, out. 2015. Elsevier BV. http://dx.doi.org/10.1016/j.cocis.2015.10.007.
ZOUAOUI, Ahmed et al. Electrocatalytic hydrogenation of ketones and enones at nickel microparticles dispersed into poly(pyrrole-alkylammonium) films. Electrochimica Acta, [s.l.], v. 46, n. 1, p.49-58, out. 2000. Elsevier BV. http://dx.doi.org/10.1016/s0013-4686(00)00533-8.
ZHAO, Y.; LI, X.; ZHOU, X.; ZHANG, Y., Sensors and Actuators B: Chemical, vol. 231 (2016), 324









